Los pacientes con LMC tienen una esperanza de vida normal cuando son tratados con inhibidores de la cinasa específicos de Abl (TKI) en fase crónica. El imatinib, el dasatinib y el nilotinib están aprobados para el tratamiento de primera línea de la LMC. En caso de resistencia o intolerancia, el bosutinib y el ponatinib están disponibles como alternativas a los TKI. El objetivo de la terapia es lograr una remisión molecular profunda (RM). Este es un prerrequisito para los conceptos de interrupción de TKI y el logro de la remisión libre de terapia (TFR). Los mecanismos biológicos que subyacen a una TGF no se conocen con precisión, pero probablemente estén mediados inmunológicamente. Es posible que la terapia temporal con interferón alfa (IFN) o con inhibidores de los puntos de control inmunitarios pueda aumentar la tasa de TFR. Estas cuestiones se están abordando actualmente en ensayos clínicos.
Todo paciente con LMC debe ser tratado con un TKI específico de Abl aprobado en terapia de primera línea. Una respuesta oportuna a la terapia molecular es relevante para el pronóstico. Para poder evaluar esto, es esencial el registro regular de la carga de ARNm de BCR-ABL (cada tres meses hasta que se consiga una MMR estable, y después al menos cada seis meses) durante la terapia con TKI [1]. El número de copias de BCR-ABL se mide en laboratorios normalizados y se estandariza en la unidad internacional “IS” [2]. La carga de BCR-ABL tras la IS se pronuncia sobre la profundidad de la remisión alcanzada. La disminución del número de copias de BCR-ABL en sangre periférica se expresa en pasos logarítmicos desde el valor basal en el momento del diagnóstico. Simplificado, un MR3 (MMR) corresponde a una disminución de la carga de BCR-ABL de tres niveles logarítmicos, un MR4 corresponde a una disminución de cuatro niveles logarítmicos, etc.
La medición de la carga de BCR-ABL en función del tiempo de terapia permite una evaluación de la respuesta y, si es necesario, el cambio de terapia en caso de resistencia terapéutica [1]. En caso de resistencia, comorbilidades o intolerancia, los inhibidores de Abl como bosutinib o ponatinib están disponibles como alternativas de tratamiento además de las terapias de primera línea.
El trasplante alogénico de células madre (allo-SCT) es una opción de tratamiento que normalmente sólo está indicada en pacientes con LMC avanzada o LMC refractaria a múltiples TKI.
Interferón alfa (IFN)
La monoterapia con IFN no es muy eficaz en los pacientes con LMC.
En cambio, la terapia combinada de imatinib o un TKI de segunda generación (nilotinib, dasatinib) con interferón alfa pegilado (IFN) es muy eficaz. La RM profunda se consigue más rápidamente y en un número significativamente mayor de pacientes con la combinación que con los TKI solos [3–5]. En estudios no controlados, la terapia de mantenimiento con IFN tras la terapia combinada precedente también indujo una tasa elevada de TFR [6,7].
Objetivos de la terapia en la fase crónica
El objetivo principal de la terapia con TKI en la LMC es lograr una remisión molecular lo antes posible, que debe estar al menos en el rango de una MMR (MR3). Esto es importante porque la remisión molecular profunda protege contra la progresión de la enfermedad y normaliza la supervivencia global con la LMC [8–10].
El objetivo terapéutico secundario es la rápida consecución de un MR profundo (por ejemplo, en el sentido de un MR4, MR4,5 o MR5), ya que esto permite la inclusión en los conceptos de interrupción de los TKI.
Remisión libre de tratamiento (“RFT”)
Originalmente, la terapia con TKI para la LMC se diseñó para ser continua, ya que pronto quedó claro que los inhibidores de BCR-ABL (imatinib, dasatinib, nilotinib) no podían erradicar las células madre de la LMC [11,12].
Sorprendentemente, informes de casos clínicos y estudios posteriores (STIM, STIM-2, EURO-SKI) demostraron que alrededor del 50% de los pacientes que han sido tratados con imatinib durante muchos años y que, por tanto, han alcanzado un MR4,5 estable, pueden hacer una pausa en el imatinib sin sufrir una recaída molecular (rebote de la carga de BCR-ABL o pérdida de un MMR) [13–17].
Hasta ahora, los mecanismos que subyacen a una TGF son poco conocidos. Por lo tanto, actualmente no se han establecido estrategias terapéuticas probadas para aumentar la tasa de TGF. Sin embargo, se presupone el control inmunológico de las células de LMC residuales por parte de las células T y las células NK. Los factores asociados a una tasa de TFR significativamente mayor son la duración de la preterapia con imatinib (más de 5,8 años) y la duración de una MR4 (más de 3,1 años). El número de células dendríticas plasmocitoides maduras (CD86+pDC) y de células NK maduras es un marcador biológico potencial asociado a una mayor tasa de TFR [18,19].
Conceptos para mejorar la tasa de TGF
Conseguir la remisión libre de tratamiento en el mayor número posible de pacientes es el ambicioso objetivo de los conceptos actuales de terapia de primera línea para la LMC (CML-V, Tiger) y de los estudios de interrupción (NAUT, ENDURE, INCEPTION).
El estudio ENDURE, que comenzará en breve en 15 centros de Alemania, está probando si una terapia de mantenimiento con IFN de 15 meses puede reducir la tasa de recidivas moleculares en 214 pacientes sometidos a RM profunda (al menos RM4) (Fig. 1). El IFN utilizado es el Ropeg-IFN (AOP2014). El Ropeg-IFN es un nuevo IFN con una semivida más larga y, por tanto, mejor tolerado que los IFN pegilados disponibles anteriormente. El preparado sólo necesita inyectarse cada 14 días.
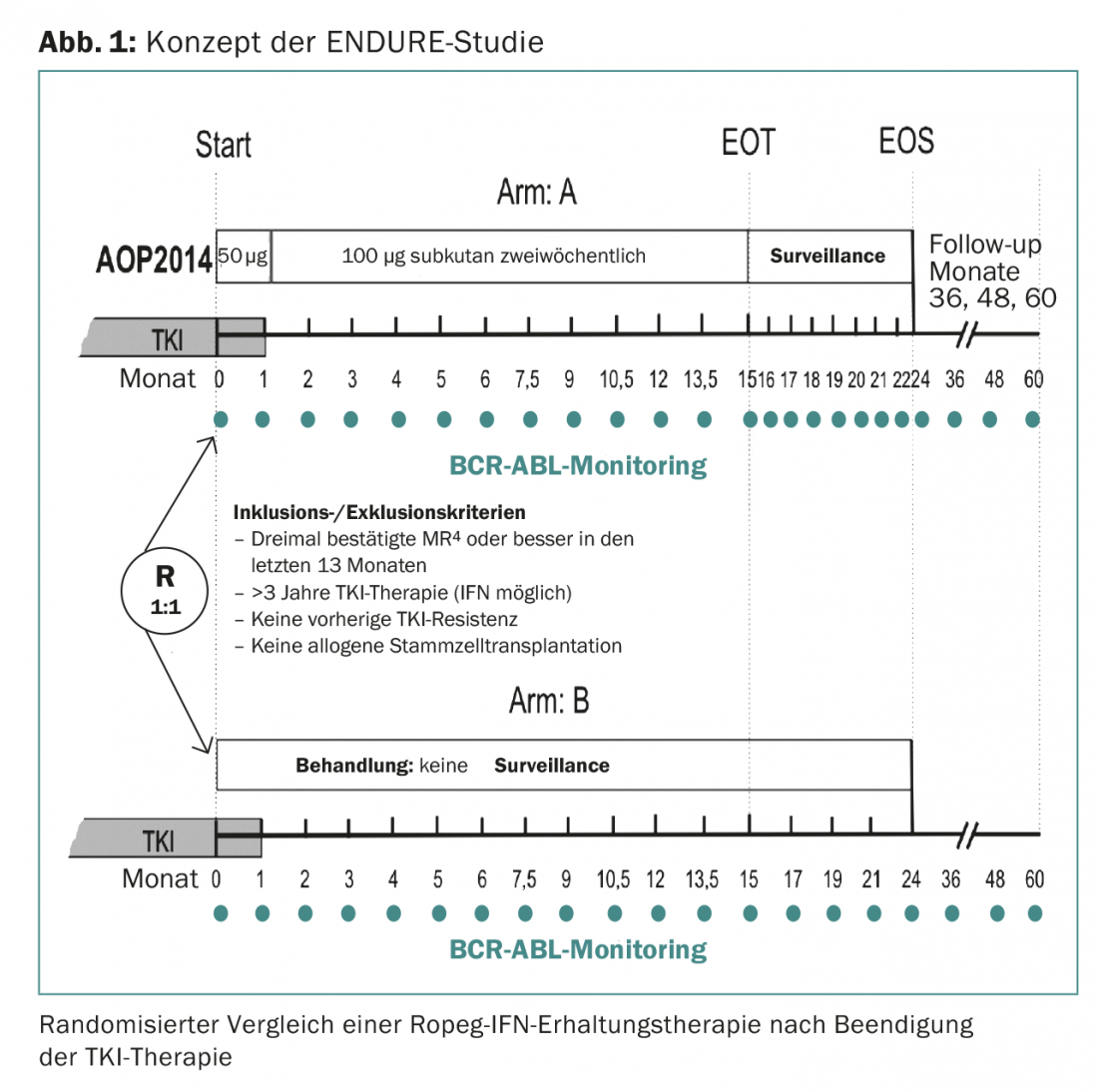
Pronto se probará otro concepto terapéutico innovador en el estudio INCEPTION. Aquí, los pacientes tras la pausa de TKI -estratificados por fenotipo de células T de agotamiento e inmunofenotipo de pDC- se tratan aleatoriamente con los inhibidores de los puntos de control nivolumab e ipilimumab.
Outlook
Con la introducción de los TKI como terapia estándar para la LMC, la supervivencia con esta enfermedad se ha normalizado. El objetivo de la futura terapia de la LMC es lograr una RM profunda y una liberación del tratamiento segura y a largo plazo en el mayor número posible de pacientes.
Literatura:
- Baccarani M, et al: Recomendaciones de la European LeukemiaNet para el tratamiento de la leucemia mieloide crónica: 2013. Blood 2013; 122: 872-884.
- Cross NCP, et al: Recomendaciones de laboratorio para la puntuación de respuestas moleculares profundas tras el tratamiento de la leucemia mieloide crónica. Leucemia 2015; 29: 999-1003.
- Simonsson B, et al: La combinación de IFN-α2b pegilado con imatinib aumenta las tasas de respuesta molecular en pacientes con leucemia mieloide crónica de riesgo bajo o intermedio. Sangre 2011; 118: 3228-3235.
- Preudhomme C, et al: Imatinib más peginterferón alfa-2a en la leucemia mieloide crónica. N Engl J Med 2010; 363: 2511-2521.
- Nicolini FE, et al: Nilotinib y peginterferón alfa-2a para la leucemia mieloide crónica en fase crónica recién diagnosticada (NiloPeg): un estudio de fase 2 multicéntrico, no aleatorizado y abierto. Lancet Haematology 2015; 2: e37-e46.
- Burchert A, et al.: Respuesta molecular sostenida con interferón alfa de mantenimiento tras la terapia de inducción con imatinib más interferón alfa en pacientes con leucemia mieloide crónica. J Clin Oncol 2010; 28: 1429-1435.
- Burchert A, et al: La terapia de mantenimiento con interferón alfa 2 (IFN) puede permitir altas tasas de interrupción del tratamiento en la leucemia mieloide crónica (LMC). Leucemia 2015; 29: 1331-1335.
- Hehlmann R, et al: Deep Molecular Response Is Reached by the Majority of Patients Treated With Imatinib, Predicts Survival, and Is Achieved More Quickly by Optimized High-Dose Imatinib: Results From the Randomized CML-Study IV. J Clin Oncol 2014 Feb 10; 32(5): 415-423.
- Hehlmann R, et al: Tolerability-adapted imatinib 800 mg/d versus 400 mg/d versus 400 mg/d más interferón-α en la leucemia mieloide crónica de diagnóstico reciente. J Clin Oncol 2011; 29: 1634-1642.
- Bower H, et al: La esperanza de vida de los pacientes con leucemia mieloide crónica se aproxima a la de la población general. J Clin Oncol 2016; 34: 2851-2857.
- Graham SM, et al: Las células madre primitivas, quiescentes y positivas para Filadelfia de pacientes con leucemia mieloide crónica son insensibles al STI571 in vitro. Sangre 2002; 99: 319-325.
- Jørgensen HG, et al: El nilotinib ejerce efectos antiproliferativos equipotentes al imatinib y no induce la apoptosis en las células CD34+ de la LMC. Sangre 2007; 109: 4016-4019.
- Mahon FX, et al: Interrupción del imatinib en pacientes con leucemia mieloide crónica que han mantenido una remisión molecular completa durante al menos 2 años: el ensayo prospectivo y multicéntrico Stop Imatinib (STIM). Lancet Oncol 2010; 11: 1029-1035.
- Rousselot P, et al: Interrupción del mesilato de imatinib en pacientes con leucemia mielógena crónica en remisión molecular completa durante más de 2 años. Sangre 2007; 109: 58-60.
- Rousselot P, et al: Loss of Major Molecular Response As a Trigger for Restarting Tyrosine Kinase Inhibitor Therapy in Patients With Chronic-Phase Chronic Myelogenous Leukemia Who Have Stopped Imatinib After Durable Undetectable Disease. J Clin Oncol 2013; 32: 424-430.
- Ross DM, et al: Seguridad y eficacia del cese del imatinib en pacientes con LMC con enfermedad mínima residual estable indetectable: resultados del estudio TWISTER. Sangre 2013; 122: 515-522.
- Mahon FX, et al: Análisis provisional de un ensayo paneuropeo de inhibidores de la tirosina cinasa de parada en la leucemia mieloide crónica: el estudio EURO-SKI. Sangre 2014; 124: 151.
- Ilander M, et al: El aumento de la proporción de células NK maduras se asocia a la interrupción satisfactoria del imatinib en la leucemia mieloide crónica. Leucemia 2016. DOI: 10.1038/leu.2016.360 [Epub ahead of print].
- Schütz C, et al.: La expresión del ligando CD86 de CTLA-4 en las células dendríticas plasmocitoides (pDC) predice el riesgo de recurrencia de la enfermedad tras la interrupción del tratamiento en la LMC. Leucemia 2017. DOI: 10.1038/leu.2017.9 [Epub ahead of print].
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(1): 17-19