En una disección aórtica aguda, la pared aórtica se desgarra primero desde el interior, provocando la separación de las capas de la pared. El resultado: se crea un lumen adicional. ¿Qué hacer?
En una disección aórtica aguda, la pared aórtica se desgarra primero desde el interior y la separación resultante de las capas de la pared (íntima-media de la adventicia) crea una luz adicional (que denominamos luz verdadera) además de la luz original del vaso (que denominamos luz falsa). El correlato clínico es el dolor torácico agudo, a menudo migratorio. La clasificación clásica da una disección que afecta a la aorta ascendente, la definición disección de tipo A, una disección que afecta al arco aórtico sin la aorta ascendente, la definición disección de tipo No-A-No-B y una disección que afecta a la aorta descendente, la definición disección de tipo B [1].
La localización del desgarro primario (entrada) determina el curso clínico de la disección aórtica aguda. El principio esencial de la enfermedad subyacente es que, tras desarrollarse la entrada primaria, se produce una propagación en la pared aórtica con y contra el flujo sanguíneo, lo que conduce a un ensanchamiento de la disección [2].
La localización de la entrada primaria puede asignarse a menudo a un segmento aórtico. Sin embargo, sólo su extensión final a lo largo y en contra del flujo sanguíneo determina el curso clínico, nuestra definición de la enfermedad (tipo A, tipo no A-no B o tipo B) y la consiguiente medida terapéutica invasiva inmediata o retardada además de la terapia farmacológica, que inicialmente consiste sobre todo en bajar la presión arterial [3,4].
Propagación contra el torrente sanguíneo
La disección aguda con entrada primaria en la aorta ascendente, independientemente de su propagación y extensión, se denomina siempre disección de tipo A y la reparación quirúrgica aguda es el patrón oro, ya que la propagación retrógrada a la raíz aórtica provoca una regurgitación aguda de alto grado de la válvula aórtica debido al prolapso comisural y la transudación a través de la pared aórtica provoca un taponamiento pericárdico. En este caso, la rotura aórtica es un proceso metacrónico que puede producirse inmediatamente, con un retraso de tiempo o, en casos individuales, no producirse en absoluto [5].
Una entrada primaria en la aorta descendente se denomina disección de tipo B, pero de nuevo, la localización de la entrada primaria y la extensión marcan una diferencia significativa en el tratamiento, o si una disección aguda de tipo B ya ha causado complicaciones, o se esperan complicaciones, o si es probable que la disección no presente complicaciones. Definimos como “complicada” la aparición de una malperfusión de órganos debida a una obstrucción dinámica o estática a través de la membrana de disección de las ramas laterales o terminales de la aorta (médula espinal, estómago/intestino, riñón y extremidades); pero también se califican como cursos “complicados” los síntomas de dolor persistente (el dolor es un biomarcador muy bueno en el curso de los primeros días) y una diferencia de presión arterial entre las extremidades superiores e inferiores (en el sentido de una pseudocoartación causada por la membrana de disección). Cualquier forma de derrame pleural sanguinolento y, comprensiblemente, cualquier forma de rotura cubierta y descubierta también se puntúan como “complicadas”. Si todos los síntomas mencionados anteriormente están ausentes, hablamos de una disección de tipo B “no complicada”, siempre que el diámetro total de la aorta disecada no supere los 40 mm.
Consideramos que las disecciones son “potencialmente complicadas” si cumplen criterios morfológicos que a menudo preceden a las complicaciones mencionadas anteriormente, los más importantes son la localización de la entrada primaria en la cara interna del arco aórtico (porque en la propagación retrógrada ninguna barrera anatómica puede detener la progresión del proceso hacia el arco aórtico y hacia la aorta ascendente, que a menudo se ve impedida en la cara externa del arco por los vasos de la cabeza y el cuello) y una distancia corta entre la entrada primaria y la arteria subclavia izquierda (aquí se consideran cortas las distancias inferiores a 2 cm) [2,6,7].
Propagación a lo largo del torrente sanguíneo
Durante muchos años nos hemos centrado casi exclusivamente en la propagación a lo largo del torrente sanguíneo, lo que es intuitivamente correcto, ya que una entrada primaria situada inmediatamente a nivel de la arteria subclavia izquierda sólo muestra su efecto en los segmentos aórticos descendentes, especialmente a nivel de los vasos viscerales y renales, a través del colapso del lumen verdadero con una mala perfusión de los órganos terminales afectados. [3,8].
Mecanismos de la mala perfusión de órganos
La causa principal es la compresión estática o dinámica del lumen verdadero. La presencia o ausencia de mala perfusión depende en gran medida de la localización de la entrada primaria y de la dinámica de la membrana disecante a lo largo del ciclo cardiaco, teniendo la localización de la entrada primaria en segmentos aórticos angulados (como el arco aórtico y la aorta descendente proximal) una mayor correlación con la aparición de mala perfusión [2–5].
Mecanismos de formación del aneurisma
La razón principal de la formación de aneurismas es la diferencia de presión sanguínea entre el lumen verdadero y el falso y el ángulo en el que el flujo sanguíneo golpea la pared aórtica. Estos factores están determinados a su vez por la localización de la entrada primaria y también por el número y el tamaño de las comunicaciones entre las luminarias (antes también denominadas entradas y reentradas múltiples). Otro factor importante es el tamaño de la comunicación más distal entre las luces o también como desgarro más distal (reentrada), ya que -en el caso de una reentrada pequeña o ausente- la presión arterial media en la falsa luz puede ser significativamente mayor que en la verdadera luz, lo que provoca un aumento de la resistencia periférica [9,10].
Estrategia terapéutica activa
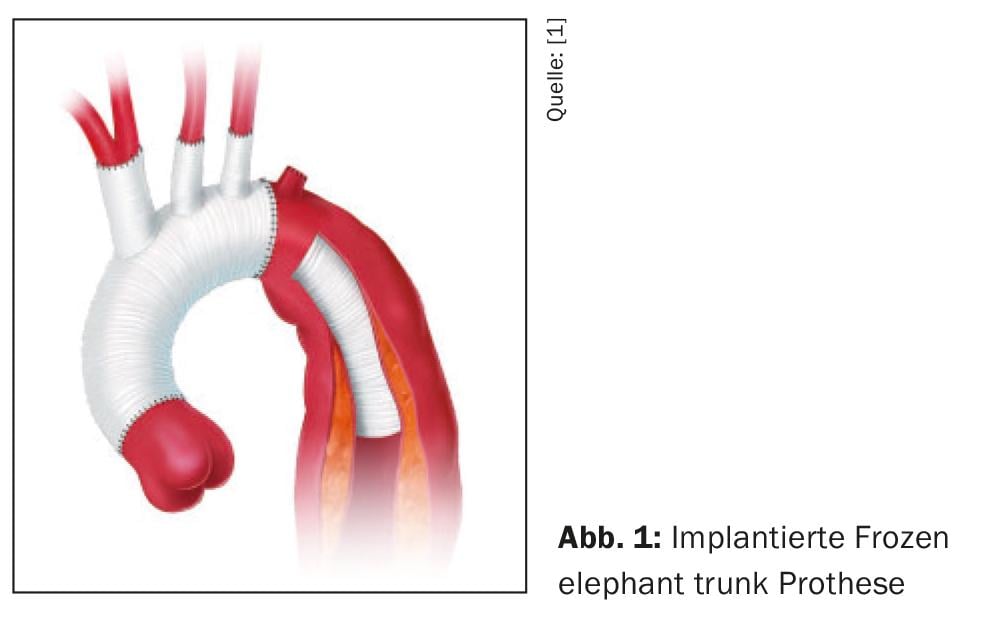
El principio básico de cualquier estrategia terapéutica activa es siempre cerrar la entrada primaria, ya sea mediante resección y sustitución del vaso en cirugía abierta o excluyendo la entrada primaria del torrente sanguíneo mediante la inserción de un stent-injerto, ya sea como “reparación aórtica endovascular torácica (TEVAR)” o en cirugía abierta mediante la denominada técnica de la trompa de elefante congelada (FET). (Fig. 1). La aproximación resultante del cilindro íntima-media y la adventicia conduce a una descompresión de la luz verdadera con el restablecimiento simultáneo de los diámetros transversales regulares de los segmentos aórticos descendentes y, por tanto, a una estabilización de la membrana de la disección, Sin embargo, el número y el tamaño de la comunicación entre las luces también influyen, por lo que siempre es necesario realizar un alargamiento de la endoprótesis cubierta, ya que las grandes comunicaciones entre las luces pueden seguir provocando síndromes de mala perfusión persistentes a pesar del cierre satisfactorio de la entrada primaria. Por lo tanto, en casos individuales también es necesario colocar endoprótesis no cubiertas (abiertas) sobre las salidas de los vasos viscerales y renales.
Salida de las grandes ramas laterales del lumen verdadero y/o falso
En el transcurso del evento agudo, todas las ramas continúan inicialmente apartándose del lumen verdadero, y los cilindros íntima/media de las grandes ramas laterales se extienden inicialmente como tubos a través del falso lumen recién creado hasta el órgano terminal respectivo. Dado que estos cilindros de íntima/media son muy frágiles, a menudo se desgarran tarde o temprano dentro de la falsa luz, lo que morfológicamente da lugar a la circunstancia de salida de la falsa luz. Es esencial ser consciente de que se trata de un efecto secundario y de que la comunicación resultante entre las luminarias es siempre del tamaño del diámetro de salida de la rama lateral. Por este motivo, el flujo sanguíneo a través de esta comunicación entre el lumen verdadero y el falso es suficiente para la perfusión de los órganos finales en la mayoría de los casos, y la oclusión de la entrada primaria con la prevención de la perfusión en el lumen falso no tiene ningún efecto adverso sobre el flujo sanguíneo a los órganos finales respectivos, independientemente de si se ha utilizado cirugía abierta, TEVAR o la técnica FET. [12].
Resumen de la fisiopatología
Siempre hay que ser consciente de que las definiciones actuales (disección de tipo A, de tipo no A-no B, de tipo B) son sólo aproximaciones para describir el mismo proceso fisiopatológico en el que el inicio (entrada primaria) y el final respectivo (a lo largo y en contra del flujo sanguíneo) de la disección marcan la diferencia fundamental en el curso clínico y la necesidad de una estrategia de tratamiento activa.
¿Cuál es la mejor estrategia de tratamiento para la disección de tipo B no complicada?
Durante muchos años, el curso clínico de la disección aguda de tipo B se interpretó como la disección aórtica “inofensiva” (sobre todo en comparación con la disección de tipo A, a menudo dramática), ya que rara vez era necesario actuar en la situación aguda [13]. Sin embargo, un examen más detallado de la historia natural de la enfermedad ha demostrado que un gran número de pacientes desarrollan complicaciones en momentos determinados y necesitan entonces un tratamiento activo [14]. Se ha descubierto que las causas y el momento de aparición varían, predominando la mala perfusión de órganos, la propagación retrógrada al arco aórtico y la aorta ascendente (disección retrógrada de tipo A) en la fase aguda de la enfermedad y luego la formación de aneurismas en las fases subaguda y crónica [15]. La respuesta a la pregunta de qué pacientes tomarán qué curso primario y quiénes desarrollarán complicaciones secundarias se ha mostrado principalmente en parámetros morfológicos y funcionales y ha llevado a la definición de grupos de alto riesgo [16,17].
Momento de la enfermedad
La fase aguda se define desde el inicio inmediato del episodio de dolor primario hasta el día 14 posterior, entre el día 15 y el 90 se habla de fase subaguda y a partir del día 91 de fase crónica [13].
EN VEZ DE JUICIO
El ensayo INSTEAD (Investigation of STEnt Grafts in Aortic Dissection) y el seguimiento a largo plazo (ensayo INSTEAD-XL) compararon de forma prospectiva si la implantación profiláctica adicional de endoprótesis cubierta (TEVAR) tiene alguna ventaja sobre el tratamiento farmacológico óptimo solo en pacientes con disección de tipo B no complicada entre 2 y 52 semanas después del evento agudo. Después de 5 años, los pacientes que recibieron TEVAR profiláctica adicional mostraron un efecto positivo significativo en la supervivencia relacionada con la aorta y la progresión de la enfermedad subyacente [18,19].
Ensayo ADSORB
El ensayo ADSORB (Acute Dissection Stent Grafting or Best Medical Treatment) comparó prospectivamente si la TEVAR adicional tiene una ventaja sobre la terapia médica óptima sola en pacientes con disección aguda de tipo B no complicada entre 0 y 2 semanas después del evento agudo. El criterio de valoración primario aquí fue una combinación del estado de trombosis del lumen verdadero y, dilatación aórtica o acontecimientos aórticos adversos (rotura) al año. La conclusión extraída fue que la TEVAR podía lograr tanto una remodelación aórtica positiva como una reducción del diámetro con trombosis consecutiva (intencionada) de la falsa luz, pero que había que esperar a los resultados a largo plazo, que no están disponibles en este momento [20].
Estos dos estudios representan el mayor nivel de evidencia disponible en este momento. El ensayo INSTEAD XL, en particular, ha dado lugar a una modificación de las últimas directrices de la ESC sobre la aorta y ha elevado la TEVAR profiláctica en la disección de tipo B no complicada a una recomendación de clase IIA, nivel B.
Evolución natural de la disección tipo B no complicada
Tras la fase aguda, se produce la cronificación y la membrana disecante se encuentra en una fase de transición entre el estado agudo, altamente elástico y frágil, a un estado estático. El efecto de la reposición completa de las capas de la pared es mejor en las primeras semanas tras el acontecimiento agudo [21]. Es muy raro que complicaciones como la mala perfusión de órganos o la propagación retrógrada a la aorta ascendente (disección retrógrada de tipo A) sigan produciéndose en esta fase; sin embargo, siempre se produce un aumento del diámetro transversal máximo de la aorta. Esta circunstancia de aumento de diámetro puede anticiparse sobre la base de criterios morfológicos o rastrearse en controles de angiografía por tomografía computerizada (ATC ) y puede detenerse mediante TEVAR en una fase temprana y, en el mejor de los casos, revertirse [16].
Estrategia de tratamiento óptimo para la disección aguda no complicada de tipo B
Basándonos en las pruebas actualmente disponibles, es correcto recomendar un tratamiento farmacológico óptimo como base del tratamiento de cualquier disección aguda de tipo B. Un análisis morfológico preciso permite identificar los subgrupos de alto riesgo que se benefician pronósticamente de una TEVAR precoz. Se trata en definitiva de muchos pacientes, en algunos colectivos hasta el 80%. El ensayo INSTEAD y su seguimiento a 5 años (ensayo INSTEAD XL) nos proporcionan las mejores pruebas disponibles en la actualidad sobre el beneficio de una estrategia endovascular en pacientes con disección de tipo B no complicada. Debe considerarse la TEVAR profiláctica si la anatomía es adecuada [19]. En los últimos años, esta ampliación de conocimientos ya se ha plasmado en directrices internacionales y documentos de consenso de expertos [22,23].
Caso práctico 1 – Disección aguda complicada de tipo BUn hombre de 57 años sufre un dolor torácico agudo y repentino que comienza entre los omóplatos y se irradia a la ingle. Al cabo de 5 minutos, desarrolla primero alteraciones sensitivas y después paraparesia y finalmente paraplejia de la extremidad inferior derecha; el médico de urgencias llamado al lugar detecta clínicamente un déficit de pulso en la ingle derecha y sospecha una disección aórtica aguda a la vista de los síntomas de dolor errante y del déficit de pulso. Además, el paciente desarrolla clínicamente un abdomen agudo con dolor y guardias. Se le traslada al servicio de urgencias más cercano, donde se le realiza una ATC de toda la aorta según el diagnóstico sospechado. Resultado de la ATC: La ATC muestra una disección de tipo B con la entrada primaria en el arco aórtico interno esencialmente sin distancia a la arteria subclavia izquierda. Hay colapso del lumen verdadero a nivel de los vasos viscerales y renales y la arteria ilíaca común derecha también está ocluida funcionalmente. Curso clínico: El lactato sérico sube a 10 mmol/l y la diuresis se detiene. Existe una necesidad imperiosa de actuar para cerrar la entrada primaria con el fin de descomprimir el lumen verdadero y restablecer el flujo sanguíneo a los segmentos aórticos descendentes y a la extremidad inferior derecha. Constelación favorable a una TEVAR primaria. Como parte del diagnóstico de la ATC, también se examinaron los vasos de la cabeza y el cuello. La arteria vertebral izquierda es pequeña y no contribuye a la competencia del Círculo de Willisi. En esta constelación, puede realizarse una TEVAR primaria con sobreprótesis de la salida de la arteria subclavia izquierda para resolver la situación aguda, la probabilidad de desencadenar una isquemia aguda de las extremidades superiores es baja, pero debe realizarse una medición periférica de la saturación de oxígeno en el brazo izquierdo y el procedimiento posterior debe depender además de la evolución clínica (claudicación de esfuerzo). Constelación que favorece la TEVAR y la revascularización simultánea de la arteria subclavia izquierda: La arteria vertebral izquierda es un vaso muy grande y el círculo de Willisi está interrumpido, lo que significa que en el caso de una arteria vertebral derecha hipoplásica, la arteria izquierda tiene una importancia fundamental. Por lo tanto, se realiza un bypass carótido-subclavio antes de la implantación del stent-graft para preservar la circulación cerebral posterior y conservar el flujo de entrada en la arteria espinal anterior (evitando la isquemia posterior de la médula). Constelación que favorece la implantación del FET primario: La paciente tiene una aorta ascendente y un aneurisma del arco aórtico con un diámetro transversal máximo de 5 cm, lo que significa que no se dispone de una zona de aterrizaje proximal adecuada y no se puede realizar una TEVAR. |
“Subgrupos de alto riesgo” con disección aguda de tipo B- Localización de la entrada primaria
Se ha demostrado que la localización de la entrada primaria en la cara interna del arco aórtico es uno de los factores morfológicos de riesgo más significativos para la presencia o aparición de complicaciones de la disección aguda de tipo B, en particular la malperfusión de órganos y la disección retrógrada de tipo A en los primeros 14 días tras el acontecimiento agudo [2,16,17].
Distancia entre la entrada primaria y la salida de la arteria subclavia izquierda
La distancia entre la entrada primaria y la salida de la arteria subclavia izquierda también es un factor predictivo significativo, y el riesgo disminuye significativamente a mayor distancia [16, 24-26].
Tamaño de la entrada primaria
El tamaño de la entrada primaria también es relevante desde el punto de vista pronóstico, sobre todo en relación con el aumento precoz del diámetro transversal máximo de la aorta; a partir de 10 mm de diámetro transversal máximo, el riesgo aumenta significativamente de dilatación y rotura aórtica precoz. El mejor método, aunque por razones pragmáticas rara vez se utiliza principalmente, es la ecocardiografía transesofágica (ETE) [25]. La razón también se debe a un pico de presión arterial asociado a menudo a la ETE, que generalmente se quiere evitar en la disección aórtica.
Diámetro total de la aorta y diámetro del falso lumen
También se ha demostrado que un diámetro global de 40 mm o superior medido inicialmente en el momento del diagnóstico de la ATC y un diámetro inicial de la luz fibrosa igual o superior a 22 mm son factores predictivos del aumento de tamaño con el tiempo y justifican la colocación de un stent-graft endovascular [17,27,28].
Número y tamaño de las comunicaciones entre las luminarias
También se ha demostrado que el número y el tamaño de las comunicaciones entre lúmenes a lo largo de la aorta toracoabdominal son factores que influyen significativamente en el aumento de tamaño con el paso del tiempo. Incluso después de una TEVAR, las comunicaciones de gran calibre entre los lúmenes distales a la endoprótesis cubierta pueden actuar funcionalmente como una nueva entrada primaria. Puede observarse un mecanismo similar cuando, tras una TEVAR, la membrana de disección del extremo distal de la endoprótesis cubierta se desgarra hacia el interior de la luz equivocada debido a unas fuerzas de cizallamiento excesivas (normalmente con una endoprótesis cubierta sobredimensionada), lo que se conoce como nueva entrada inducida por la endoprótesis cubierta distal(dSINE) [29,30].
Trombosis del falso lumen en diversos grados
También se ha demostrado que la trombosis parcial de la falsa luz es un sustituto pronóstico de un resultado desfavorable. La trombosis parcial puede caracterizarse a menudo como un fenómeno de flujo con imágenes más modernas, pero la hipótesis del aumento de la presión arterial media en la falsa luz debido al retraso del flujo de salida (comunicación interluminal distal más pequeña) sigue siendo la misma, ya que la resistencia periférica aumenta en la falsa luz [10].
¿TEVAR para todos los pacientes con disección de tipo B no complicada?
El objetivo de la TEVAR profiláctica sigue siendo evitar la formación posterior de aneurismas y las complicaciones tardías asociadas, ya que la mala perfusión y la disección retrógrada espontánea de tipo A sólo se producen durante la fase aguda. Sin embargo, la disección retrógrada de tipo A también puede producirse durante la TEVAR y esto, combinado con otras complicaciones muy poco frecuentes pero comunes relacionadas con el procedimiento, como el ictus y la isquemia medular sintomática, son las razones por las que la indicación debe seguir estando bien justificada. Una aorta ascendente ectásica, un arco aórtico ectásico y extensos procedimientos de transposición para lograr una zona de aterrizaje proximal adecuada son otros factores de riesgo [31,32].
Caso práctico 2 – Disección aguda no complicada de tipo BUna mujer de 64 años sufre un dolor torácico agudo que comienza entre los omóplatos y continúa hasta el nivel del diafragma. Pierde el conocimiento durante 30 segundos, luego el dolor mejora. El médico de urgencias hace un diagnóstico clínico de sospecha de síndrome coronario agudo y remite al paciente al servicio de urgencias más cercano con una estación de cateterismo para un diagnóstico más profundo. Otras investigaciones: Se toma una muestra de sangre, las enzimas cardiacas son normales pero el dímero D está elevado. Se realiza una ATC para descartar una embolia pulmonar o una disección aórtica. La ATC muestra una disección de tipo B con una entrada primaria en la cara externa del arco aórtico sin evidencia de malperfusión. constelación que favorece un enfoque principalmente conservador: La distancia de la entrada primaria a la arteria subclavia izquierda es de 3 cm, el diámetro transversal máximo de la entrada primaria es de 5 mm, el diámetro total de la aorta es de 37 mm y el diámetro del falso lumen es de 16 mm. No hay signos clínicos ni de imagen de mala perfusión. En esta constelación, existe una situación de bajo riesgo y se inicia un procedimiento principalmente conservador con un tratamiento farmacológico óptimo y una ATC de control. Constelación que favorece la TEVAR profiláctica:
A pesar de la disección formal de tipo B “sin complicaciones”, estas dos constelaciones pueden considerarse de “alto riesgo” y debe realizarse una terapia TEVAR precoz para cerrar la entrada primaria. Básicamente: si la TEVAR se realiza en circunstancias planificadas, debe colocarse un drenaje de LCR antes del procedimiento para proteger la médula espinal (el drenaje de LCR es la fasciotomía de la médula espinal). |
Evaluación del riesgo de posibles complicaciones asociadas a la terapia
El riesgo residual de ictus se sitúa en el rango porcentual bajo de un solo dígito. En este caso, es posible hacer una afirmación precisa de antemano mediante la evaluación de la ATC diagnóstica con respecto a las lesiones arterioscleróticas en las proximidades de las salidas de las ramas supraaórticas y, de este modo, comprender o excluir un riesgo potencial de embolia mediante la manipulación del catéter.
Un problema importante sigue siendo la isquemia medular sintomática de diversos grados, que van desde las alteraciones sensoriales hasta la paraplejia completa. En los últimos años se ha producido un gran salto en el conocimiento de los mecanismos subyacentes y su prevención. Cabe señalar que la médula espinal, de forma análoga a la arcada de Riolan de suministro arterial visceral, dispone de mecanismos de reserva extra e intraespinales que pueden compensar hasta cierto punto la pérdida de sangre aguda y crónica. En primer lugar, hay que hablar aquí del concepto de “cuatro territorios” [33]. Esto presupone la existencia anatómica de cuatro afluentes arteriales de la médula espinal, de igual valor, a saber, la arteria subclavia (con su continuación en la arteria vertebral y, por tanto, en la arteria espinal anterior, las arterias segmentarias torácicas (vasos intercostales), las arterias segmentarias lumbares (vasos lumbares) y la arteria iliacae internae, todas ellas tributarias de las arterias radiculomedulares anteriores y, por tanto, de la arteria espinal anterior. Si uno de estos afluentes arteriales está ocluido (por ejemplo, si varias arterias segmentarias torácicas están cubiertas por un stent-injerto), esto no tiene un impacto significativo en el riesgo de isquemia medular sintomática. Sin embargo, si se ocluyen dos afluentes al mismo tiempo (por ejemplo, una sobredentadura adicional de la arteria subclavia izquierda), aumenta significativamente el riesgo de paraplejia, ya que no se puede compensar esta extensión del flujo sanguíneo reducido. Incluso una fase de hipotensión pronunciada por sí sola puede aumentar el riesgo de paraplejia (por ejemplo, TEVAR aguda en ruptura). La naturaleza tiene la posibilidad de compensar la reducción aguda del riego sanguíneo, por ejemplo, de la sección torácica de la médula espinal, a través de los músculos autóctonos de la espalda e inducir un brote de vasos capilares en la zona insuficientemente irrigada [34]. Dentro de la médula espinal existen incluso vasos colaterales -preformados- que pueden intervenir en tales situaciones, pero la capacidad de esta red colateral es sólo limitada y cualquier forma de hipotensión intra o postoperatoria contribuye al riesgo [35].
Una medida muy útil en la situación electiva para prevenir la isquemia medular sintomática es la aplicación de un drenaje de líquido cefalorraquídeo antes de la operación. Todos los tejidos, incluida la médula espinal, reaccionan a la isquemia aguda con una hinchazón tisular, pero la médula espinal tiene una capacidad muy limitada para hincharse en el estrecho canal medular debido a la presencia de su líquido portador, es decir, el líquido cefalorraquídeo, y -de forma análoga a la isquemia de las extremidades sin fasciotomía- se produce un estrangulamiento del lecho capilar y, por tanto, un círculo vicioso, que acaba con la pérdida del órgano; en este sentido, el drenaje del líquido cefalorraquídeo puede describirse como una fasciotomía de la médula espinal. [36]. Incluso en casos de isquemia medular secundaria sintomática, por ejemplo unos días después de la cirugía, la aplicación de un drenaje de LCR suele asociarse a un éxito clínico impresionante.
Otra medida de monitorización muy útil en la TEVAR es la medición de los potenciales evocados motores y somatosensoriales (MEPs/ SSEPs) [37]. Esto permite detectar zonas funcionalmente isquémicas en una fase temprana y contrarrestarlas en consecuencia, por ejemplo aumentando la presión arterial media o elevando el hematocrito; estas medidas también pueden ser muy útiles en la fase inicial de la isquemia medular aguda.
En los últimos años, la técnica FET se ha establecido en el tratamiento de diversas patologías aórticas torácicas agudas y crónicas, pero también en pacientes con disección compleja de tipo B que no disponen de una zona de aterrizaje proximal adecuada para el anclaje del stent-graft. Esta indicación, aunque poco frecuente, debe considerarse si el riesgo evaluado de disección retrógrada de tipo A es elevado. Los resultados de este procedimiento para esta indicación son muy buenos en los centros experimentados [33]. En cambio, la cirugía abierta clásica mediante toracotomía lateral izquierda ya no tiene importancia hoy en día.
Las operaciones de fenestración abierta, en las que se extirpa parcialmente la membrana de disección, también han quedado obsoletas en la actualidad. Además, el único tratamiento intervencionista de un órgano terminal malperfundido carece de valor, ya que la causa de la malperfusión seguiría existiendo a través de la entrada primaria abierta y quedaría sin resolver.
Elegir el momento adecuado para el tratamiento
Las pruebas actualmente disponibles sugieren que un intervalo de tiempo más largo entre el evento agudo y la TEVAR (más de 2 semanas) es favorable en términos de complicaciones relacionadas con el procedimiento, asumiendo la estabilidad clínica [38,39].
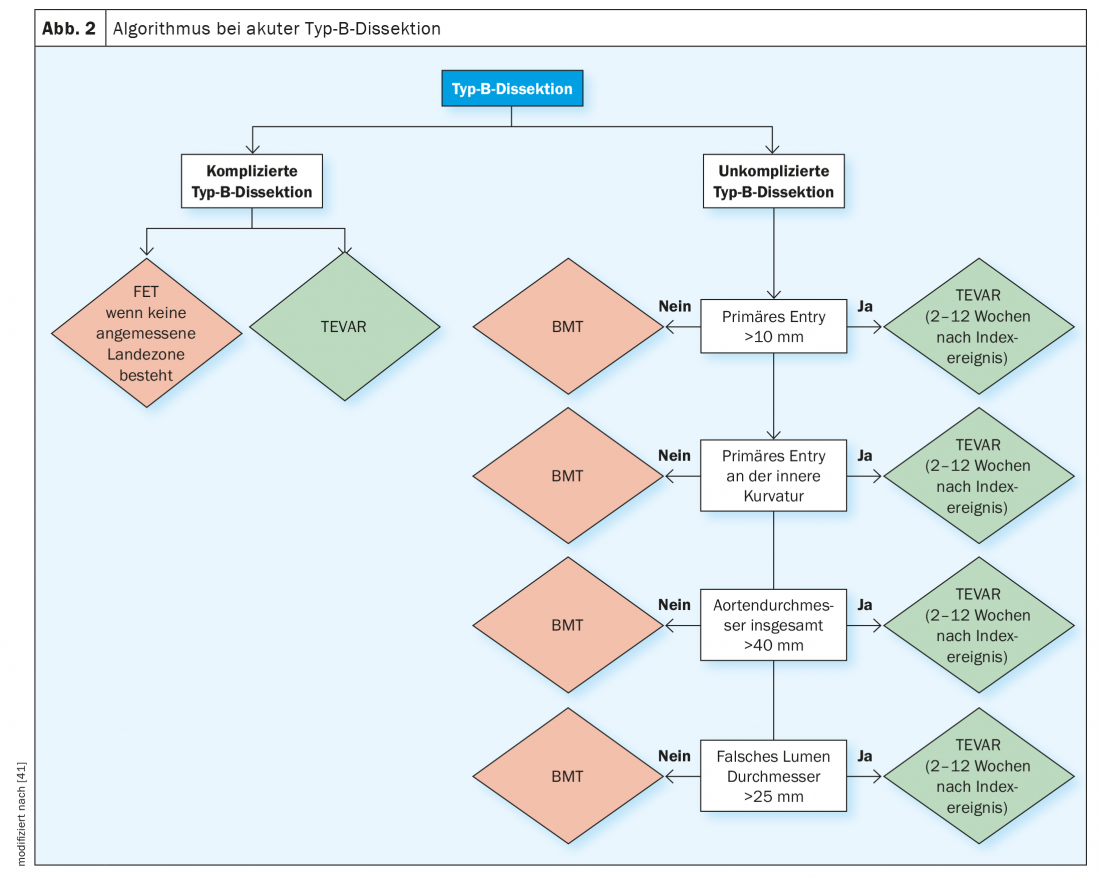
Algoritmo de diagnóstico y tratamiento recomendado
El diagnóstico de la disección aguda y subaguda no complicada de tipo B requiere un algoritmo de evaluación complejo en el que deben evaluarse los parámetros sustitutos mencionados para las complicaciones tempranas y tardías antes de realizar el diagnóstico de disección “no complicada” de tipo B. La figura 2 muestra el algoritmo de diagnóstico que también recomiendan las principales sociedades profesionales para definir estos subgrupos de alto riesgo y tomar después la vía de tratamiento adecuada en cada caso.
Mensajes para llevarse a casa
- La incidencia de la disección de tipo B realmente no complicada es menor de lo que se pensaba.
- Debe aplicarse un diagnóstico de exclusión escalonado para confirmar o excluir los sustitutos de “alto riesgo” mediante angiografía por TC antes de establecer el diagnóstico de “sin complicaciones”.
- El potencial de remodelación positiva de la aorta (reducción del diámetro, aproximación de las capas de la pared) disminuye con el tiempo, y esto debe tenerse en cuenta a la hora de elegir el momento del tratamiento (“ventana de oportunidad de 90 días”).
- La atención al mantenimiento de la perfusión medular en la medida de lo posible a través de los cuatro afluentes arteriales principales es un factor crítico para reducir el riesgo residual de isquemia medular sintomática.
- El drenaje del LCR es una medida muy eficaz para la prevención y también la terapia de la isquemia medular sintomática.
- En pacientes que requieren tratamiento pero presentan un alto riesgo de disección retrógrada de tipo A, debe considerarse la técnica FET.
Literatura:
- Czerny M, Schmidli J, Adler S, et al: Current options and recommendations for the treatment of thoracic aortic pathologies involving the aortic arch- an expert consensus document of the European Association for Cardio-Thoracic Surgery (EACTS) and the European Society of Vascular Surgery (ESVS). Eur J Cardiothorac Surg 2019(55): 133-162.
- Loewe C, Czerny M, Sodeck GH, et al: Un nuevo mecanismo por el que una disección aórtica aguda de tipo B se complica principalmente, se complica o permanece sin complicaciones. Ann Thorac Surg 2012; 93: 1215-1522.
- Ante M, Mylonas S, Skrypnik D, et al: Prevalencia de los predictores morfológicos DISSECT por tomografía computarizada en la disección aórtica tipo B de Stanford no complicada. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Weiss G, Wolner I, Folkmann S, et al: La localización del desgarro de entrada primario en la disección aórtica aguda de tipo B afecta al pronóstico precoz. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Erbel R, Aboyans V, Boileau C, et al: 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases- Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult- The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2873-2926.
- Rylski B, Reser D, Kari F, et al: Disección aórtica aguda no A, no B: definición, tratamiento y resultado. Eur J Cardiothorac Surg 2017; 52: 1111-1117.
- Grimm M, Loewe C, Gottardi R, et al: Nuevos conocimientos sobre los mecanismos y el tratamiento del hematoma intramural que afecta a toda la aorta torácica. Ann Thorac Surg 2008; 86: 453-456.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Predicción del agrandamiento aórtico en la disección aórtica de tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Czerny M, Eggebrecht H, Rousseau H, et al: Distal stent-graft induced new entry after TEVAR or FET – insights into a new disease from EuREC. Ann Thorac Surg 2020, publicación electrónica antes de impresión.
- Tsai TT, Evangelista A, Nienaber CA, et al: Registro internacional de disección aórtica aguda. Trombosis parcial de la falsa luz en pacientes con disección aórtica aguda de tipo B. N Engl J Med 2007; 357: 349-59.
- Evangelista A, Isselbacher EM, Bossone E, et al: Insights from the International Registry of Acute Aortic Dissection: A 20 year experience of collaborative clinical research. Circulation 2018; 137: 1846-1860.
- Czerny M, Rodler S, Fakhimi S, et al: Resultados a medio plazo de la TEVAR en pacientes con aneurismas que afectan a la aorta descendente originados por disecciones crónicas de tipo B. Ann Thorac Surg 2010; 90:90-94.
- Evangelista A, Isselbacher EM, Bossone E, et al: Insights from the International Registry of Acute Aortic Dissection: A 20 year experience of collaborative clinical research. Circulation 2018; 137: 1846-1860.
- Pape LA, Awais M, Woznicki EM, et al: Presentación, diagnóstico y resultados de la disección aórtica aguda: tendencias de 17 años del registro internacional de disección aórtica aguda. J Am Coll Cardiol 2015; 66: 350-358.
- Zeeshan A, Woo EY, Bavaria JE, et al: Reparación aórtica torácica endovascular para la disección aórtica aguda complicada de tipo B: superioridad en relación con la terapia quirúrgica abierta y médica convencional. J Thorac Cardiovasc Surg 2010; 140(6 Suppl): S109-15.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Predicción del agrandamiento aórtico en la disección aórtica de tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Ante M, Mylonas S, Skrypnik, et al: Prevalencia de los predictores morfológicos DISSECT por tomografía computarizada en la disección aórtica tipo B de Stanford no complicada. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Nienaber C, Rousseau H, Eggebrecht H, et al: A randomized comparison of strategies for noncomplicated type B aortic dissection – the INvestigation of STEnt-grafts in Aortic Dissection (INSTEAD) trial. Circulation 2009; 120: 2519-2528.
- Nienaber CA, Kische S, Rousseau H, et al: Endovascular repair of type B aortic dissection: long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Intervent 2013; 6: 407-416.
- Brunkwall J, Kasprzak P, Verhoeven E, et al: La reparación endovascular de la disección aórtica aguda no complicada de tipo B favorece la remodelación aórtica ; resultados a 1 año del ensayo ADSORB. Eur J Vasc Endovasc Surg 2014; 48: 285-291. Fe de erratas en Eur J Vasc Endovasc Surg 2015; 50: 130.
- Moulakakis KG, Mylonas SN, Dalainas I, et al: Tratamiento de la disección aguda de tipo B complicada y no complicada. Una revisión sistemática y un metaanálisis. Ann Cardiothorac Surg 2014; 3: 234-246.
- Erbel R, Aboyans V, Boileau C, et al: 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases- Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult- The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2873-2926.
- Grabenwöger M, Alfonso F, Bachet J, et al: ESC/EACTS position statement on thoracic endovascular aortic repair (TEVAR). Eur J Cardiothorac Surg 2012; 42: 17-24.
- Weiss G, Wolner I, Folkmann S, et al: La localización del desgarro de entrada primario en la disección aórtica aguda de tipo B afecta al pronóstico precoz. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Evangelista A, Salas A, Ribera A, et al: Resultado a largo plazo de la disección aórtica con falsa luz permeable: papel predictivo del tamaño y la localización del desgarro de entrada. Circulation 2012; 125: 3133-3141.
- Codner JA, Lou X, Duwayri YM, et al: La distancia del desgarro intimal primario desde la arteria subclavia izquierda predice el crecimiento aórtico en la disección aórtica tipo B no complicada. J Vasc Surg 2019; 69: 692-700.
- Song JM, Kim SD, Kim JH, et al: Factores predictivos a largo plazo del cambio aneurismático de la aorta descendente en pacientes con disección aórtica. J Am Coll Cardiol 2007; 50: 799-804.
- Fattori R Cao P, De Rango P, et al: Documento de consenso de expertos interdisciplinarios sobre el tratamiento endovascular de la disección aórtica de tipo B. J Am Coll Cardiol 2013; 61: 1661-1678.
- Czerny M, Eggebrecht H, Rousseau H, et al.: Nueva entrada distal inducida por endoprótesis después de TEVAR o FET – insights into a new disease from EuREC. Ann Thorac Surg 2020, en prensa.
- Lou X, Duwayri YM, Jordan WD Jr, et al: Seguridad y eficacia de la TEVAR ampliada en la disección aórtica aguda de tipo B. Ann Thorac Surg 2020, en prensa.
- Cochennec F, Tresson P, Cross J, et al: Reparación híbrida de las disecciones del arco aórtico. J Vasc Surg 2013; 57: 1560-1567.
- Eggebrecht H, Thompson M, Rousseau H, et al; en nombre del Registro Europeo de Complicaciones de la Reparación Aórtica Endovascular. Disección retrógrada de la aorta ascendente durante o después de la colocación de una endoprótesis aórtica torácica: conclusiones del Registro Europeo de Complicaciones de la Reparación Endovascular de la Aorta (EuREC). Circulation 2009; 120: S276-281.
- Czerny M, Eggebrecht H, Sodeck G, et al: Mechanisms of symptomatic spinal cord ischemia after TEVAR- Insights from the European Registry of Endovascular Aortic Repair Complications (EuREC). J Endovasc Ther 2012; 19: 37-43.
- Etz CD, Kari FA, Mueller CS, et al: El concepto de red colateral: remodelación de la red colateral arterial tras el sacrificio experimental de una arteria segmentaria. J Thorac Cardiovasc Surg 2011; 141: 1029-1036.
- Heber U, Mayrhofer M, Gottardi R, et al: La red colateral arterial intraespinal: una nueva base anatómica para comprender y prevenir la paraplejia durante la reparación aórtica. Eur J Cardiothorac Surg 2020, en prensa.
- Etz C, Weigang E, Hartert M, et al: Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular aortic repair: A position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothorac Surg 2015; 47: 943-957.
- Maier S, Shcherbakova M, Beyersdorf F, et al: Beneficios y riesgos de la monitorización profiláctica con catéter de líquido cefalorraquídeo y potenciales evocados en la isquemia medular sintomática de bajo riesgo en la reparación aórtica endovascular torácica. Thorac Cardiovasc Surg 2018; 67: 379-384.
- Kreibich M, Berger T, Morlock J, et al: La técnica de la trompa de elefante congelada para el tratamiento de la disección aórtica aguda complicada de tipo B. Eur J Cardiothorac Surg 2018; 53: 525-530.
- Desai ND, Gottret JP, Szeto WY, et al: Impacto del momento en las complicaciones mayores tras la reparación aórtica endovascular torácica por disección aórtica aguda de tipo B. J Thorac Cardiovasc Surg 2015; 149(2 Suppl): S151-156.
- Heijmen R, Fattori R, Thompson M, et al: Resultados a medio plazo y remodelación aórtica tras la reparación endovascular torácica de la disección aórtica aguda, subaguda y crónica: el registro VIRTUE. Eur J Vasc Endovasc Surg 2014; 48: 363-371.
- Czerny M, Pacini D, Aboyans V, et al.Opciones y recomendaciones actuales para el uso de la reparación aórtica endovascular torácica en la enfermedad aórtica torácica aguda y crónica: un documento de consenso de expertos del Grupo de Trabajo de Cirugía Cardiovascular de la Sociedad Europea de Cardiología (ESC), el Grupo de Trabajo de Aorta y Enfermedades Vasculares Periféricas de la ESC, la Asociación Europea de Intervenciones Cardiovasculares Percutáneas (EAPCI) de la ESC y la Asociación Europea de Cirugía Cardio-Torácica (EACTS). Eur J Cardiothorac Surg 2021 Ene 4;59(1): 65-73.
CARDIOVASC 2022; 21(3): 6-12