La determinación del estado de mutación del EGFR y las translocaciones EML-ALK en pacientes con adenocarcinoma metastásico tiene consecuencias terapéuticas y debe solicitarse en el momento del diagnóstico. El tratamiento de mantenimiento con pemetrexed en pacientes con carcinomas epiteliales no plaquetarios se ha abierto camino en la rutina clínica. Un reto importante es el desarrollo secundario de resistencia a los TKI orales del EGFR o a la terapia del EGFR. Crizotinib. Las terapias de segunda línea establecidas para pacientes con tumores sin una “diana genética” tienen una actividad limitada, y los actuadores predictivos tendrían aquí una importancia considerable.
En todo el mundo, el cáncer de pulmón sigue siendo la neoplasia maligna más frecuente en los hombres y la cuarta en las mujeres. Mientras que la incidencia del cáncer de pulmón no microcítico (CPNM) ha disminuido algo en los hombres de muchos países durante la última década, el CPNM está aumentando en las mujeres de varios países industrializados, por ejemplo, de 35 a 39 por 100.000 habitantes en el Reino Unido entre 1993 y 2008. La mortalidad por CPNM en Europa aumentó un 10% en las mujeres entre 2007 y 2012 [1]. Esta es una triste consecuencia del tabaquismo “emancipado”. Alrededor del 85-90% de todos los cánceres de pulmón corresponden a la variante de células no pequeñas, y hasta dos tercios de todos los pacientes se diagnostican en la fase metastásica. Para mayor claridad, este artículo hace referencia al CPNM y al estadio metastásico.
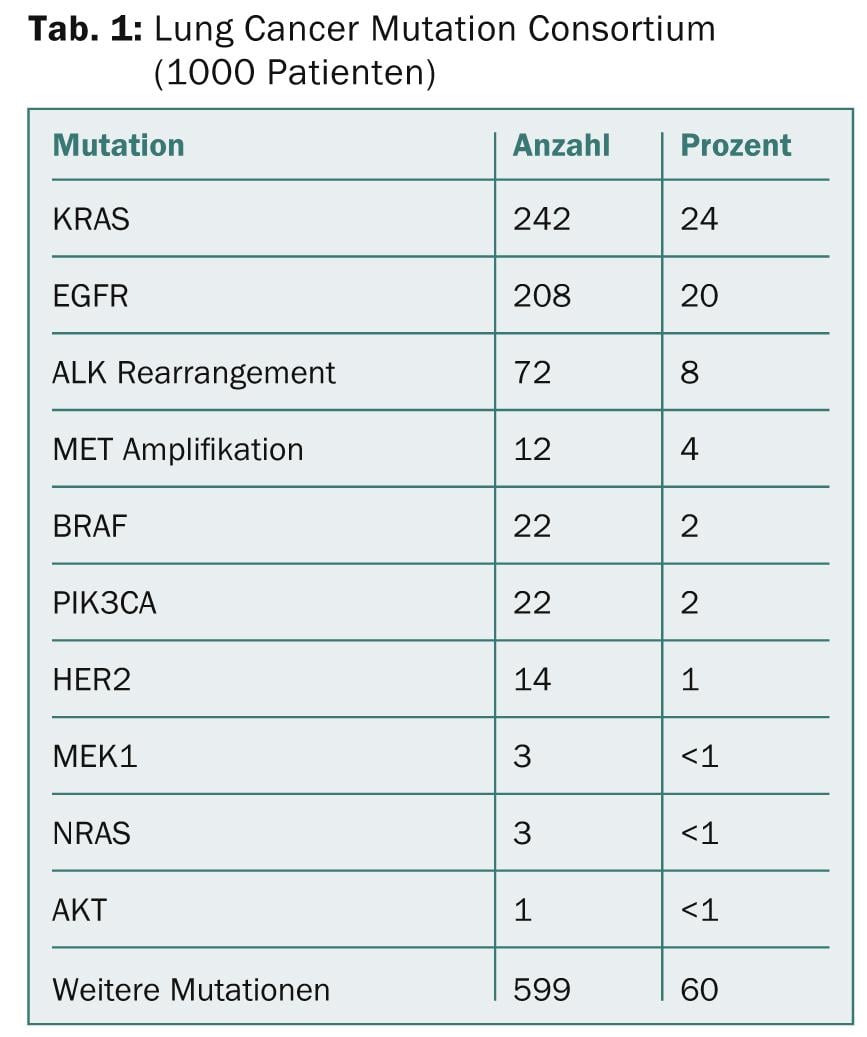
La subclasificación molecular del CPNM condujo a la aprobación de potentes fármacos oncológicos orales en pacientes con mutaciones activadoras del EGFR (10% de los caucásicos) (erlotinib, gefitinib, afatinib) y en pacientes con mutaciones del EGFR (10% de los caucásicos). Translocaciones EML-ALK (5% de los caucásicos) (crizotinib). Otras mutaciones impulsoras en el adenocarcinoma (ROS1, RET, HER2, BRAF, KRAS, MET) y el carcinoma de células escamosas (FGFR1, PIK3CA, DDR2, PTEN) podrían permitir tratamientos dirigidos en el futuro [2] (Tabla 1).
Diagnóstico
Para el diagnóstico histopatológico o citopatológico en el caso (frecuente) de material tumoral limitado procedente de biopsias con aguja fina o sacabocados, en 2011 se publicaron las recomendaciones correspondientes [3]. En cualquier caso, debe realizarse una subtipificación en adenocarcinoma o adenocarcinoma. Debe aspirarse a un carcinoma de células escamosas, y la tasa de tumores que no puedan seguir tipificándose debe limitarse a <10%. En los adenocarcinomas, se recomienda la determinación primaria del estado de mutación de EGFR y EML-ALK [4].
CPNM metastásico sin evidencia de mutaciones activadoras del EGFR
Tratamiento de primera línea: El tratamiento de primera línea en pacientes sin evidencia de mutaciones activadoras del EGFR tiene en cuenta el subtipo histológico de la enfermedad. Los pacientes con adenocarcinomas reciben una combinación del antifolato pemetrexed y una sal de platino, ya sea cisplatino en ausencia de contraindicaciones, o paraplatino. En pacientes con carcinoma escamoso de pulmón, el pemetrexed se sustituye por el análogo de nucleósido gemzitabina o un taxano. El tratamiento diferenciado según el histotipo se remonta a un ensayo aleatorizado que demostró la superioridad del cisplatino/pemetrexed sobre el cisplatino/gemzitabina en los adenocarcinomas (supervivencia global de 12,6 frente a 10,9 meses), y viceversa en los carcinomas de células escamosas (10,8 frente a 9,4 meses) [5].
En cuanto a la posible adición del anticuerpo anti-VEGF bevacizumab a la quimioterapia estándar, se abre una clara “brecha transatlántica”. El ensayo estadounidense ECOG-4599 mostró una prolongación significativa de la supervivencia global de 10,3 a 12,3 meses con la adición de bevacizumab al carboplatino y paclitaxel, con complicaciones hemorrágicas en el 4,4% de los pacientes tratados con bevacizumab [6]. En el estudio comparativo europeo aleatorizado AVAiL, el bevacizumab se combinó con cisplatino y gemzitabina sin dar lugar a una mejora significativa o clínicamente relevante de la supervivencia [7]. A pesar de estos datos, el bevacizumab sólo se aprobó en Suiza en combinación con cisplatino/gemzitabina, y su uso en el CPNM es limitado.
Pacientes ancianos y con un estado funcional limitado: Solemos referirnos a los pacientes con una edad de al menos 70 años como “ancianos”. Es más probable que estos pacientes tengan disfunción orgánica y un estado funcional deteriorado o que estén tomando medicamentos que puedan interactuar. La evolución epidemiológica en los países occidentales explica la especial importancia de este grupo de pacientes en fuerte crecimiento.
Un ensayo aleatorizado abordó la cuestión del tratamiento óptimo de primera línea en pacientes de entre 70 y 89 años con un estado funcional de hasta 2 [8]. Esto demostró que la quimioterapia combinada con carboplatino y paclitaxel semanal era superior a la monoterapia con gemzitabina o vinorelbina, y condujo a una mejora de la supervivencia de 6,2 a 10,3 meses. Las complicaciones relacionadas con la quimioterapia no fueron más frecuentes que con la monoterapia. En general, preferimos por tanto una terapia combinada basada en platino también en pacientes de edad avanzada, así como en pacientes seleccionados con un estado funcional de 2 y con al menos una buena función orgánica. Las monoterapias se recomiendan en el caso de pacientes ancianos con un estado de rendimiento 2 o comorbilidades importantes.
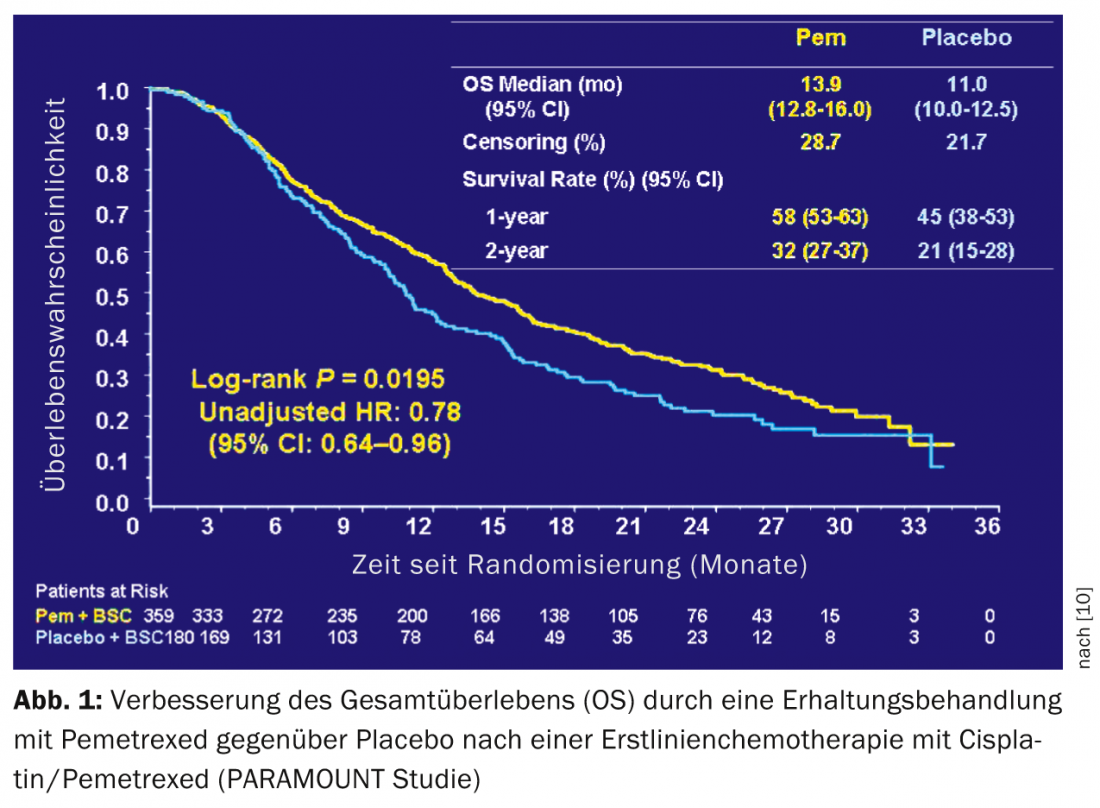
Terapia de mantenimiento: Dos ensayos aleatorios han demostrado el beneficio clínico de la terapia de mantenimiento tras cuatro ciclos de quimioterapia basada en platino [9,10]. SATURN mostró una mejora significativa pero pequeña de la supervivencia de 11 a 12 meses con el tratamiento de mantenimiento con erlotinib. Este beneficio también se demostró en pacientes con EGFR de tipo salvaje. PARAMOUNT demostró una mejora de la supervivencia de 11,0 a 13,9 meses con el tratamiento de mantenimiento con pemetrexed tras cuatro ciclos de cisplatino/pemetrexed en pacientes con carcinoma pulmonar de células no escamosas. (Fig.1). El tratamiento de mantenimiento con pemetrexed se ha convertido en una estrategia habitual en este grupo de pacientes, entre otras cosas por la buena tolerancia del pemetrexed.
Terapia de segunda línea: Por término medio, los pacientes con CPNM metastásico experimentan una progresión de la enfermedad cinco meses después de iniciar la terapia de primera línea, y muchos de estos pacientes son aptos para una segunda línea de terapia. Los fármacos oncológicos más utilizados son el pemetrexed, el docetaxel y el inhibidor de la tirosina quinasa anti-EGFR erlotinib. Mientras que el docetaxel y el erlotinib no tienen restricciones de subtipo histológico, el pemetrexed sólo está aprobado para el adenocarcinoma de diferenciación predominante. El ensayo TAILOR publicado en 2013 mostró un beneficio en la supervivencia del tratamiento de segunda línea con docetaxel frente al erlotinib en pacientes con CPNM metastásico y EGFR de tipo salvaje (8,2 frente a 5,4 meses) [11]. Sin embargo, el beneficio para la supervivencia en el estudio TAILOR es estadísticamente poco significativo y la relevancia clínica de los resultados es controvertida.
CPNM metastásico con mutaciones activadoras del EGFR
Se recomienda la búsqueda de mutaciones activadoras del EGFR en pacientes con adenocarcinoma metastásico o, en el caso del carcinoma de células escamosas, en “pocos fumadores” (<15 paquetes-año) en el momento del diagnóstico [4]. En pacientes con mutaciones activadoras del EGFR, la terapia de primera línea con un inhibidor oral de la tirosina quinasa anti-EGFR (erlotinib, gefitinib) debe preferirse a la quimioterapia. El EURTAC mostró una mejora sustancial de la supervivencia libre de progresión en los pacientes con mutaciones activadoras del EGFR tratados con erlotinib frente a la quimioterapia combinada basada en platino (9,7 y 5,2 meses, respectivamente) [12]. Se obtuvieron resultados comparables en el ensayo asiático IPASS (gefitinib) [13] y en el ensayo LUX-Lung-6 (afatinib) [14]. A pesar del frecuente exantema acneiforme durante el tratamiento con inhibidores de la tirosina cinasa anti-EGFR, la tolerancia subjetiva es muy buena en general, y también puede considerarse un tratamiento adecuado en pacientes con un estado de rendimiento >2. El inhibidor irreversible de la tirosina quinasa anti-EGFR afatinib fue aprobado por la EMA en septiembre de 2013; la aprobación de Swissmedic se concedió en enero de 2014.
CPNM metastásico con translocaciones EML-ALK (ALK+)
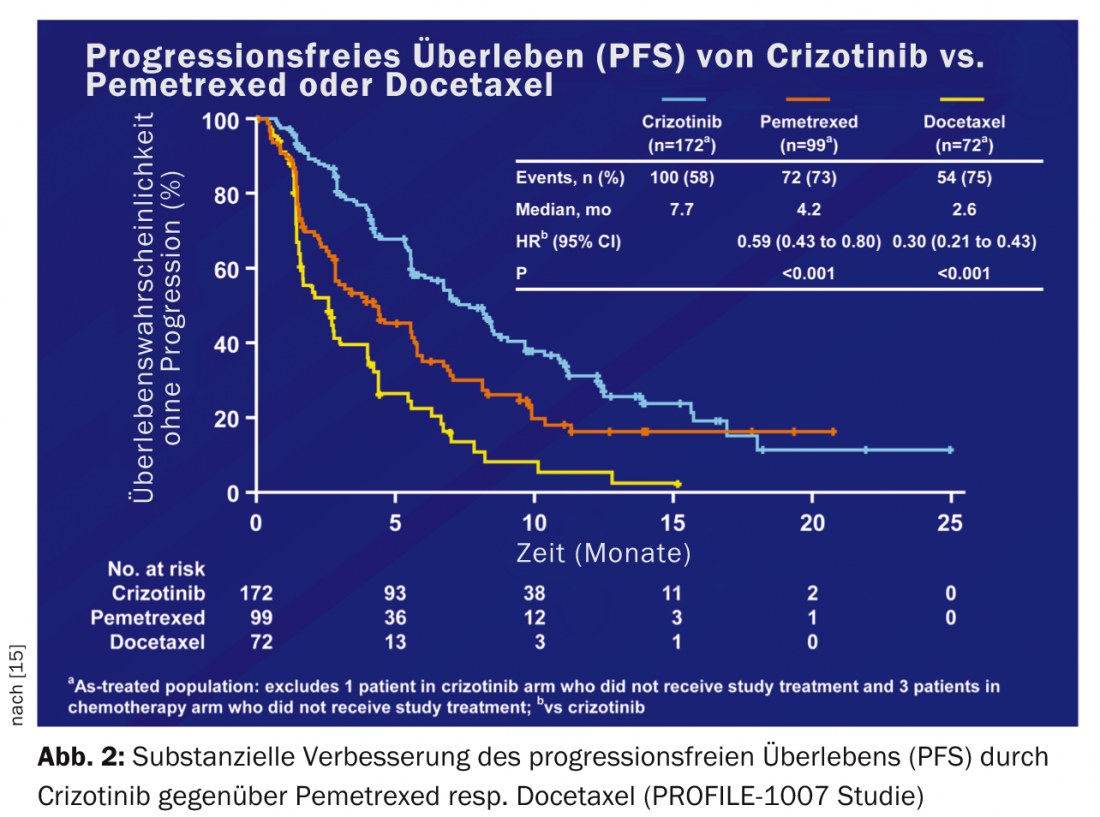
Alrededor del 5% de todos los caucásicos con CPNM presentan una translocación EML-ALK (ALK+). Los primeros datos aleatorizados sobre crizotinib frente a quimioterapia en pacientes con CPNM ALK+ tras el fracaso de la quimioterapia de primera línea (PROFILE 1007) mostraron una mejora sustancial de la supervivencia libre de progresión de 3,1 a 7,7 meses [15] (Fig. 2).
Debido al inevitable desarrollo de resistencias, actualmente se están realizando intensos esfuerzos para desarrollar inhibidores de ALK de segunda generación. Los compuestos más avanzados son el inhibidor oral de ALK/EGFR AP26113 y los inhibidores puros de ALK LDK378 y CH5424802. Además de una buena actividad en los tumores ALK+ resistentes, estas sustancias también tienen la ventaja de la movilidad en el SNC.
PD Dr. med. et rer. nat. Markus Joerger
Literatura:
- Malvezzi M, et al: Predicciones europeas de mortalidad por cáncer para el año 2012. Ann Oncol 2012; 23: 1044-1052.
- Ujhazy P, Herbst R: Terapia personalizada. J Thorac Oncol 2012; 7: S401-403.
- Travis WD, et al: International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6: 244-285.
- Peters S, et al: Cáncer de pulmón no microcítico (CPNM) metastásico: Guías de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol 2012; 23 Suppl 7: vii56- 64.
- Scagliotti GV, et al: Estudio de fase III que compara cisplatino más gemcitabina con cisplatino más pemetrexed en pacientes sin quimioterapia con cáncer de pulmón no microcítico en estadio avanzado. J Clin Oncol 2008; 26: 3543-3551.
- Sandler A, et al: Paclitaxel-carboplatino solo o con bevacizumab para el cáncer de pulmón no microcítico. N Engl J Med 2006; 355: 2542-2550.
- Reck M, et al: Supervivencia global con cisplatino-gemcitabina y bevacizumab o placebo como tratamiento de primera línea para el cáncer de pulmón no microcítico no escamoso: resultados de un ensayo aleatorizado de fase III (AVAiL). Ann Oncol 2010; 21: 1804-1809.
- Quoix E, et al: Quimioterapia con doblete de carboplatino y paclitaxel semanal en comparación con la monoterapia en pacientes ancianos con cáncer de pulmón no microcítico avanzado: ensayo aleatorizado de fase 3 IFCT-0501. Lancet 2011; 378: 1079-1088.
- Cappuzzo F, et al: Erlotinib como tratamiento de mantenimiento en el cáncer de pulmón no microcítico avanzado: un estudio de fase 3 multicéntrico, aleatorizado y controlado con placebo. Lancet Oncol 2010; 11: 521-529.
- Paz-Ares LG, et al: PARAMOUNT: Resultados finales de supervivencia global del estudio de fase III de pemetrexed de mantenimiento frente a placebo inmediatamente después del tratamiento de inducción con pemetrexed más cisplatino para el cáncer de pulmón no microcítico no escamoso avanzado. J Clin Oncol 2013; 31: 2895-2902.
- Garassino MC, et al: Erlotinib frente a docetaxel como tratamiento de segunda línea de pacientes con cáncer de pulmón no microcítico avanzado y tumores EGFR de tipo salvaje (TAILOR): un ensayo controlado aleatorizado. Lancet Oncol 2013; 14: 981-988.
- Rosell R, et al: Erlotinib frente a quimioterapia estándar como tratamiento de primera línea para pacientes europeos con cáncer de pulmón no microcítico avanzado con mutación EGFR positiva (EURTAC): un ensayo multicéntrico, abierto y aleatorizado de fase 3. Lancet Oncol 2012; 13: 239-246.
- Mok TS, et al: Gefitinib o carboplatino-paclitaxel en el adenocarcinoma pulmonar. N Engl J Med 2009; 361: 947-957.
- Wu YL, et al: Afatinib frente a cisplatino más gemcitabina para el tratamiento de primera línea de pacientes asiáticos con cáncer de pulmón no microcítico avanzado portador de mutaciones del EGFR (LUX-Lung 6): un ensayo de fase 3 abierto y aleatorizado. Lancet Oncol 2014; 15: 213-222.
- Shaw AT, et al: Crizotinib frente a quimioterapia en cáncer de pulmón avanzado ALK-positivo. N Engl J Med 2013; 368: 2385-2394.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(4): 10-12