Si un paciente sufre apnea obstructiva del sueño (AOS), esto le predispone a toda una serie de comorbilidades, desde trastornos cardiovasculares y renales hasta pulmonares y neuropsiquiátricos. Pero también hay cada vez más pruebas de un efecto contrario. Investigadores de Irlanda han estudiado la relación entre la AOS y la comorbilidad, centrándose en las comorbilidades que muestran indicios de una relación bidireccional.
Entre los posibles mecanismos asociados a la AOS que contribuyen a la comorbilidad se encuentran la hipoxia intermitente, la fluctuación de la presión intratorácica y las microexcitaciones recurrentes, que son características integrales de la apnea obstructiva. Las consecuencias celulares o moleculares pueden incluir la excitación simpática, la inflamación sistémica y el estrés oxidativo, además de la disfunción metabólica y endotelial, escriben la Dra. Margaret Gleeson y el Prof. Dr. Walter McNicholas de la Facultad de Medicina del University College de Dublín y del Departamento de Medicina Respiratoria y del Sueño del Grupo Hospitalario St Vincent de Dublín [1]. Pueden prevalecer mecanismos diferentes con ciertas comorbilidades.
Obesidad
Alrededor del 70% de los pacientes con AOS son obesos, a la inversa, el 50% de los que tienen un índice de masa corporal (IMC) >40 padecen AOS con un índice de apnea-hipopnea (IAH) >10. Un IMC más elevado suele conllevar un SAOS más grave, especialmente en los hombres y en la población más joven. La mayoría de las investigaciones se han centrado en la obesidad como factor de riesgo de la AOS, pero existen pruebas de que la relación es bidireccional.
La acumulación de grasa en la zona del cuello contribuye al estrechamiento de la orofaringe, lo que aumenta el riesgo de colapso de las vías respiratorias superiores. Además, la obesidad abdominal reduce la tracción de las vías respiratorias superiores, lo que predispone aún más al colapso. Además, la hipoxia intermitente, que es una característica central de la AOS, desencadena una respuesta proinflamatoria en el tejido adiposo visceral y contribuye a la resistencia a la insulina.
Efecto terapéutico de la reducción severa de peso, especialmente tras la cirugía bariátrica. La intervención dietética sola, por otra parte, mostró sólo un pequeño efecto durante un periodo de seguimiento de 10 años, escriben los autores. Los pacientes con SAOS con un volumen maxilomandibular preexistente pequeño fueron los que más se beneficiaron de la pérdida de peso, lo que indica una importante interacción entre la anatomía de las vías respiratorias superiores y los efectos de la obesidad.
Los hombres con sobrepeso y SAOS pierden menos peso en respuesta a un programa de dieta y ejercicio de un año de duración que los hombres con un sobrepeso similar sin SAOS. Aunque el tratamiento con presión positiva continua en las vías respiratorias (CPAP) es muy eficaz para controlar la AOS, paradójicamente algunos pacientes aumentan de peso tras iniciar el tratamiento con CPAP, sobre todo las mujeres y los pacientes no obesos. En general, la relación entre la obesidad y la AOS es sinérgica en términos de riesgo cardiometabólico, ya que diversos mecanismos intermedios potenciales, como la inflamación, la disfunción endotelial y la resistencia a la insulina, se ven amplificados por la coexistencia de ambas afecciones, afirman el Dr. Gleeson y el profesor McNicholas.
EPOC
La relación entre la EPOC y la AOS es descrita por los autores como “compleja”: Algunos factores, como la hiperinsuflación pulmonar, protegen de la AOS, mientras que otros, como la retención de líquidos, favorecen la AOS. El aumento del IMC y los antecedentes de tabaquismo se correlacionan positivamente con la probabilidad de AOS en pacientes con EPOC (Fig. 1).
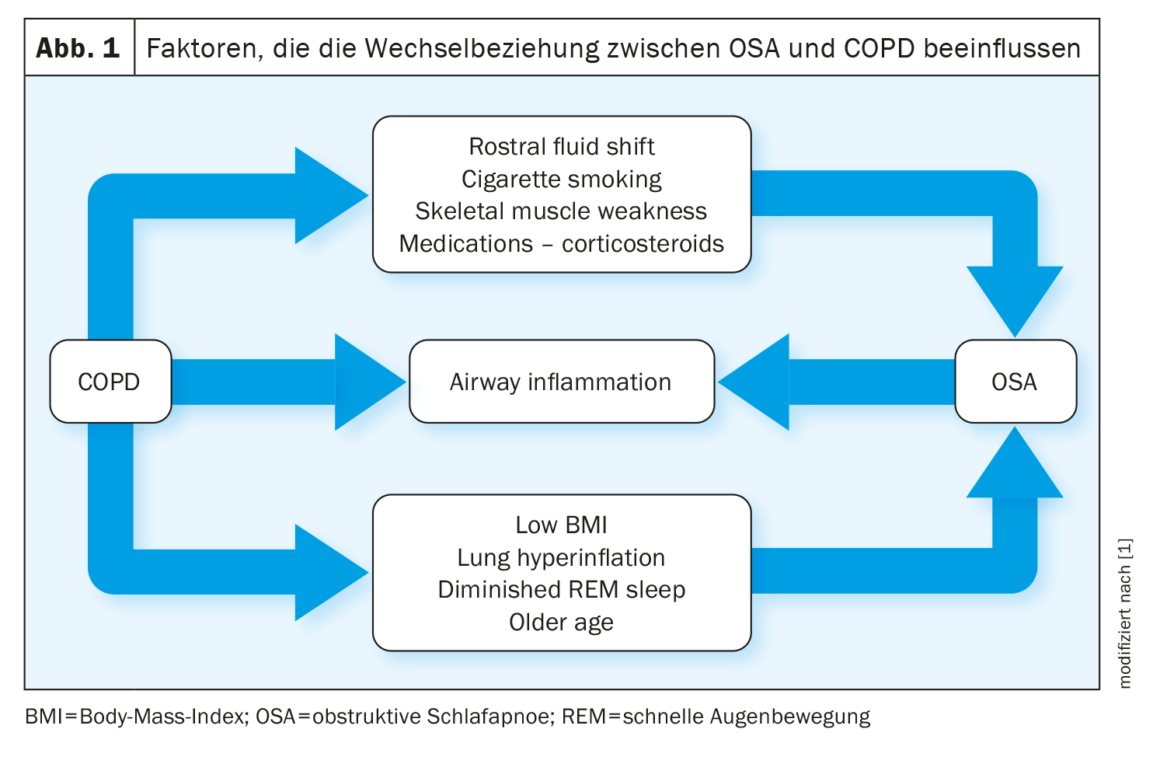
Los trabajos sobre la AOS como factor de riesgo de EPOC han arrojado resultados dispares. Por ejemplo, un estudio muestra una mayor prevalencia de EPOC y asma en pacientes con SAOS en comparación con una población de control correspondiente, especialmente en mujeres. La AOS también parece exacerbar la inflamación de las vías respiratorias inferiores en pacientes con EPOC, y los estudios en animales informan de que la hipoxia intermitente crónica contribuye al daño pulmonar en ratones al inducir inflamación y estrés oxidativo.
Los pacientes con solapamiento EPOC-OSA tratados con CPAP a largo plazo tienen una supervivencia similar a la de los pacientes con EPOC sola, mientras que los pacientes con solapamiento no tratados con CPAP tienen una mayor mortalidad y tasas de hospitalización con exacerbaciones agudas. Estos resultados ponen de relieve la importancia de identificar la AOS coexistente en pacientes con EPOC grave para poder seleccionar la terapia óptima, señalaron el Dr. Gleeson y el Prof. McNicholas.
Diabetes
La diabetes y la AOS coexisten a menudo, cada vez hay más pruebas de una relación bidireccional.
Varios estudios transversales de cohortes han mostrado una asociación independiente con la diabetes de tipo 2 y la resistencia a la insulina; una estimación conjunta del riesgo relativo de diabetes a partir de nueve estudios originales fue de 1,69 (IC 95%: 1,45-1,80). Los mecanismos de la diabetes y la resistencia a la insulina incluyen la hipoxia intermitente y la fragmentación del sueño, que conducen a la excitación simpática y la inflamación. Un estudio de cohortes de 8.678 adultos sometidos a pruebas de detección de la AOS informó de que las personas con AOS grave tenían un riesgo un 30% mayor de desarrollar diabetes que las que no la padecían, tras un seguimiento medio de 67 meses después de controlar los factores de confusión.
La terapia CPAP sola durante 24,5 semanas no promovió la sensibilidad a la insulina en pacientes no diabéticos con SAOS, en contraste con la reducción de peso. Los ensayos aleatorios de control de la CPAP en pacientes diabéticos con SAOS han arrojado resultados dispares.
Algunas consecuencias de la diabetes mellitus pueden predisponer a la AOS, como la neuropatía que afecta a los músculos de las vías respiratorias superiores y los trastornos del control respiratorio. Un estudio prospectivo de casi 300 000 profesionales sanitarios descubrió que la AOS era un factor de riesgo independiente para la diabetes de nueva aparición, pero a la inversa, la diabetes insulinodependiente era un factor de riesgo independiente para la AOS en las mujeres.
Hipertensión
Aunque la hipertensión es muy común en pacientes con AOS, la gran mayoría de las investigaciones sobre este tema se han centrado en el AOS como factor de riesgo de hipertensión.
Muchos estudios epidemiológicos basados en la población indican claramente que la AOS es un factor de riesgo de hipertensión sistémica, a menudo con un perfil de presión arterial (PA) nocturna no descendente. Los datos del Sleep Heart Health Study mostraron una asociación dosis-dependiente con la hipertensión prevalente y el Wisconsin Cohort Study informó de una mayor presencia de hipertensión asociada al SAOS tras 4 años de seguimiento. Los datos del estudio ESADA, en el que participaron 4.372 pacientes con AOS leve, hallaron una asociación independiente con la hipertensión prevalente, y un estudio prospectivo de 744 pacientes con AOS leve/moderada y normotensos de base informó de una asociación con la hipertensión de nueva aparición al cabo de 9 años en pacientes <60 años.
Existen pruebas limitadas de que la hipertensión puede predisponer a la AOS. Los datos procedentes de estudios en animales y pequeños seres humanos sugieren que las fluctuaciones de la presión arterial pueden afectar al tono de las vías respiratorias superiores al mostrar cambios inhibitorios en el electromiograma (EMG). Esto es un indicio de que reducir la presión arterial puede mejorar el flujo de aire y reducir la gravedad de la AOS.
Insuficiencia cardíaca
La relación bidireccional entre la apnea del sueño y la insuficiencia cardiaca puede explicarse en parte por factores de riesgo comunes como la edad, un IMC elevado y un estilo de vida sedentario. Los mecanismos unificadores, especialmente la retención y la redistribución de líquidos, conducen a una relación bidireccional en la que puede ser difícil determinar la causa y el efecto.
El SAOS se asocia a un mayor riesgo de aparición y progresión de cardiopatías coronarias, insuficiencia cardiaca congestiva y mortalidad cardiovascular. Puede inducir el remodelado cardiaco, contribuyendo a la insuficiencia cardiaca, y puede deteriorar agudamente la función cardiaca, exacerbando los episodios de insuficiencia cardiaca aguda. Los pacientes con un IAH más elevado presentan un mayor grado de disfunción diastólica. Los pacientes sin SAOS o con SAOS leve tuvieron una incidencia de acontecimientos mortales un 50% menor en comparación con los pacientes con enfermedad moderada o grave no tratada. La AOS puede afectar negativamente al pronóstico de la insuficiencia cardiaca y se asocia a un aumento de los ingresos hospitalarios y de la mortalidad tras el alta en pacientes hospitalizados por AOS.
El tratamiento del SAOS con CPAP mejora los criterios de valoración cardiovasculares intermedios, como la presión arterial, la frecuencia y el ritmo cardíacos y la fracción de eyección. Un estudio descubrió un aumento del 9% en la fracción de eyección del ventrículo izquierdo (FEVI), además de una disminución diurna de la frecuencia cardiaca y la presión arterial, lo que puede reflejar una reducción de la excreción urinaria nocturna de epinefrina. Sin embargo, aunque se ha demostrado una mejora fisiológica inmediata con el tratamiento con CPAP, faltan datos que demuestren una mejora de la mortalidad y de la supervivencia sin trasplante en cuanto al efecto a largo plazo.
En un ensayo controlado aleatorio (ECA) de pacientes con AOS grave, la restricción de sodio y el tratamiento diurético sólo produjeron una mejora limitada del IAH, lo que sugiere que la retención de líquidos sólo explica parcialmente la etiología del AOS en la insuficiencia cardiaca. En una exacerbación aguda de insuficiencia cardiaca diastólica hipertensiva, la terapia diurética produjo una reducción del peso corporal, un aumento del calibre faríngeo y una disminución del IAH en 17. Por el contrario, en un estudio observacional, la terapia diurética mejoró la AOS en pacientes obesos o con hipertensión, pero no se observó ninguna mejora significativa de la gravedad de la AOS en pacientes con insuficiencia cardiaca.
Disfunción renal
Las pruebas actuales sugieren que la enfermedad renal y la apnea del sueño tienen una relación bidireccional. La prevalencia de la AOS es hasta diez veces mayor en los pacientes con enfermedad renal crónica (ERC) que en la población general, pero la AOS sigue estando poco reconocida en la ERC, explican los investigadores irlandeses. La incidencia de la AOS aumenta proporcionalmente a la gravedad de la ERC, lo que respalda su papel en la patogénesis. Un ensayo clínico informó de una prevalencia de AOS del 27%, 41% y 57% en pacientes con TFGe >60, pacientes con TFGe <60 pero sin terapia de sustitución renal y pacientes en hemodiálisis, respectivamente.
Los factores que contribuyen a la AOS en la ERC incluyen el aumento de la sensibilidad quimiorrefleja, la disminución del aclaramiento de toxinas urémicas y la hipervolemia. En un grupo de 40 pacientes en hemodiálisis, el 70% tenía un IAH >15 y un mayor volumen total de líquido extracelular corporal, incluidos los volúmenes del cuello, torácico y de las piernas, aunque no había diferencias en el IMC en comparación con los que tenían un IAH <5.
El aumento de la sobrecarga de líquidos predice el empeoramiento de la AOS, y el tratamiento agresivo de la ESRD puede reducir la gravedad. La diálisis diaria, la diálisis nocturna y la diálisis peritoneal automatizada nocturna se han tratado en estudios observacionales con beneficios para la AOS relacionados con la reducción del IAH, la disminución de la congestión respiratoria y la mejora del aclaramiento urémico. El trasplante renal revierte muchas de las complicaciones metabólicas de la enfermedad renal terminal y ralentiza la progresión de las comorbilidades asociadas, pero su papel en el beneficio de la AOS sigue sin ser concluyente.
Aunque la AOS puede producirse como consecuencia de la ERC, existen pruebas de que también puede contribuir a la ERC y al descenso progresivo de la TFG. El SAOS también se ha asociado a una mayor morbilidad y mortalidad en pacientes con enfermedad renal terminal, lo que puede estar relacionado con los efectos agravantes de comorbilidades como las enfermedades cardiovasculares y cerebrovasculares, incluidas las arritmias, la enfermedad coronaria y el ictus.
La enfermedad renal inducida por la AOS puede explicarse por dos mecanismos principales: La hipertensión y la hipoxia intrarrenal con hiperfiltración glomerular. La médula renal es especialmente sensible a la hipoxia, lo que desencadena estrés oxidativo, inflamación sistémica y disfunción endotelial, dando lugar a lesiones tubulointersticiales, el sello distintivo de la ERC. Los episodios de apnea estimulan el sistema nervioso simpático y el sistema RAAS, lo que provoca hipertensión sistémica y glomerular, daño vascular y rigidez de la pared arterial, que culmina en isquemia renal.
En un estudio, la terapia con CPAP afectó positivamente a la hemodinámica renal en pacientes con una función renal normal al inicio, lo que sugiere un beneficio en la ralentización del daño renal. Sin embargo, el papel de la CPAP en la atenuación de la progresión de la disfunción renal en la AOS es incierto, con pocos estudios centrados en pacientes con ERC existente.
Apoplejía
Los trastornos respiratorios del sueño (TDS) suelen aparecer en pacientes tras un ictus. Aún no está claro si la AOS es un factor provocador, que potencia factores de riesgo vascular conocidos como la hipertensión, o una consecuencia de la lesión cerebral relacionada con el ictus.
El SAOS es un factor de riesgo de ictus y provoca un aumento de aproximadamente el doble en su incidencia. Un metaanálisis identificó una mayor incidencia de ictus en pacientes con SAOS no tratada, incluso después de tener en cuenta posibles factores de confusión como la edad, el IMC, la diabetes y la hipertensión arterial. Los estudios observacionales indican una reducción del riesgo de ictus en los pacientes con SAOS que reciben CPAP, especialmente en los pacientes cumplidores. Los ECA sugirieron que el cumplimiento del tratamiento durante más de 4 h podría aportar algún beneficio.
La prevalencia de la AOS es alta en el ictus, con un tercio de los supervivientes que documentan un IAH >30, aunque es posible que el ictus revele una AOS preexistente. La arquitectura del sueño tras un ictus puede afectar a los mecanismos de control respiratorio a nivel central, pero en particular, el ictus puede dañar la función muscular de las vías respiratorias superiores, aumentando la colapsibilidad.
Depresión
La depresión y la AOS pueden compartir síntomas similares, como falta de concentración, deterioro de la memoria y fatiga, lo que complica su evaluación clínica y diagnóstico (Fig. 2). Las alteraciones del sueño son un síntoma común autodeclarado de la depresión y pueden ser un síntoma predictivo del desarrollo posterior de depresión. Una teoría reciente es que las personas con depresión tienen un mayor riesgo de padecer AOS en etapas posteriores de su vida. Los mecanismos esperados subyacentes a cada proceso incluyen la fragmentación del sueño, los despertares frecuentes y los episodios hipóxicos intermitentes que conducen a la hipoperfusión cerebral y a la disfunción de los neurotransmisores. A pesar de la plausibilidad biológica, existen pocas investigaciones sobre las posibles relaciones bidireccionales y los resultados han sido contradictorios.
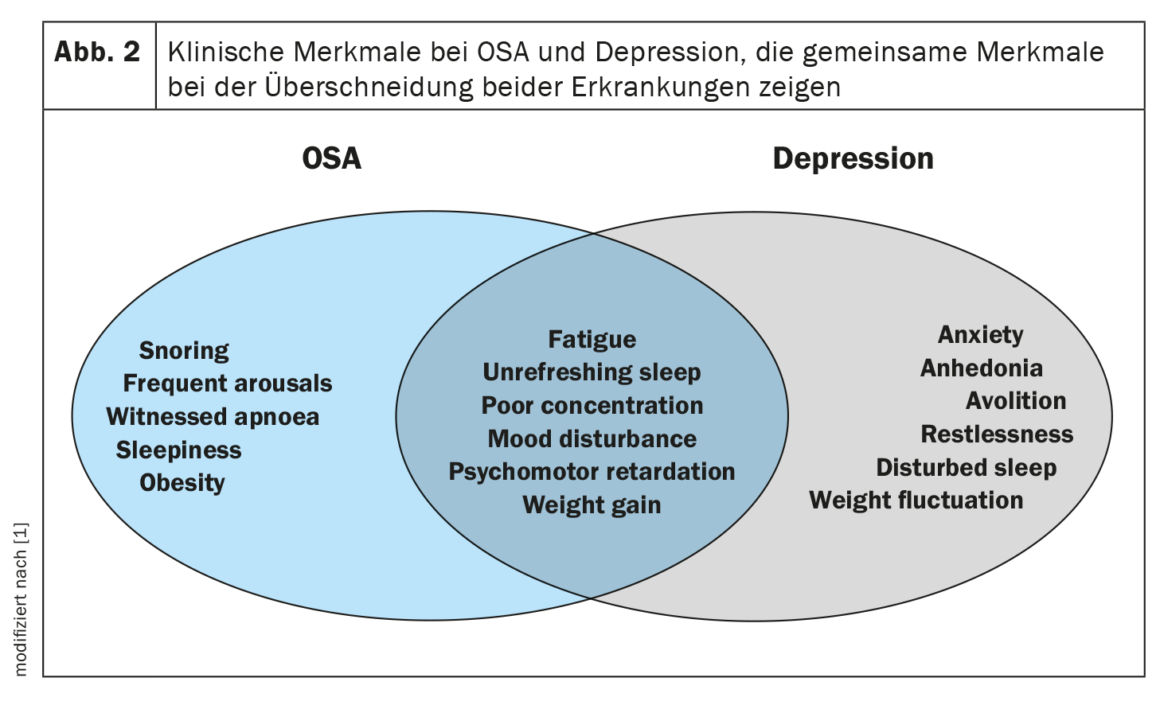
En las cohortes clínicas, la prevalencia de la depresión en la AOS oscila entre el 20 y el 40%, y parece haber un aumento de la proporción de probabilidades de depresión con el aumento de la gravedad del SDB. Sin embargo, otros estudios más pequeños informaron de que la presencia o la gravedad de la AOS no eran predictores independientes de las puntuaciones de depresión ni de los ingresos hospitalarios posteriores.
El tratamiento de la AOS con CPAP durante 5 o más horas por noche durante al menos 3 meses mejoró los síntomas depresivos, incluida la ideación suicida, independientemente del uso de antidepresivos.
Por el contrario, la depresión no ha sido bien estudiada como posible causa de la AOS. Los informes de prevalencia indican que el 15% de los pacientes psiquiátricos hospitalizados con trastorno depresivo mayor (TDM) presentan un IAH elevado en la polisomnografía nocturna y el 18% de los pacientes con TDM también cumplen los criterios diagnósticos de AOS.
Una revisión de estudios prospectivos con cinco antidepresivos diferentes descubrió que sólo dos tenían un efecto positivo sobre la reducción del IAH, pero ningún efecto sobre la somnolencia o la calidad del sueño. Además, la AOS no diagnosticada puede empeorar con algunos tratamientos farmacológicos dirigidos a la depresión, siendo el aumento de peso un posible factor. Las benzodiacepinas pueden aumentar la frecuencia y duración de los episodios de apnea al afectar al tono de las vías respiratorias superiores y al umbral de excitación.
Literatura:
- Gleeson M, McNicholas WT: Relaciones bidireccionales de comorbilidad con la apnea obstructiva del sueño. Eur Respir Rev 2022; 31: 210256; doi: 10.1183/16000617.0256-2021.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2023; 5(1): 24-25











