Una vez más, la Conferencia Europea sobre el Cáncer de Pulmón se celebró en Ginebra. También en esta ocasión, la atención se centró principalmente en el cáncer de pulmón de células no pequeñas. Se están investigando terapias dirigidas a variantes mutadas y no mutadas del EGFR solas o en combinación con quimioterapia. Varios de estos medicamentos ya están aprobados en la UE y en EE.UU. Además, se debatió un enfoque innovador del campo de la inmunología con una terapia en el campo del mesotelioma.
Están sucediendo cosas en el tratamiento del cáncer de pulmón no microcítico (CPNM). Por un lado, en el congreso se debatieron los resultados de los estudios sobre el osimertinib. Se trata de un potente inhibidor irreversible de la tirosina quinasa EGFR de tercera generación que ya ha sido aprobado en EE.UU. y la UE (aún no en Suiza). Dos resúmenes de última hora confirmaron su eficacia en el CPNM con mutación del EGFR, en particular en presencia de una mutación T790M. Una actualización de AURA P1 (fase I) y los datos agrupados de la extensión de AURA y AURA 2 (ambos ensayos de fase II) mostraron los siguientes resultados para el osimertinib a la dosis recomendada de 80 mg/día (oral):
- De los 63 pacientes del AURA P1, el 71% tuvo una respuesta objetiva que duró una mediana de 9,6 meses. La supervivencia sin progresión fue de 9,7 meses. Los efectos secundarios causales más frecuentes incluyeron erupciones cutáneas (37%, ninguna de grado 3) y diarrea (35%, de las que el 2% fueron de grado 3).
- De los 411 pacientes de los dos ensayos agrupados de fase II, el 66% tuvo una respuesta objetiva (según una revisión independiente) que duró una mediana de 12,5 meses. La supervivencia sin progresión fue de 11 meses. Al cabo de un año, el 47,5% de los participantes seguían libres de progresión. Una vez más, la erupción cutánea (41%, incluido un 1% de grado 3) y la diarrea (38%, incluido un 1% de grado 3) se encontraban entre los efectos secundarios causales más frecuentes.
Los datos agrupados de la fase II confirmarían claramente los resultados de AURA P1 y de publicaciones anteriores, afirmaron los ponentes. En pacientes con CPNM avanzado y la mutación EGFR T790M que han progresado con una terapia EGFR TKI previa, el osimertinib 80 mg/d proporciona una alta tasa de respuesta durante una duración relativamente larga con una supervivencia sin progresión alentadora (especialmente en comparación con los cuatro a cinco meses con quimioterapia) y un perfil de efectos secundarios manejable.
Según los autores, el diagnóstico molecular de la mutación T790M ya debería ser estándar. Los datos mostrarían claramente que los pacientes con un mecanismo de resistencia correspondiente se benefician del osimertinib.
El osimertinib también es eficaz en primera línea
La segunda presentación mostró datos de dos cohortes de fase I con osimertinib a la dosis de 80 o 160 mg/d, esta vez administrado como terapia de primera línea, es decir, en 60 pacientes sin tratamiento previo. También se trata de una actualización del estudio AURA. Los pacientes tenían un CPNM localmente avanzado o metastásico con mutación del EGFR (cinco de ellos eran T790M positivos). La mediana de seguimiento fue de 16,6 meses. La tasa de respuesta objetiva global fue del 77% (67% en la cohorte de 80 mg y 87% en la de 160 mg). Los pacientes permanecieron libres de progresión durante una mediana de 19,3 meses. Al cabo de un año y medio, un total de 55% resp. ninguna progresión en el 57% (80 mg) y el 53% (160 mg) según la cohorte.
Los acontecimientos adversos más frecuentes fueron diarrea (60% y 87%, respectivamente, de los cuales 0% y 7% fueron de grado 3 o superior), estomatitis (43% y 50%, respectivamente, de los cuales 0% y 3% fueron de grado 3 o superior) y paroniquia (30% y 53%, respectivamente, de los cuales 0% y 7% fueron de grado 3 o superior). Al 10% (80 mg) resp. En el 47% (160 mg) de los pacientes fue necesario reducir la dosis para controlar los efectos secundarios.
¿El tratamiento con osimertinib modifica la biología del tumor?
El osimertinib también mostró potencial en el escenario de primera línea, concluyeron los autores. Es una de las mejores tasas de respuesta global logradas con terapias de primera línea para el CPNM con mutación del EGFR, y la supervivencia sin progresión también supera con creces la experiencia con los fármacos correspondientes de primera y segunda generación (aprox. 10-13 meses). Muchos pacientes aún no han mostrado progresión y siguen beneficiándose del osimertinib.
Además, en aquellos con enfermedad progresiva, la mutación T790M no parece ser responsable de la resistencia, según muestran los datos iniciales. Es posible que el uso de osimertinib en primera línea modifique la biología del tumor. El perfil de seguridad es bueno, especialmente en la dosis más baja (aprobada); una tasa del 10% de pacientes con reducciones de dosis se considera baja.
Otros estudios en preparación
La inhibición del EGFR es actualmente el tratamiento estándar para los pacientes con CPNM con mutaciones activadoras del EGFR. A través de la mutación T790M, el 50-60% de los pacientes desarrollan resistencia al tratamiento. El osimertinib es especialmente útil para estos pacientes porque inhibe con potencia las mutaciones originales del EGFR (exón 19 y 21), pero también la mutación T790M del EGFR. Con el osimertinib, la resistencia puede retrasarse, el tumor aparentemente tiene que buscar nuevos mecanismos de resistencia además de la mutación EGFR T790M. La claridad sobre las ventajas del inhibidor de tercera generación en primera línea la aportará ahora un ensayo de fase III con más de 500 pacientes, en el que se está comparando el osimertinib con el erlotinib y el gefitinib. Los resultados se esperan en aproximadamente un año y medio.
Necitumumab: los pacientes con tumores que expresan EGFR son los más beneficiados
Además del osimertinib, también se presentaron nuevos datos sobre el necitumumab. Este anticuerpo monoclonal también se dirige al EGFR y se administra junto con quimioterapia (gemcitabina y cisplatino) en pacientes con CPNM con carcinoma de células escamosas avanzado. El necitumumab ya está aprobado en EE.UU. y la UE.
Los datos presentados en el congreso procedían del ensayo SQUIRE (fase III) y se referían al subgrupo de pacientes con tumores que expresan EGFR (95% de la población evaluada [n=982]). Mientras que el 5% de los pacientes sin proteína EGFR no mostraron ningún beneficio, el 95% con tumores que expresaban EGFR mostraron una mejora significativa de la supervivencia global y libre de progresión del 21% y el 16% respectivamente (en comparación con la quimioterapia sola), un beneficio ligeramente mayor que en la población general. Dado el mecanismo de acción del necitumumab, se trata de un resultado obvio: donde no hay receptor y, por tanto, no hay diana, el fármaco no puede unirse. Por tanto, según la EMA, el necitumumab sólo está aprobado para pacientes con tumores que expresan EGFR, mientras que la FDA decidió basarse en la población total de SQUIRE y no especificó más la aprobación.
Ni siquiera este análisis de subgrupos permite extraer una conclusión firme, ya que el grupo de pacientes sin tumores que expresan EGFR era claramente demasiado pequeño (5% o sólo 47 pacientes) y el diseño del estudio no estaba dirigido a estos pacientes. Habrá que esperar a estudios más amplios para poder afirmar con certeza si los pacientes con tumores EGFR negativos también se benefician o no del necitumumab.
¿Una bacteria ayuda contra el mesotelioma?
El mesotelioma pleural maligno es una enfermedad poco frecuente pero muy agresiva y de mal pronóstico. El tratamiento es difícil y actualmente consiste en quimioterapia estándar con pemetrexed y platino. Se consiguen tasas de respuesta de alrededor del 30%, pero el beneficio para la supervivencia es bajo. Por lo tanto, se necesitan nuevos enfoques de tratamiento. Una de ellas promete inmunoterapia con una bacteria viva llamada CRS-207, una forma atenuada de Listeria monocytogenes con dos deleciones genéticas, para reducir la patogenicidad. La bacteria fue diseñada para expresar mesotelina, un antígeno que sobreexpresan varios tumores, entre ellos el mesotelioma, y que es importante para la supervivencia de las células. Así pues, se cree que el CRS-207 induce una respuesta anti-mesotelina y, por tanto, una respuesta inmunitaria endógena, adaptativa y específica del tumor. Junto con la quimioterapia, se altera el microentorno tumoral y se posibilita la destrucción inmunomediada de las células tumorales.
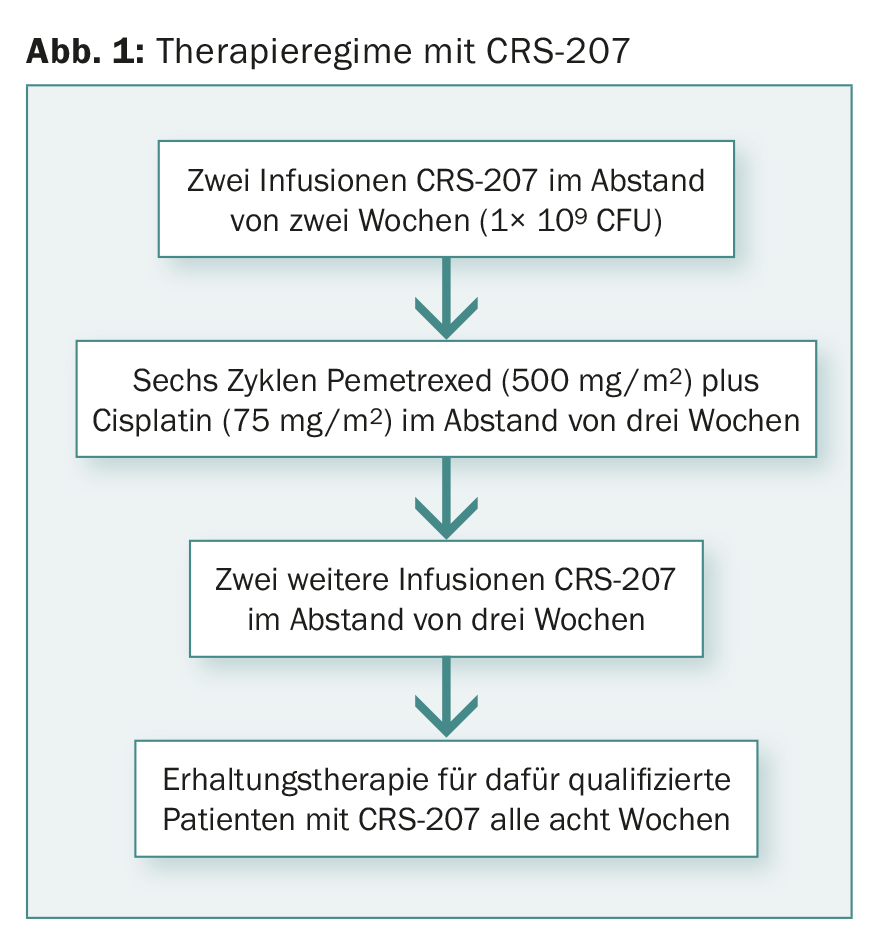
En el ensayo de fase Ib participaron pacientes con plauramesotelioma avanzado no resecable que no habían recibido quimioterapia. En el momento de la presentación, se habían evaluado los datos de 38 pacientes. La figura 1 muestra el régimen terapéutico.
La inmunohistoquímica detectó un aumento de los linfocitos infiltrantes del tumor tras el tratamiento con RSC. Tras una mediana de seguimiento de 9,4 meses, el 59% de los tratados mostraron una respuesta parcial. En el 35%, la enfermedad estaba estable. En conjunto, esto da una tasa de control de la enfermedad del 94%. Por término medio, los pacientes vivieron 8,5 meses sin progresión.
No se asociaron al tratamiento efectos secundarios graves ni muertes. Se notificaron con mayor frecuencia fiebre, bajadas de temperatura/rigor, hipotensión, náuseas y vómitos (grado 1 y 2). La mayoría de los efectos secundarios estaban relacionados con la propia infusión y remitieron al cabo de 24 horas.
En realidad se estimula la respuesta inmunitaria
Una respuesta de casi el 60% con una tasa global de control de la enfermedad superior al 90% resultó alentadora, resumieron los ponentes. Además, el nuevo enfoque no sólo midió los linfocitos infiltrados en el tumor, sino también los cambios correspondientes en las células inmunitarias circulantes y los biomarcadores séricos. Por ejemplo, se midió un aumento de macrófagos, células CD8+ infiltrantes y células asesinas naturales. De este modo, podría iniciarse realmente la respuesta inmunitaria específica y no específica con el consiguiente control sinérgico del tumor en combinación con la quimioterapia.
La terapia se investigará ahora más a fondo en ensayos de fase III, ya que parece producir resultados significativamente mejores que la quimioterapia sola. El perfil de seguridad y tolerabilidad del nuevo enfoque también es sorprendentemente bueno; no parece que se produzcan toxicidades acumulativas.
Fuente: ELCC 2016 European Lung Cancer Conference, 13-16 de abril de 2016, Ginebra.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(4): 30-32