La anticoagulación debe adaptarse individualmente al sistema de soporte y al paciente. Se ha demostrado que los pacientes con sistemas no pulsátiles han adquirido el síndrome de von Willebrand, lo que aumenta el riesgo de complicaciones hemorrágicas. Aún no se han realizado estudios con nuevos anticoagulantes orales en pacientes con dispositivos de asistencia cardiaca. Por lo tanto, no se han aprobado nuevos anticoagulantes orales para pacientes con DAVI.
Los dispositivos de asistencia ventricular (DAV) son ahora un tratamiento establecido para la insuficiencia cardiaca terminal. Por ejemplo, en 2012 se implantaron en todo el mundo más dispositivos de asistencia ventricular izquierda que corazones. En Suiza se realizaron el año pasado 33 trasplantes de corazón frente a 116 pacientes en lista de espera para un trasplante de corazón. El tiempo de espera para un donante de corazón fue de 179 días en 2009. Esto explica la creciente importancia de los sistemas de apoyo disponibles sin límites.
Aunque aún no se dispone de datos a largo plazo de más de diez años, las tasas de supervivencia a 1 y 2 años tras la implantación de un DAV son muy prometedoras, por lo que muchos sistemas se utilizan ahora no sólo como puente al trasplante de corazón, sino también como solución definitiva.
Sistemas de DAV en Suiza
En el caso de los sistemas de asistencia cardiaca, hay que distinguir entre sistemas pulsátiles y no pulsátiles. Las bombas no pulsátiles se han convertido en predominantes en los sistemas de asistencia ventricular izquierda. Las bombas pulsátiles se utilizan principalmente para el soporte cardíaco biventricular o ventricular derecho a largo plazo.
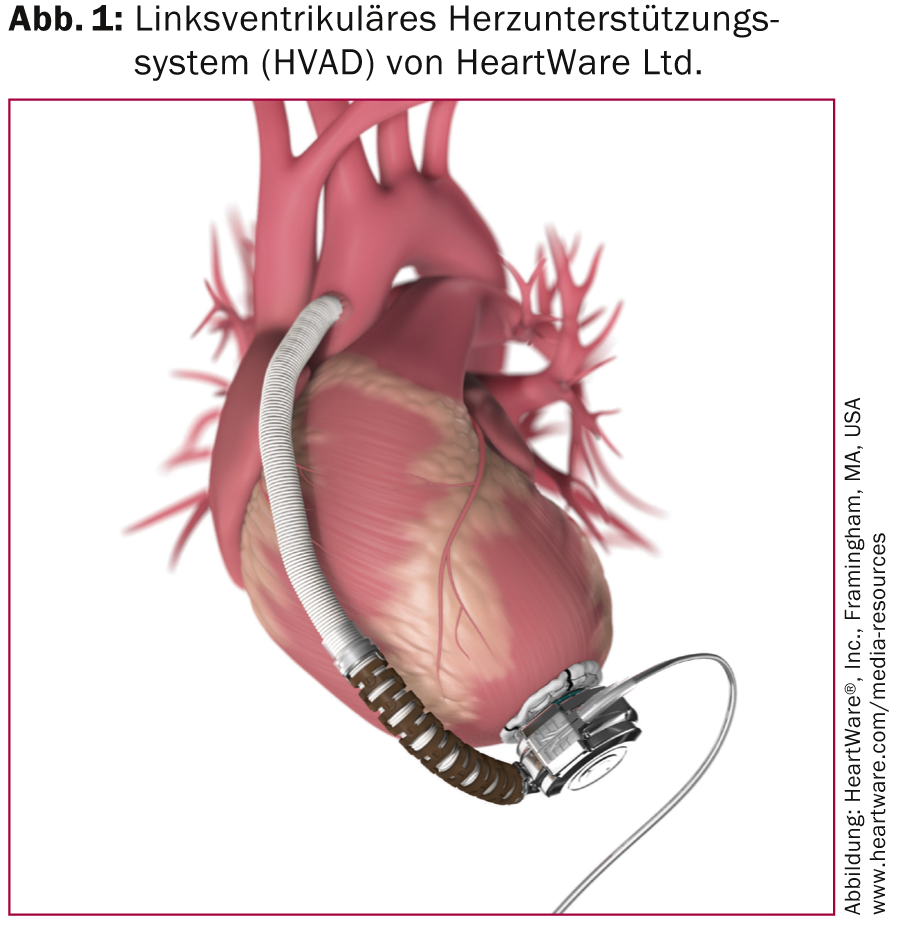
Los dispositivos de asistencia ventricular izquierda implantados con más frecuencia son el HVAD (Fig. 1) y el HeartMate II (Fig. 2).

En la tabla 1 se ofrece una visión parcial de los sistemas existentes en el mercado.

Anticoagulación
En el postoperatorio, sin embargo, la anticoagulación también debe adaptarse individualmente al paciente, en función de la bomba.
Sistemas de apoyo temporales: Los sistemas provisionales suelen anticoagularse continuamente con heparina durante su corta duración. Según la empresa, en el momento de la implantación debe haber un ACT de >300 s. En el curso posterior, el ACT objetivo se sitúa entre 160 y 180 s y el PTT objetivo es un aumento de 1,5-1,8 veces [1, 2].
Sistemas de apoyo a largo plazo no pulsátiles: En la mayoría de los casos, la implantación de un DAV se realiza con el uso de la máquina cardiopulmonar, por lo que se requiere la administración de heparina con un ACT >400 s intraoperatoriamente. Si la implantación se realiza sin circulación extracorpórea, debe alcanzarse un ACT de >200 s durante la implantación. Tras la parada de la máquina de circulación extracorpórea o al final de la operación, la heparina se antagoniza por completo.
La anticoagulación adicional sólo debe iniciarse después de 24h. El objetivo de la PTT está entre 40 y 60 s en el primer o segundo día postoperatorio.
Para las bombas centrífugas, el objetivo de PTT debe aumentarse a 60-80 s a partir del segundo o tercer día postoperatorio. Después de cambiar a warfarina, el INR recomendado está entre 2,0 y 3,0. Puede iniciarse un tratamiento antiagregante plaquetario adicional, por ejemplo aspirina (81-325 mg/tgl.), desde el primer día postoperatorio y debe administrarse como muy tarde tras la retirada de los tubos torácicos.
Para la bomba axial HeartMate II, el objetivo de TPT es ligeramente inferior del segundo al tercer día postoperatorio (60-75 s) y el objetivo de INR tras el cambio a warfarina se sitúa entre 2,0 y 3,0 (según datos de la empresa). Para la agregación plaquetaria, la aspirina es de 81-325 mg/tgl. recomendada [3].
Tras el ajuste individual de la dosis de warfarina, debe comprobarse además la agregación plaquetaria mediante una prueba de agregación plaquetaria o, si se administra clopidogrel, mediante una prueba VASP y ajustarse individualmente.
Sistemas pulsátiles de apoyo a largo plazo: Para el DAV de Thoratec, la heparina, PTT objetivo con un aumento de 1,5 veces, debe iniciarse tras la reducción de la hemorragia a menos de 50 ml/h. Al cambiar a warfarina, el INR objetivo es de 2,5-3,5. Para la agregación plaquetaria, pueden añadirse 100 mg de aspirina al día [4].
Excor requiere un INR de 3,0-3,5 en adultos y una agregación plaquetaria de al menos 75 mg al día de aspirina y dipiridamol a un mínimo de 150 mg al día, que debe ajustarse al recuento de plaquetas [5].
Para el seguimiento ambulatorio, cada paciente debe recibir un Coagu-Check.
Trastornos de la coagulación: El síndrome de von Willebrand adquirido se ha demostrado en algunos sistemas no pulsátiles. Las fuerzas de cizallamiento de las bombas axiales y centrífugas alteran la estructura del factor von Willebrand para que pueda ser escindido por la metaloproteinasa ADAMTS13 [6]. Por lo tanto, hay una ausencia de los grandes multímeros que son los principales responsables de la hemostasia primaria (Fig. 3).

Además, no está del todo claro hasta qué punto se produce un cambio en las plaquetas como resultado de las bombas de soporte. Por ejemplo, se habla del daño a los receptores plaquetarios (GPIb-V-IX) debido al esfuerzo cortante [7], pero también de la reducción de la agregación plaquetaria debida a los productos de escisión del factor von Willebrand [8, 9].
Aún no se han realizado estudios con nuevos anticoagulantes orales en pacientes con dispositivos de asistencia cardiaca. Un estudio con heparina de bajo peso molecular hasta la interrupción con warfarina tras la implantación de un dispositivo de asistencia ventricular izquierda [10] mostró una mayor tasa de ictus en los primeros 30 días tras la deducción del tiempo perioperatorio de 48 h con un 2,5 frente a ≤0,7% [11, 12].
Anticoagulación para las complicaciones
Hemorragia: Los factores de riesgo multivariables de una mayor tasa de hemorragia tras la implantación de un DAV son la edad, el sexo femenino, la cardiomiopatía isquémica y un hematocrito preoperatorio más bajo [13]. Aún debe investigarse hasta qué punto la anticoagulación adaptada supone una mejora para estos subgrupos.
En pacientes con hemorragia gastrointestinal, un algoritmo de Suárez et al. [14, 15], según el cual primero debe interrumpirse la anticoagulación completa. Si se identifica y trata la fuente de la hemorragia, debe iniciarse primero la warfarina y continuar con la inhibición de la agregación plaquetaria. Si hay más complicaciones hemorrágicas, el INR puede reducirse a 1,5-2,0.
Para detener la hemorragia cuando no se identifica el origen de la misma, se recomienda la administración de factores de coagulación como concentrados de protrombina o Haemate®, concentrados de plaquetas, octreotida y desmopresina.
Trombosis de la bomba: En pacientes con sospecha de trombosis de la bomba con parámetros de hemólisis elevados, primero debe optimizarse la coagulación y, si es necesario, debe administrarse heparina continua. Si la sospecha persiste, se recomienda la administración de inhibidores de la trombina. Si esto no da lugar a un tratamiento exitoso, debe considerarse la sustitución del dispositivo de asistencia ventricular o la realización de una terapia de lisis [16]. Si se cura, debe considerarse un INR elevado con la adición de un segundo agente antiplaquetario en el curso posterior [17].
Anticoagulación durante la cirugía: Según las directrices del Colegio Americano de Médicos de Tórax, debe suspenderse la warfarina de cinco a seis días antes y un agente antiplaquetario siete días antes de una operación programada con un mayor riesgo de hemorragia y cambiar a heparina [18]. No existen directrices para pacientes con DAV en cirugía no cardiaca, sin embargo, en un artículo de Morgan et al. demostraron que el cambio de warfarina y AAS a heparina con pausa perioperatoria de la heparina producía menos complicaciones hemorrágicas [19]. En caso de urgencia o cirugía urgente, pueden administrarse PFC, concentrados de protombina o vitamina K [3]. Para la cirugía menor, como la extracción de dientes o la cirugía cutánea, se recomienda la anticoagulación continuada con warfarina y AAS para los pacientes sin DAVL. Un enjuague oral con ácido tranexámico y la hemostasia local con esponjas de colágeno y pegamento de fibrina, así como el uso de una férula dental, pueden prevenir además la hemorragia [20].
Dra. Anna L. Meyer
Literatura:
- Oliver WC: Anticoagulación y gestión de la coagulación para EMCO. Semin Cardiothorac Vasc Anesth 2009; 13(3): 154-175.
- http://columbialvad.org/pdf/centrimag.pdf.
- Feldmann D, et al: Directrices de la Sociedad Internacional de Trasplante de Corazón y Pulmón de 2013 para la asistencia circulatoria mecánica: resumen ejecutivo. J Heart Lung Transplant 2013; 32(2): 157-187.
- www.thoratec.com/_assets/download-tracker/15579-A.pdf.
- www.berlinheart.de/UserFiles/Downloaddokumente/Medical_Professionals_Distributoren/Non_US/EXCOR_Parakorporales_Herzunterstuetzungssystem/Gebrauchsanweisungen/EXCOR_VAD_Ikus_Antrieb/Ikus_Rev_2_1_Software_3_40/Gebrau3.40AMRev80en.pdf.
- Tsai HM: La escisión fisiológica del factor von Willebrand por una proteasa plasmática depende de su conformación y requiere ión calcio. Sangre 1996; 87(10): 4235-4244.
- Himmelfarb J, et al: Niveles elevados de plasmaglicocalicina y disminución de la aglutinación plaquetaria inducida por ristocetina en pacientes en hemodiálisis. Am J Kidney Dis 1998; 32(1): 132-138.
- Sugimoto M, et al.: Modulación funcional del dominio aislado de unión a la glicoproteína Ib del factor von Willebrand expresado en Escherichia coli. Bioquímica 1991; 30(21): 5202-5209.
- Alevriadou BR, et al.: Análisis en tiempo real de la formación de trombos dependientes del cizallamiento y su bloqueo mediante inhibidores de la unión del factor von Willebrand a las plaquetas. Sangre 1993; 81(5): 1263-1276.
- Sandner SE, et al: Heparina de bajo peso molecular para la anticoagulación tras la implantación de un dispositivo de asistencia ventricular izquierda. J Heart Lung Tranplant 2014; 33(1): 88-93.
- Starling RC, et al: Results of the post-U.S. Food and Drug Administration-approval study with a continuous flow left ventricular assist device as a bridge to heart transplantation: a prospective study using the INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll Cardiol 2011; 57(19): 1890-1898.
- Miller LW, et al: Uso de un dispositivo de flujo continuo en pacientes en espera de un trasplante de corazón. N Engl J Med 2007; 357(9): 885-896.
- Boyle AJ, et al: Factores de riesgo preoperatorio de hemorragia e ictus durante el soporte del dispositivo de asistencia ventricular izquierda: un análisis de más de 900 pacientes ambulatorios de HeartMate II . J Am Coll Cardiol 2014; 63(9): 880-888.
- Suárez J, et al: Mecanismos de hemorragia y abordaje de pacientes con dispositivos de asistencia ventricular izquierda de flujo axial. Circ Heart Fail 2011; 4(6): 779-784.
- Tamez D, et al: Pruebas tempranas de viabilidad y desarrollo de ingeniería del abordaje transapical para el sistema de asistencia ventricular HeartWare MVAD. ASAIO J 2014; 60(2): 170-177.
- Schlendorf K, et al: Terapia trombolítica para la trombosis de dispositivos de asistencia ventricular de flujo continuo. J Card Fail 2014; 20(2): 92-97.
- Goldstein DJ, et al: Algoritmo para el diagnóstico y tratamiento de la sospecha de trombo de bomba. J Heart Lung Transplant 2013; 32(7): 667-670.
- Douketis JD, et al: Perioperative management of antithombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis,9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl): e326S-350S.
- Morgan JA, et al: Cirugía no cardiaca en pacientes con asistencia ventricular izquierda a largo plazo. J Heart Lung Transplant 2012; 31(7): 757-763.
- Lund JP, et al: Tratamiento quirúrgico oral de pacientes con asistencia circulatoria mecánica. Int J Oral Maxillofac Surg 2002; 31(6): 629-633.
CARDIOVASC 2014; 13(2): 18-20