Tras la implantación de un stent, la trombosis del mismo es una de las complicaciones agudas más importantes. Por lo tanto, está indicada una inhibición eficaz de la agregación plaquetaria. Pero, ¿qué aspecto tiene esto?
En los primeros tiempos de la angiografía coronaria, las lesiones se trataban inicialmente sólo mediante dilatación con balón. No fue hasta mediados de la década de 1980 cuando se desarrollaron los primeros stents [1,2]. Desde entonces, la tecnología de los stents, pero también las posibilidades en el campo de la inhibición de la agregación plaquetaria, no han dejado de desarrollarse.
Papel de la terapia antiplaquetaria dual (DAPT) y su desarrollo
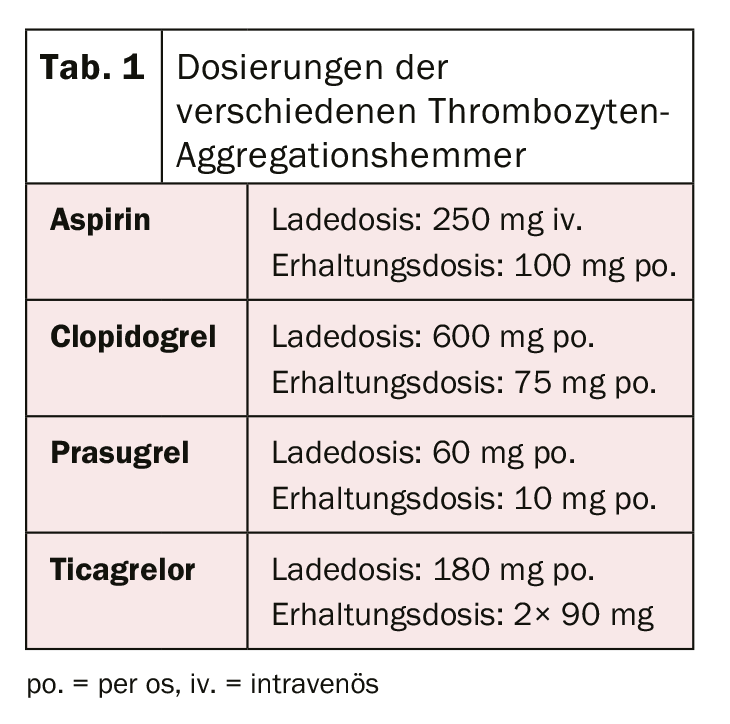
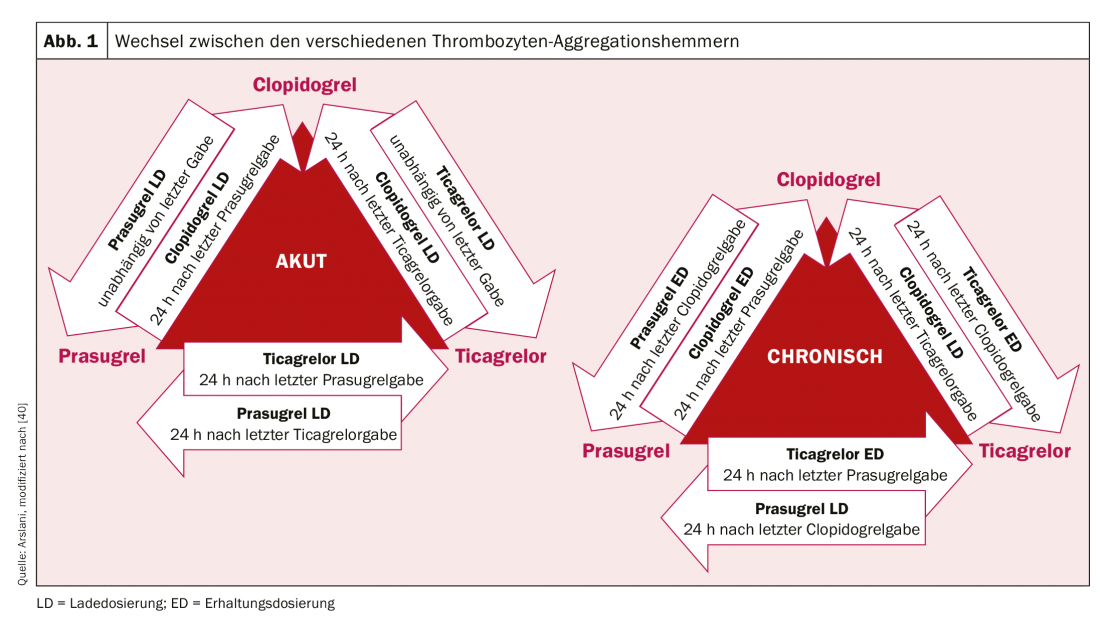
Tras la revolución que supuso la implantación del primer stent en 1986 por Sigwart et al. [2], las primeras dificultades y complicaciones asociadas se hicieron patentes con relativa rapidez. La complicación aguda más importante tras la implantación de un stent es y sigue siendo la trombosis del stent, que se produjo a una tasa de casi el 20% en los primeros días. Para evitarlo, se han evaluado diversas terapias para el adelgazamiento de la sangre o la inhibición de la agregación plaquetaria tras la implantación de un stent. Después de que el tratamiento con dextrano de bajo peso molecular, aspirina (AAS), dipiridamol y heparina intravenosa no lograra los resultados deseados, los pacientes fueron anticoagulados sistemáticamente por vía oral con warfarina tras la implantación del stent. Aunque esto dio lugar a una reducción significativa de la trombosis aguda y subaguda del stent hasta el 3,5%, también se asoció a un aumento significativo de las complicaciones hemorrágicas. [3–5]. En la búsqueda del equilibrio ideal entre la prevención de la temida trombosis del stent y el mayor riesgo de hemorragia, se investigaron posteriormente otros regímenes terapéuticos. La inhibición doble (dual) de la agregación plaquetaria pareció ser la más eficaz. Por ejemplo, un estudio de Leon et al. demostró que se podía conseguir una reducción significativa de la trombosis del stent y de las complicaciones asociadas mediante una terapia combinada con AAS y ticlopidina. [6,7]. Como se produjeron efectos secundarios graves con la ticlopidina (como alergias, úlceras, diarrea, disfunción hepática y neutropenia), este fármaco se sustituyó rápidamente por el mucho mejor tolerado clopidogrel [8]. El AAS impide la activación plaquetaria mediada por tromboxano y el clopidogrel la mediada por ADP, por lo que ambos bloqueos actúan de forma aditiva y, por tanto, la inhibición y, por ende, también la reducción de la formación de trombos es significativamente más eficaz que con la monoterapia. El clopidogrel es un profármaco que se metaboliza primero en el hígado por el citocromo P450 2C19 y otras enzimas CYP, y su metabolito activo se une posteriormente de forma irreversible a los receptores P2Y12 de las plaquetas, reduciendo así la activación plaquetaria mediada por ADP. Dado que las enzimas que activan el clopidogrel en el hígado son genéticamente diferentes, el efecto inhibidor de las plaquetas del clopidogrel no es igual de pronunciado en todas las personas. Tras la colocación electiva de un stent, también se demostró la eficacia de la terapia antiplaquetaria dual con AAS y clopidogrel en pacientes con infarto agudo de miocardio sin elevación del ST mediante una reducción significativa de los acontecimientos cardiovasculares [9]. Se consiguió una mayor optimización de la inhibición de la agregación plaquetaria mediante el uso de nuevos inhibidores del receptor P2Y12. El prasugrel también es un profármaco del grupo de las tienopiridinas, también se metaboliza (o activa) en el hígado y también se une de forma irreversible, pero más rápida y fuerte, a dichos receptores. Además, a diferencia del clopidogrel, no existen diferencias determinadas genéticamente en la activación del prasugrel. El estudio TRITON-TIMI 38 [10] demostró que el prasugrel producía una mayor reducción de los acontecimientos cardiovasculares en comparación con el clopidogrel. A pesar del aumento de las complicaciones hemorrágicas, el beneficio clínico se demostró claramente a favor del prasugrel, con una reducción significativa de los criterios de valoración isquémicos (excepto en pacientes de edad ≥75 años, bajo peso corporal (<60 kg) y en pacientes tras acontecimientos cerebrovasculares). Debido al mayor riesgo de hemorragia, también debe conocerse el estado coronario antes de administrar prasugrel o la intención de implantar un stent. Actualmente, la carga preintervencionista sólo se recomienda para el infarto de miocardio con elevación del segmento ST [11]. El ticagrelor pertenece a la clase de las ciclopentilriazolopirimidinas y es un inhibidor de P2Y12 competitivo y, por tanto, reversible, que se toma como metabolito activo (sin activación enzimática). En el estudio PLATO [12], el ticagrelor también demostró ser superior al clopidogrel. Se demostró una reducción de la muerte cardiovascular, el infarto de miocardio y la trombosis del stent y no hubo pruebas de un aumento de las complicaciones hemorrágicas. Sin embargo, en comparación con otros estudios, en algunos casos se utilizaron definiciones de hemorragia diferentes. A diferencia del prasugrel, el efecto positivo también se observó en pacientes tratados de forma conservadora (sin intervención ni colocación de stent) o mediante cirugía de derivación [12,13]. En pacientes con infarto de miocardio con elevación del segmento ST, el tratamiento previo con ticagrelor antes de la angiografía coronaria también ha demostrado dar lugar a menores tasas de trombosis del stent [14]. Por desgracia, aún no se ha realizado una comparación entre las sustancias ticagrelor y prasugrel. La dosis inicial de carga y la dosis de mantenimiento de los diferentes fármacos se resumen en la tabla 1. En la práctica clínica diaria, puede ser necesario cambiar de un preparado a otro (por ejemplo, en caso de intolerancia al fármaco). En la figura 1 se muestra el algoritmo para cambiar de un preparado a otro según el contexto clínico (crónico frente a agudo).
Desarrollo de las endoprótesis
Como ya se ha mencionado, en los primeros tiempos del intervencionismo coronario, el vaso se trataba únicamente mediante dilatación con balón. Sin embargo, debido a la disección, al retroceso elástico en caso de sobreestiramiento y a la remodelación tardía con proliferación intimal, a menudo se producía una nueva oclusión del vaso y una reestenosis. Para contrarrestarlo y mantener los vasos abiertos tras la dilatación, se desarrollaron mallas vasculares autoexpandibles o con balón (stents), que se implantaban tras un tratamiento previo mediante dilatación con balón. Al principio, estos stents eran difíciles de utilizar debido a su naturaleza, al material utilizado y a la técnica de implantación, aún joven (en su mayoría de acero inoxidable con struts de stent gruesos). Con el tiempo, sin embargo, estas endoprótesis metálicas (hoy también conocidas como endoprótesis metálicas sin recubrimiento, BMS, por sus siglas en inglés) se perfeccionaron para que ahora fueran mucho más fáciles de usar (implantación mediante expansión con balón, struts de endoprótesis más finos, aleaciones más ligeras). Aunque en los primeros tiempos se demostró que los BMS son superiores a la simple dilatación con balón [3,4], la evolución a largo plazo mostró tasas relevantes de reestenosis instensiva debida a una proliferación intimal excesiva. Para contrarrestar esta proliferación, se desarrollaron los llamados stents liberadores de fármacos (DES). Los DES de primera generación se fabricaban con las mismas aleaciones que los BMS pero se recubrían con un fármaco antiproliferativo liberado por polímeros como el sirolimus o el paclitaxel. Esto condujo a una reducción de la formación de neoíntima y, por tanto, a una disminución significativa de la reestenosis instintiva [15–17]. Sin embargo, debido al retraso en la endotelización causado por los fármacos antiproliferativos y, por tanto, a un contacto más prolongado de los struts del stent con el torrente sanguíneo, varios estudios mostraron una tasa significativamente mayor de trombosis tardía del stent y de infarto de miocardio [18,19]. En respuesta, se siguió desarrollando no sólo la inhibición de la agregación plaquetaria, sino también la composición del stent. En los DES de segunda y tercera generación, se han utilizado polímeros biocompatibles y fármacos más eficaces, como el everolimus, en dosis más bajas para el recubrimiento, lo que ha dado lugar a una endotelización más rápida y mejor de los stents. Junto con la mejora del DAPT, se ha podido demostrar una mejora significativa de la seguridad con la misma eficacia con los DES que se utilizan hoy en día en comparación con los DES de primera generación [20,21], lo que ha llevado prácticamente a la desaparición de los BMS sin recubrimiento. En un paso más, además de las nuevas endoprótesis, la dilatación con balón también se ha desarrollado ahora más y es posible tratar vasos más pequeños utilizando balones recubiertos de fármacos (DCB) sin necesidad de implantar endoprótesis [22].
Duración del DAPT tras la implantación del stent
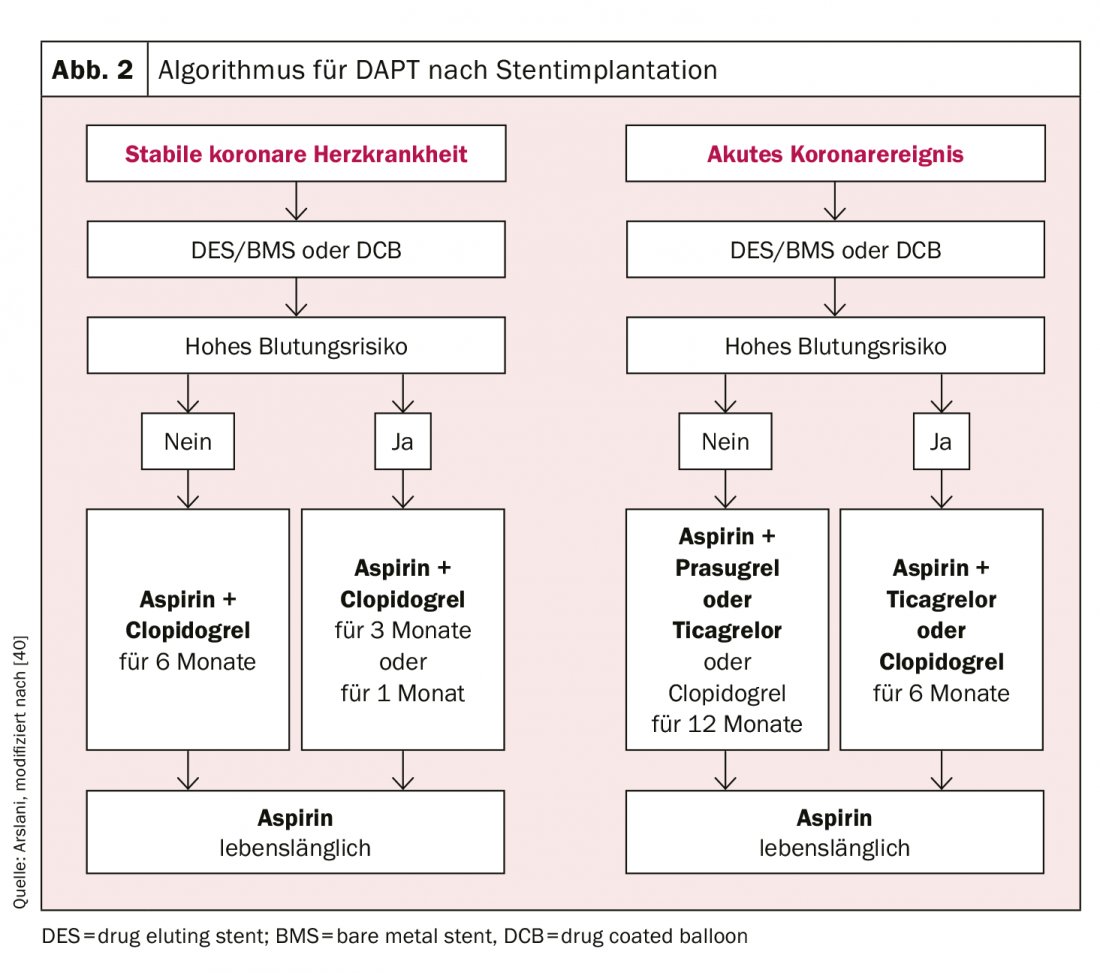
En cuanto a la duración del DAPT, debe hacerse una clara distinción entre los pacientes con infarto agudo de miocardio y los pacientes con enfermedad arterial coronaria estable. En pacientes con enfermedad arterial coronaria estable, se ha demostrado que no hay diferencias en los acontecimientos cardiovasculares y la muerte entre una duración del tratamiento de 6 meses y ≥12 meses [23,24]. Por otro lado, se produjo un aumento significativo de las complicaciones hemorrágicas relevantes con una duración del tratamiento superior a 12 meses y hubo indicios de un aumento de la mortalidad [25,26]. Dado que no se han realizado estudios con TAPD consistente en AAS y ticagrelor o prasugrel en pacientes con enfermedad arterial coronaria estable, se recomienda el TAPD con clopidogrel en este contexto. Sin embargo, en pacientes seleccionados con alto riesgo isquémico, puede optarse por uno de los otros fármacos. En resumen, se recomienda una terapia antiplaquetaria dual con AAS y clopidogrel durante 6 meses en pacientes con enfermedad coronaria estable tras una intervención, independientemente del tipo de stent, y también tras el tratamiento con un DCB solo [27]. Si existe un mayor riesgo de hemorragia (puntuación Precise-DAPT ≥25, www.precisedaptscore.com) [28], la duración de la terapia puede reducirse a 3 meses [29,30] y en casos seleccionados también a 1 mes [31,32]. Sin embargo, si se reduce la duración de la terapia (especialmente a 1 mes), debe sopesarse cuidadosamente el riesgo de recurrencia de los episodios cardiovasculares frente al riesgo de hemorragia.
Las recomendaciones para los pacientes tras un síndrome coronario agudo se basan en los estudios comparativos de prasugrel o ticagrelor con clopidogrel. Estos estudios son la base de la recomendación actual de que los pacientes reciban una terapia antiplaquetaria dual con AAS y ticagrelor o prasugrel durante 12 meses tras un acontecimiento agudo, también independientemente del tipo de stent [9,10,12]. Según los datos actuales, en particular el estudio PEGASUS [33] La terapia antiplaquetaria dual prolongada sólo debe utilizarse en pacientes con riesgo isquémico aumentado (edad ≥50 años y más de uno de los siguientes factores: >65 años, diabetes mellitus que requiera tratamiento, infarto de miocardio posterior, enfermedad coronaria multivaso o insuficiencia renal con un aclaramiento de <60 ml/min) y sin complicaciones hemorrágicas previas. La terapia con ticagrelor 60 mg dos veces al día es preferible [27]. También es posible una reducción de la duración de la terapia a 6 meses con un riesgo aceptable en caso de un mayor riesgo de hemorragia (puntuación Precise-DAPT ≥25) [28]. En los datos disponibles hasta la fecha, sólo una reducción a <6 meses mostró un aumento sustancial de los eventos cardiovasculares.
Anticoagulación y DAPT
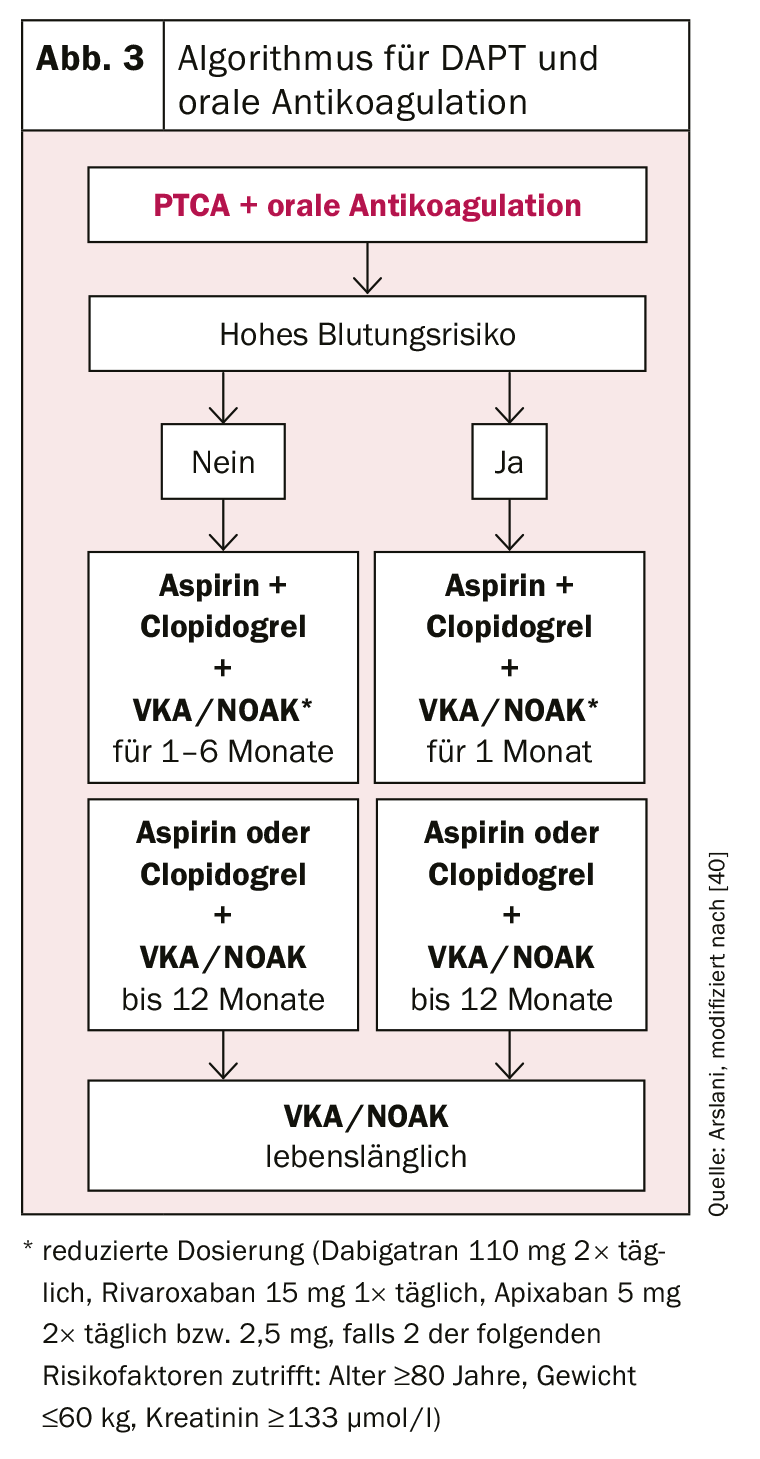
Otro reto lo plantean los pacientes con indicación de anticoagulación oral. Aquí también es importante encontrar el equilibrio ideal entre el riesgo de hemorragia y los riesgos de trombosis del stent o de acontecimientos cardiovasculares. Se recomienda una terapia triple con AAS, clopidogrel y anticoagulación oral establecida con un antagonista de la vitamina K (AVK) o uno de los nuevos anticoagulantes orales (NOAK). El valor de INR al que debe aspirarse debe seleccionarse en el límite inferior (INR 2-2,5) y la dosis más baja aprobada para la prevención de acontecimientos cerebrovasculares debe seleccionarse para los NOAK (dabigatrán 110 mg 2× día, rivaroxaban 15 mg 1× día, apixaban 5 mg 2× al día o 2,5 mg si se dan 2 de los siguientes factores de riesgo: edad ≥80 años, peso ≤60 kg, creatinina ≥133 umol/l). [27]. Anticoagulación oral combinada con AAS y clopidogrel [34], ya que existen pocos datos sobre los otros inhibidores de P2Y12 y se ha descrito un mayor riesgo de hemorragia en los datos de registro [35]. A la hora de determinar la duración de la triple terapia, debe sopesarse de nuevo el riesgo de hemorragia (puntuación HAS-BLED [hipertensión, función renal/hepática anormal, antecedentes de ictus, antecedentes de hemorragia, ajuste INR inestable, edad superior a 65 años, abuso de alcohol/medicamentos como los AINE; alto riesgo de hemorragia con ≥3 puntos) [36] frente al riesgo de trombosis. Si el riesgo de hemorragia es elevado, la terapia triple debe limitarse a un mes, seguido de una terapia dual (AAS o clopidogrel + anticoagulación oral en dosis normales) durante un total de un año [34,37]. Si el riesgo de trombosis es elevado, se recomienda prolongar la terapia triple hasta 6 meses [38], tras lo cual debe seguirse la terapia dual con AAS o clopidogrel durante otros 6 meses. Después de un año, la monoterapia con anticoagulación oral puede continuarse en la mayoría de los casos [39].
El uso de los diferentes inhibidores de la agregación plaquetaria según las recomendaciones actuales de la Sociedad Europea de Cardiología se resumen en las figuras 2 y 3 .
Literatura:
- 1 Gruntzig A: Dilatación transluminal de la estenosis de la arteria coronaria. Lancet, 1978. 1(8058): 263.
- 2 Sigwart U, et al: Stents intravasculares para prevenir la oclusión y la reestenosis tras la angioplastia transluminal. N Engl J Med, 1987. 316(12): 701-706.
- Fischman DL, et al: Comparación aleatorizada de la colocación de un stent coronario y la angioplastia con balón en el tratamiento de la enfermedad arterial coronaria. Investigadores del estudio sobre la reestenosis del stent. N Engl J Med, 1994. 331(8): 496-501.
- Serruys PW, et al: Comparación de la implantación de endoprótesis expandibles con balón con la angioplastia con balón en pacientes con enfermedad arterial coronaria. Benestent Study GrouN Engl J Med, 1994. 331(8): 489-495.
- Cohen DJ, et al: In-hospital and one-year economic outcomes after coronary stenting or balloon angioplasty. Resultados de un ensayo clínico aleatorizado. Investigadores del estudio sobre la reestenosis del stent. Circulation, 1995. 92(9): 2480-2487.
- Leon MB, et al: Un ensayo clínico que compara tres regímenes de fármacos antitrombóticos tras la colocación de un stent en la arteria coronaria. Investigadores del Estudio de Anticoagulación de la Restenosis del Stent. N Engl J Med, 1998. 339(23): 1665-1671.
- Schomig A, et al: Comparación aleatorizada del tratamiento antiplaquetario y anticoagulante tras la colocación de stents coronario-arteriales. N Engl J Med, 1996. 334(17): 1084-1089.
- Bertrand ME, et al: Estudio doble ciego de la seguridad del clopidogrel con y sin dosis de carga en combinación con aspirina en comparación con la ticlopidina en combinación con aspirina tras la colocación de un stent coronario: el estudio cooperativo internacional clopidogrel aspirina stent (CLASSICS). Circulation, 2000. 102(6): 624-629.
- Yusuf S, et al: Efectos del clopidogrel además de la aspirina en pacientes con síndromes coronarios agudos sin elevación del segmento ST. N Engl J Med, 2001. 345(7): 494-502.
- Wiviott SD, et al: Prasugrel frente a clopidogrel en pacientes con síndromes coronarios agudos. N Engl J Med, 2007. 357(20): 2001-2015.
- Montalescot G, et al: Pretratamiento con prasugrel en síndromes coronarios agudos sin elevación del segmento ST. N Engl J Med, 2013. 369(11): 999-1010.
- Wallentin L, et al: Ticagrelor frente a clopidogrel en pacientes con síndromes coronarios agudos. N Engl J Med, 2009. 361(11): 1045-57.
- Roe MT, et al: Prasugrel frente a clopidogrel para los síndromes coronarios agudos sin revascularización. N Engl J Med, 2012. 367(14): 1297-1309.
- Montalescot G, et al: Ticagrelor prehospitalario en el infarto de miocardio con elevación del segmento ST. N Engl J Med, 2014. 371(11): 1016-1027.
- Morice MC, et al: Comparación aleatorizada de un stent liberador de sirolimus con un stent estándar para la revascularización coronaria. N Engl J Med, 2002. 346(23): 1773-1780.
- Moses JW, et al: Stents liberadores de sirolimus frente a stents estándar en pacientes con estenosis en una arteria coronaria nativa. N Engl J Med, 2003. 349(14): 1315-1323.
- Stone GW, et al: Un stent polimérico liberador de paclitaxel en pacientes con enfermedad arterial coronaria. N Engl J Med, 2004. 350(3): 221-231.
- McFadden EP, et al: Trombosis tardía en stents coronarios liberadores de fármacos tras la interrupción del tratamiento antiplaquetario. Lancet, 2004. 364(9444): 1519-1521.
- Lagerqvist B, et al: Trombosis del stent en Suecia: un informe del Registro Sueco de Angiografía Coronaria y Angioplastia. Circ Cardiovasc Interv, 2009. 2(5): 401-408.
- Stone GW, et al: Stents liberadores de everolimus frente a stents liberadores de paclitaxel en la enfermedad coronaria. N Engl J Med, 2010. 362(18): 1663-1674.
- Planer D, et al: Comparison of everolimus- and paclitaxel-eluting stents in patients with acute and stable coronary syndromes: pooled results from the SPIRIT (A Clinical Evaluation of the XIENCE V Everolimus Eluting Coronary Stent System) and COMPARE (A Trial of Everolimus-Eluting Stents and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice) Trials. JACC Cardiovasc Interv, 2011. 4(10): 1104-1115.
- Jeger RV, et al: Balones recubiertos de fármacos para la enfermedad arterial coronaria pequeña (BASKET-SMALL 2): un ensayo aleatorizado abierto de no inferioridad. Lancet, 2018. 392(10150): 849-856.
- Gwon HC, et al: Tratamiento antiplaquetario dual de seis meses frente a 12 meses tras la implantación de stents liberadores de fármacos: el estudio aleatorizado y multicéntrico Efficacy of Xience/Promus Versus Cypher to Reduce Late Loss After Stenting (EXCELLENT). Circulation, 2012. 125(3): 505-513.
- Valgimigli M, et al: Duración a corto frente a largo plazo del tratamiento antiplaquetario dual tras la colocación de un stent coronario: un ensayo multicéntrico aleatorizado. Circulation, 2012. 125(16): 2015-2026.
- Costa F, et al: Impact of clinical presentation on ischaemic and bleeding outcomes in patients receiving 6- or 24-month duration of dual-antiplatelet therapy after stent implantation: a pre-specified analysis from the PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia) trial. Eur Heart J, 2015. 36(20): 1242-1251.
- Bittl JA, et al: Duration of Dual Antiplatelet Therapy: A Systematic Review for the 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol, 2016. 68(10): 1116-1139.
- Valgimigli M, et al: [2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS.]. Cardiol Pol, 2017. 75(12): 1217-1299.
- Costa F, et al: Derivación y validación de la puntuación de predicción de complicaciones hemorrágicas en pacientes sometidos a implantación de stent y posterior tratamiento antiplaquetario dual (PRECISE-DAPT): un análisis agrupado de conjuntos de datos de pacientes individuales procedentes de ensayos clínicos. Lancet, 2017. 389(10073): 1025-1034.
- Kim BK, et al: A new strategy for discontinuation of dual antiplatelet therapy: the RESET Trial (REal Safety and Efficacy of 3-month dual antiplatelet Therapy followin Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol, 2012. 60(15): 1340-1348.
- Feres F, et al: Tres frente a doce meses de terapia antiplaquetaria dual tras stents liberadores de zotarolimus: el ensayo aleatorizado OPTIMIZE. JAMA, 2013. 310(23): 2510-2522.
- Urban P, et al: Stents coronarios recubiertos de fármaco sin polímero en pacientes con alto riesgo de hemorragia. N Engl J Med, 2015. 373(21): 2038-47.
- Valgimigli M, et al: Stents liberadores de zotarolimus frente a stents metálicos sin recubrimiento en candidatos inciertos a stents liberadores de fármacos. J Am Coll Cardiol, 2015. 65(8): 805-815.
- Bonaca MP, Braunwald E, Sabatine MS: Uso a largo plazo del ticagrelor en pacientes con infarto de miocardio previo. N Engl J Med, 2015. 373(13): 1274-1275.
- Dewilde WJ, et al: Uso de clopidogrel con o sin aspirina en pacientes que reciben tratamiento anticoagulante oral y se someten a una intervención coronaria percutánea: un ensayo abierto, aleatorizado y controlado. Lancet, 2013. 381(9872): 1107-1115.
- Sarafoff N, et al: Terapia triple con aspirina, prasugrel y antagonistas de la vitamina K en pacientes con implantación de un stent liberador de fármacos y una indicación de anticoagulación oral. J Am Coll Cardiol, 2013. 61(20): 2060-2066.
- Roldan V, et al: La puntuación HAS-BLED tiene mejor precisión de predicción de hemorragia grave que las puntuaciones CHADS2 o CHA2DS2-VASc en pacientes anticoagulados con fibrilación auricular. J Am Coll Cardiol, 2013. 62(23): 2199-2204.
- Gibson, C.M, et al: Prevención de hemorragias en pacientes con fibrilación auricular sometidos a ICP. N Engl J Med, 2016. 375(25): 2423-2434.
- Fiedler KA, et al: Duration of Triple Therapy in Patients Requiring Oral Anticoagulation After Drug-Eluting Stent Implantation: The ISAR-TRIPLE Trial. J Am Coll Cardiol, 2015. 65(16): 1619-1629.
- Lamberts M, et al: Tratamiento antiplaquetario para la enfermedad coronaria estable en pacientes con fibrilación auricular que toman un anticoagulante oral: un estudio de cohortes a escala nacional. Circulation, 2014. 129(15): 1577-1585.
- Valgimigli M, et al: 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Revista Europea del Corazón, 2018; 39: 213-254.
CARDIOVASC 2019; 18(4): 16-18