La trombosis venosa profunda se desarrolla en 1/1000 personas al año en Europa Occidental. En la fase aguda, es crucial prevenir la complicación de la embolia arterial pulmonar. Hoy en día, esto se hace eficazmente en el momento del diagnóstico con anticoagulación. Sin embargo, varios miles de personas mueren cada año de esta tromboembolia pulmonar porque no se realizó el diagnóstico.
La trombosis venosa profunda se desarrolla en 1/1000 habitantes de Europa Occidental al año [1]. En la fase aguda, es crucial prevenir la complicación de la embolia arterial pulmonar. Hoy en día, esto se hace eficazmente en el momento del diagnóstico con anticoagulación. Sin embargo, unas 25.000 personas mueren cada año en Alemania a causa de esta tromboembolia pulmonar, entre otras cosas porque los pacientes fallecen repentinamente con una embolia arterial pulmonar aguda o porque el diagnóstico se realiza demasiado tarde.
Por muy eficaz que sea la anticoagulación para prevenir la tromboembolia, es ineficaz para prevenir el síndrome postrombótico (SPT). En la evolución a largo plazo, los pacientes con trombosis venosa profunda desarrollan un síndrome postrombótico en un 20-83%, dependiendo de la localización y extensión de la trombosis [2,3]. Las venas ilíacas están implicadas en la trombosis iliofemoral en cerca del 40% de los casos y, a pesar de la anticoagulación, la recanalización no tiene éxito en el 70% de los casos [4,5]. Esto conduce entonces a una obstrucción crónica del drenaje y, como resultado, al STP.
El PTS resume las dolencias debidas a venas profundas dañadas y/o bloqueadas por trombosis venosa profunda. Generalmente incluyen sensación de pesadez, parestesia, picor, calambres, dolor y edema periférico en las piernas. También aparecen induraciones cutáneas, hiperpigmentación, enrojecimiento, ectasia venosa, úlceras en las piernas y dolor por compresión en las pantorrillas. En particular, la claudicación venosa es uno de los principales síntomas que, al igual que la claudicación intermitente, conlleva una limitación de la distancia recorrida. La ulceración como fase final de la sintomatología ocasiona elevados costes para el sistema sanitario debido a consecuencias socioeconómicas como la reducción de la movilidad y la necesidad de cuidados [6,7].
Trombosis venosa profunda
Diagnóstico: En los casos de sospecha de trombosis venosa profunda, el procedimiento de diagnóstico está claramente definido en las directrices. Cualquier sospecha de trombosis venosa profunda debe aclararse inmediatamente para iniciar una terapia anticoagulante si es necesario. Ésta es la única forma de reducir el riesgo de embolia arterial pulmonar y detener la progresión de la TVP [8]. La evaluación incluye primero un historial médico y un examen físico. Debido a su escasa sensibilidad, por sí sola no basta para diagnosticar o excluir la trombosis. Por lo tanto, en función de la probabilidad clínica (CL), siguen los diagnósticos de laboratorio, especialmente la determinación de los dímeros D, y/o la ecografía de compresión. Existen puntuaciones validadas para determinar el KW de la presencia de TVP, como la puntuación de Wells, de uso frecuente [8].
Mediante la puntuación, se consultan factores como la enfermedad tumoral o la diferencia de perímetro de la pierna y se les asigna una puntuación de 0 ó 1. El resultado es un KW alto o bajo para la presencia de TVP. Esto debe documentarse como un paso diagnóstico independiente. Si el KW es bajo, suele seguir la prueba del dímero D. Si el resultado es negativo, es muy probable que se haya descartado la TVP y no sea necesario realizar más pruebas diagnósticas [8]. Si la probabilidad clínica es alta, se realiza una ecografía de compresión. Si esto no es concluyente, deben realizarse más pruebas de imagen o repetir la ecografía al cabo de 3-5 días. Se recomienda examinar toda la pierna afectada, incluidas las venas pélvicas, mediante ecografía de compresión. Si no se dispone de diagnóstico por imagen a tiempo, la anticoagulación está indicada en casos de alta probabilidad clínica tras sopesar el riesgo de hemorragia [8].
Terapia: El tratamiento de la TVP incluye anticoagulación, terapia de compresión y movilización rápida. También se recomienda interrumpir o modificar el posible factor de riesgo desencadenante, como los anticonceptivos, y tratar una enfermedad subyacente recién diagnosticada, como una enfermedad tumoral. La anticoagulación se ha ampliado en los últimos años con los nuevos anticoagulantes orales (NOAK), lo que sin duda ha facilitado su manejo por parte de los pacientes. Sin embargo, las NOAK interactúan cada vez más con otros fármacos como los antibióticos y los antiarrítmicos. Esto debe comprobarse en el momento de la preparación y durante los controles de progreso.
Después de una terapia de mantenimiento durante 3-6 meses, se debe hablar de una terapia de mantenimiento prolongada. La Sociedad Alemana de Angiología dispone de un esquema de semáforo adecuado para ayudar a decidir si se debe continuar con la terapia (Tab. 1). Cabe mencionar que los dos estudios con rivaroxaban y apixaban para terapia de mantenimiento prolongada con dosis más bajas aún no han recibido atención aquí, y éstos también sólo están aprobados para 1 año. [9,10]. Durante el curso se puede realizar un esclarecimiento de la trombofilia en pacientes seleccionados, pero sólo en raras ocasiones tiene consecuencias terapéuticas. Ejemplos de una consecuencia terapéutica son el síndrome antifosfolípido, la deficiencia de antitrombina III o la deficiencia significativa de inhibidores.

Debe realizarse un control clínico del paciente con TVP en los primeros 21 días, uno ecográfico a los 3 meses o tras finalizar la anticoagulación.
En cuanto a la terapia de compresión, a pesar de todos los puntos débiles del protocolo de estudio, el ensayo Sox no mostró ninguna ventaja de la terapia de compresión en la prevención del síndrome postrombótico (SPT) [13]. Sin embargo, la compresión es indispensable para aliviar los síntomas; la terapia de compresión debe llevarse a cabo especialmente en las primeras semanas.
La TVP de origen poco claro tiene la tasa de recurrencia más alta, de hasta el 9% en el primer año. La discusión sobre si los pacientes con TVP tienen un mayor riesgo de enfermedad tumoral aún no se ha decidido de forma concluyente [14,15]. Si se realiza el cribado, un cribado adecuado a la edad más la historia clínica y el laboratorio parece ser suficiente [16]. En los pacientes más jóvenes, puede ser útil un estudio de vasculitis.
Los pacientes con tumores tienen un riesgo diferente de TVP en función de la entidad y la localización del tumor. Los pacientes con un tumor pancreático presentan el mayor riesgo de TVP. La aparición de TVP en pacientes tumorales se asocia a un resultado significativamente peor [17]. Los pacientes con tumores tienen una mayor probabilidad clínica desde el principio y los dímeros D están regularmente elevados per se. Por lo tanto, el esclarecimiento de una posible TVP en pacientes tumorales se recomienda principalmente con la ayuda de la ecografía dúplex en color y, si es necesario, de otras pruebas de imagen [18]. Los pacientes con tumores deben ser tratados con una heparina de bajo peso molecular durante 3-6 meses, ya que es superior a la heparina no fraccionada [19,20] y Marcumar [21–23]. La dosis y la duración deben decidirse en consulta con los colegas oncólogos tratantes. Debido al elevadísimo riesgo de recidiva, de hasta un 20%, se recomienda la anticoagulación a largo plazo en función del riesgo de hemorragia, al menos mientras esté presente la enfermedad tumoral, aunque los datos al respecto son limitados.
En comparación con la heparina de bajo peso molecular, se han realizado varios estudios con las NOAK en pacientes tumorales. El edoxabán comparado con la dalteparina mostró una menor tasa de recidivas (7,9% frente a 11,3%), pero a costa de una mayor tasa de hemorragias (6,9% frente a 4,0%) a los 12 meses [24]. El aumento de la tasa de hemorragias se produjo principalmente en el tracto gastrointestinal en pacientes con tumores gastrointestinales. El estudio piloto Select-D investigó el rivaroxaban en comparación con la dalteparina durante un periodo de 6 meses. Una vez más, hubo una ventaja para el rivaroxabán en la tasa de trombosis recurrente (4% frente a 11%), mientras que la tasa de hemorragias graves aumentó (6% frente a 4%) [25]. En este estudio, el aumento de la tasa de hemorragias gastrointestinales también fue notable. Tras la actualización de las directrices en este sentido, los datos sobre el apixaban seguían pendientes. Un ensayo aleatorio internacional pudo demostrar la no inferioridad del apixabán frente a la dalteparina en cuanto a la tasa de recurrencia (5,6% frente a 7,9%). Sin embargo, el apixabán, a diferencia del edoxabán y el rivaroxabán, no aumentó las complicaciones hemorrágicas (3,8% frente a 4,0%) [26] en una población de pacientes comparable.
En resumen, los NOAK parecen ser una alternativa para los pacientes con tumores, pero sigue siendo necesaria una gran precaución para los pacientes con tumores gastrointestinales o urogenitales. Según estos datos, los NOAK podrían utilizarse a partir del diagnóstico de la TVP, pero esto depende de la entidad tumoral, el estadio tumoral y el tratamiento tumoral actual.
La trombosis de la parte inferior de la pierna (trombosis venosa profunda distal), al igual que la trombosis venosa muscular, se anticoagula durante un máximo de 3 meses debido a su evolución pronósticamente favorable, incluso en caso de recidiva o de génesis idiopática [27,28]. Sin embargo, no hay pruebas claras de la necesidad de la anticoagulación, y la dosis está actualmente en discusión.
|
Puntuación izquierda
|
Una de las causas más comunes de muerte durante el embarazo y el puerperio es la TVP, con un riesgo cuatro veces mayor [29]. La TVP se produce en la pierna izquierda en el 70-90% de los casos en mujeres embarazadas [30,31]. La trombosis de las venas pélvicas también se diagnostica con mayor frecuencia durante el embarazo. Por lo tanto, la puntuación LEFt con un alto valor predictivo negativo se utiliza para el diagnóstico, pero requiere una evaluación adicional en una población de pacientes más amplia (recuadro) . Los dímeros D están elevados en el embarazo, pero los resultados de Morse et al. y Chan et al. esto puede adaptarse a la edad gestacional [32,33]. Sin embargo, estudios recientes indican una escasa viabilidad clínica del uso de los dímeros D por sí solos para excluir la TVP, fuera de los pacientes de alto riesgo [34]. Más bien, las reglas de predictibilidad clínica parecen útiles en combinación con la prueba del dímero D para ahorrar radiación cuando se sospecha una embolia pulmonar.

En este sentido, no debe dejar de mencionarse el algoritmo YEARS adaptado al embarazo propuesto en las directrices actuales de la ESC para la embolia pulmonar [35,36]. En última instancia, sin embargo, la ecografía de compresión debe utilizarse regularmente para excluir la TVP en el embarazo, si es necesario también en posición lateral. Si no se puede llegar a una conclusión sobre la TVP en este caso, se recomienda la obtención de imágenes mediante flebografía por RM [37], evitando el gadolinio y utilizando secuencias realzadas sin contraste [8]. Si la ecografía de compresión es negativa, se recomienda un control 7 días después [8].
Si se detecta una TVP, se recomienda la anticoagulación con heparinas, preferiblemente heparina de bajo peso molecular, y debe llevarse a cabo durante 3 meses a una dosis terapéutica. A partir de entonces, puede reducirse la dosis a intermedia (2× profiláctica) o profiláctica [8]. Sin embargo, la anticoagulación debe continuar durante al menos 6 semanas después del parto [38]. Los NOAK están contraindicados durante el embarazo debido a su toxicidad placentaria, pero también durante el periodo de lactancia debido a la falta de datos sobre su seguridad [39].
En pacientes con síntomas pronunciados debidos a una trombosis aguda de la vena pélvica descendente, debe plantearse un abordaje endovascular con bajo riesgo de hemorragia. La trombosis descendente suele tener su origen en una estenosis/oclusión en la vena cava inferior y/o en la vena ilíaca, lo que da lugar a un rápido crecimiento descendente del trombo, que provoca una sintomatología intensa y rápida en el paciente afectado. Los pacientes con este tipo de trombosis se benefician de un procedimiento intervencionista según un análisis de subgrupos del ensayo Attract [11]. Al tratarse en su mayoría de pacientes jóvenes, la exposición a la radiación debe minimizarse o evitarse con la ayuda de una terapia endovascular guiada por ecografía (Fig. 1). Bajo guía ecográfica, pueden realizarse la trombectomía, la terapia de lisis local, la ATP y la implantación de endoprótesis, como se muestra parcialmente en el siguiente informe de caso [12].
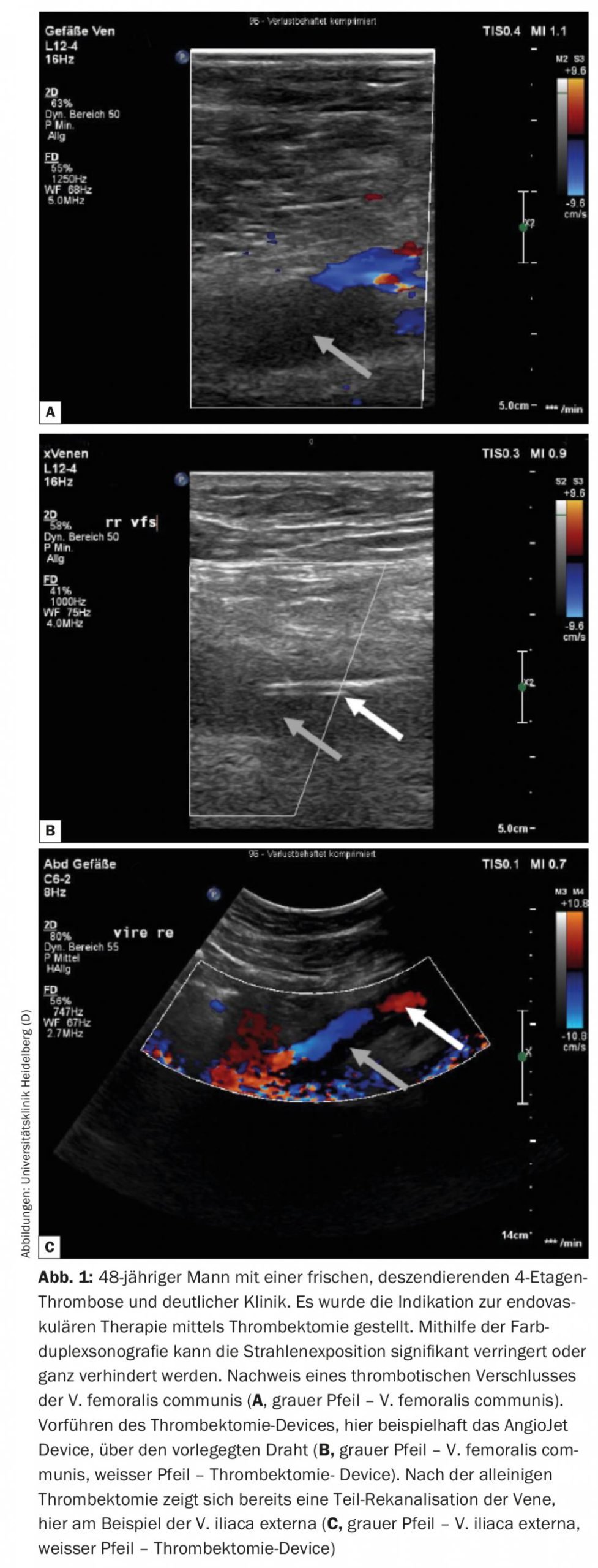
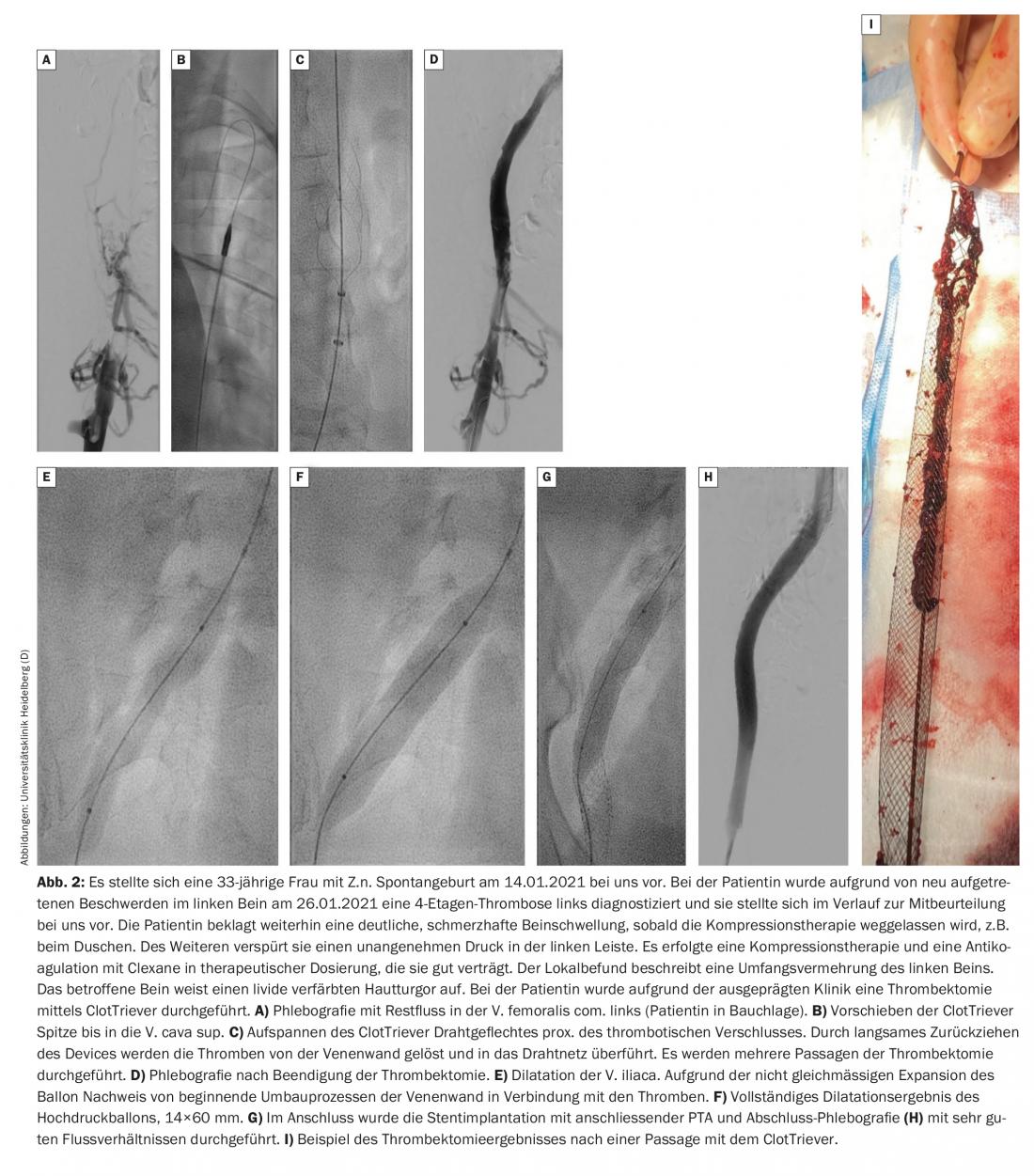
Según el protocolo de Heidelberg, los pacientes reciben primero un tratamiento conservador durante unos días. Si no se produce una mejora significativa de los síntomas o de la extensión del trombo durante este periodo, deberá discutirse con el paciente la posibilidad de realizar un procedimiento endovascular y llevarlo a cabo si es necesario. La trombectomía debe realizarse en los 14 días siguientes al inicio de los síntomas, si es posible. Al parecer, un nuevo dispositivo, el llamado ClotTriever, también permite tratar eficazmente la trombosis venosa pélvica subaguda. Actualmente se está llevando a cabo un registro y está por ver cuáles serán los primeros resultados (Fig. 2).
Terapia para el síndrome postrombótico (SPT)
Indicación y aclaración diagnóstica antes de una intervención endovascular: La indicación de una intervención endovascular depende de los síntomas del paciente. A partir del estadio 3 del CEAP, está indicado reabrir las venas ocluidas según las recomendaciones americanas. Las siguientes venas pueden tratarse con intervenciones endovasculares: la vena femoral común, la vena ilíaca, la vena cava inferior y superior y, en parte, la vena subclavia. Antes de la intervención, primero se realiza un diagnóstico con un examen clínico, una prueba de marcha, una ecografía dúplex en color y, si es necesario, más pruebas de imagen como una flebotomía por RM o TC. La extensión de la oclusión venosa, así como el flujo de entrada y salida, son esenciales en este caso, ya que la tasa de apertura a largo plazo depende de estos factores.
Terapia: La terapia básica para el síndrome de estrés postraumático consiste en terapia de compresión, medidas físicas y ejercicio. El movimiento es esencial para el desarrollo de circuitos de derivación y, por tanto, para la mejora de los síntomas. Además, el tratamiento óptimo de las heridas es elemental en el caso de una úlcera de pierna.
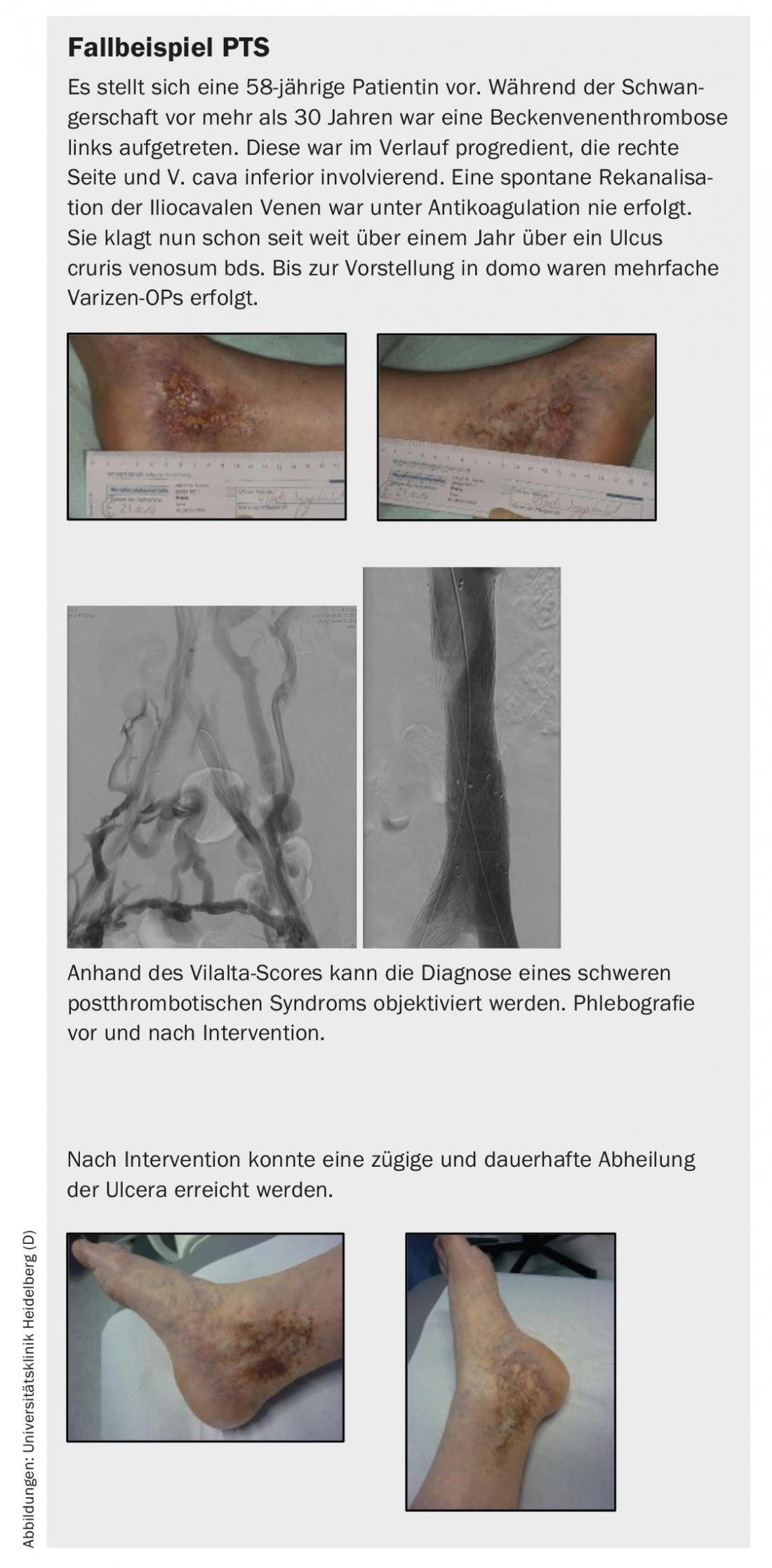
El tratamiento invasivo de la trombosis venosa proximal o de la oclusión venosa crónica se introdujo internacionalmente hace ya 30 años; en nuestro país, las intervenciones endovasculares se realizan con éxito en los principales centros desde hace varios años con altas tasas de apertura y conducen a una mejora significativa de los síntomas del paciente y a la curación de las úlceras venosas.
Si la clínica lo permite, se puede comentar con el paciente una posible intervención venosa y discutir tanto las ventajas como los inconvenientes o riesgos. No importa la antigüedad de la obstrucción en cuanto a las posibilidades de éxito del procedimiento. La tasa de apertura primaria después de 5 años es de casi el 70%. En este metaanálisis también se observó una mejora significativa de los síntomas; hasta el 82% de los pacientes tratados estaban libres de dolor al cabo de 5 años. Además, el procedimiento condujo a la curación a largo plazo de una úlcera de pierna hasta en un 80% [1].
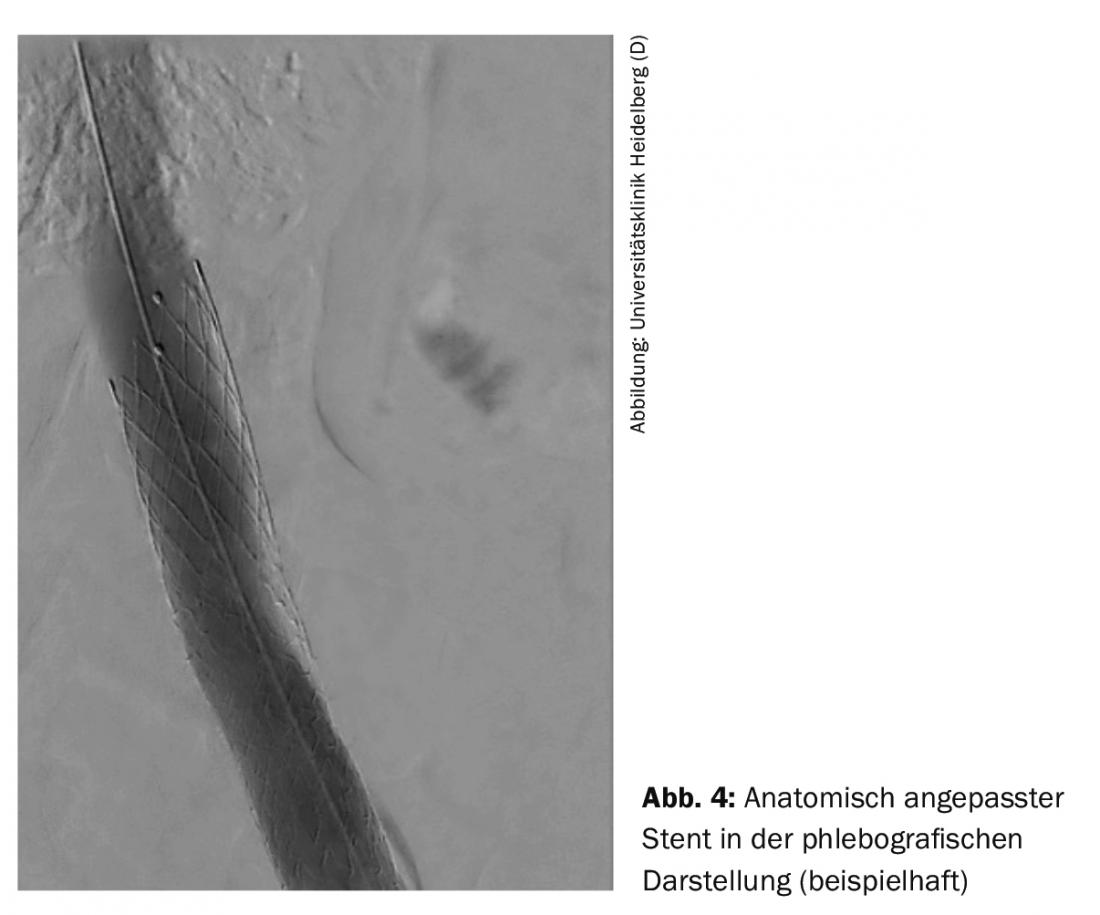
El procedimiento endovascular suele realizarse a través de la vena poplítea. Otras vías de acceso son la vena femoral y la vena yugular. Dependiendo del caso, el procedimiento puede realizarse bajo anestesia de analgosedación o de intubación. Tras la flebografía, se realiza un pasaje de alambre a través de la oclusión. Posteriormente, debido a la rigidez de las oclusiones venosas, se utilizan balones especiales de alta presión con diámetros de 14-16 mm en la vena ilíaca y de 20-24 mm en la vena cava inferior para una dilatación adecuada. utilizado. Tras la dilatación, la pared de la vena no es una construcción estable y se colapsa rápidamente, por lo que se utilizan endoprótesis diseñadas específicamente para las venas con el fin de garantizar una tasa de apertura a largo plazo. Para lograr una colocación óptima de la endoprótesis en una intervención unilateral en la zona de la vena ilíaca proximal, existen endoprótesis adaptadas anatómicamente (fig. 4).
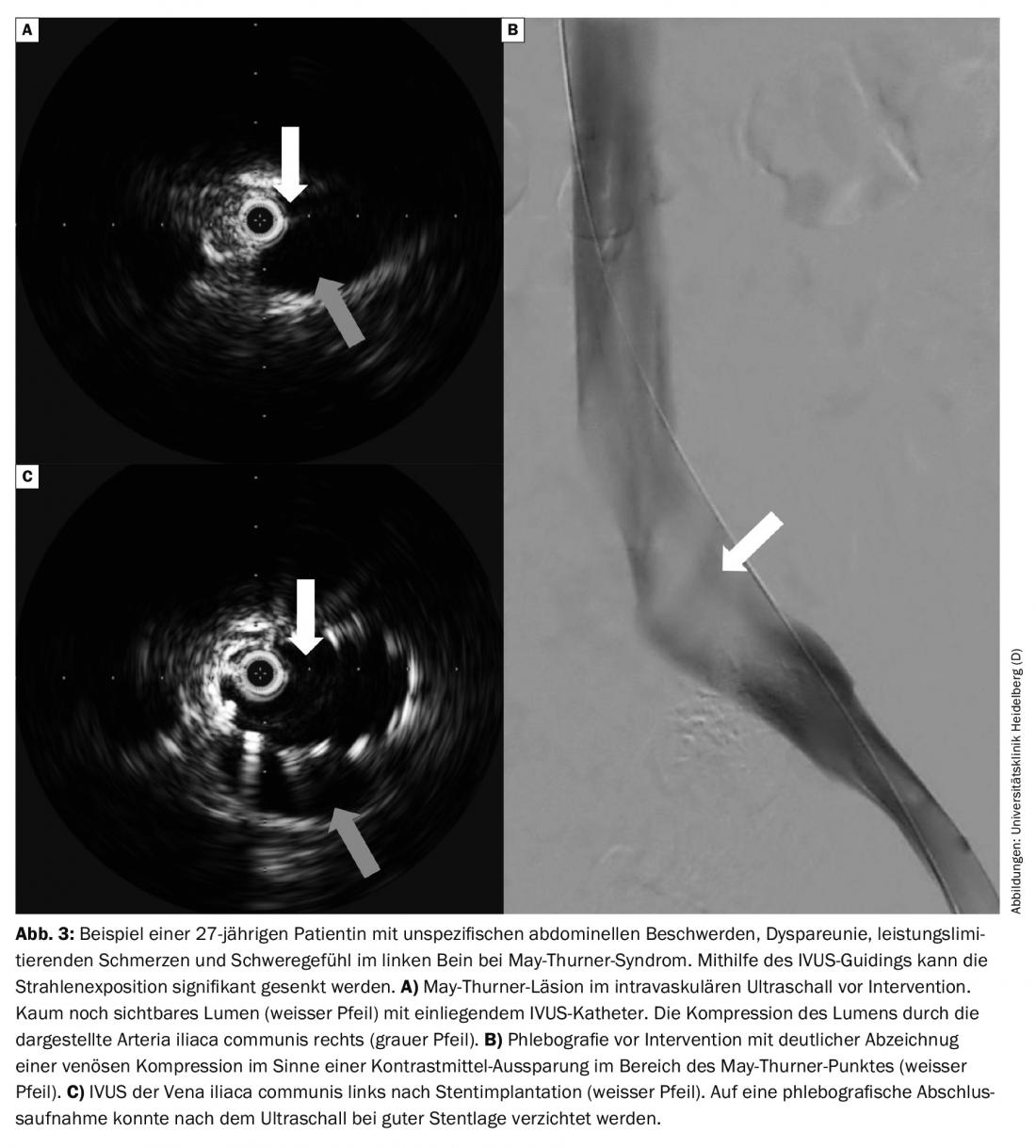
Otros colectivos de pacientes: Las etiologías complementarias son la compresión de la vena por las arterias, las denominadas estenosis venosas no trombóticas (EVNT) o las lesiones que ocupan espacio, como los tumores. La NIVL suele implicar la compresión de la vena ilíaca com. izquierda a través de la A. iliaca com. derecha, la llamada estenosis de May-Thurner. Si se añaden las quejas, entonces se habla de un síndrome May-Thurner. Estas compresiones NIVL pueden realizarse hoy en día de forma eficaz con una tasa de apertura muy elevada, de alrededor del 90% al cabo de 5 años, con un tiempo de intervención corto y un producto de baja dosis por superficie [1].
Las limitaciones de la ecografía dúplex en color, la TC y la flebografía por RM en la detección de la obstrucción dinámica ilíaca pueden suplirse ahora con el uso de la ecografía intravascular (EIV) en casos de sospecha de trombosis de las venas pélvicas con síntomas típicos sin correlato diagnóstico. (Fig. 3A). De este modo, se pueden ahorrar dosis de rayos X o incluso prescindir de ellas en el diagnóstico de este grupo de pacientes, a menudo más jóvenes. Si la intervención es necesaria, la EIV puede ser una ayuda para elegir el tamaño y la longitud del stent.
El tratamiento invasivo de la compresión venosa por un tumor puede suponer un alivio rápido de los síntomas no sólo en el contexto paliativo. Tras la colocación de la endoprótesis y la dilatación posterior, la endoprótesis alcanza su forma óptima para mantener abierta la vena correspondiente con fuerzas hacia el exterior.
Seguimiento: Se recomiendan visitas de seguimiento al cabo de 1,3 y 12 meses. Esos días se realiza un seguimiento clínico y ecográfico dúplex en color. Una nueva flebografía o ATC no es necesaria de forma rutinaria.
El tratamiento antitrombótico posintervencionista depende de la etiología del riesgo individual de trombosis y hemorragia. Se realiza de forma individual. En la mayoría de los casos, es necesaria una anticoagulación terapéutica completa durante 6-12 meses. Posteriormente, el procedimiento posterior se discute y se lleva a cabo individualmente con el paciente. Además, la inhibición plaquetaria puede ser aconsejable durante los primeros 6 meses. Las NIVL requieren un régimen menos estricto tras la intervención que las oclusiones crónicas complejas. Se recomienda una anticoagulación completa durante 3-6 meses. A continuación, se interrumpe la anticoagulación.
En resumen, la terapia endovascular de las oclusiones venosas es una forma muy buena de ayudar eficazmente a largo plazo a los pacientes con síntomas más pronunciados.
Mensajes para llevarse a casa
- La terapia NOAK puede administrarse a pacientes con tumores.
- Sin embargo, esto depende de la entidad tumoral (no en los tumores GI y urogenitales), del estadio del tumor y de su terapia.
- La anticoagulación basada en pautas minimiza la tasa de tromboembolismo, pero no la probabilidad de síndrome postrombótico (SPT).
- En la trombosis venosa pélvica aguda, claramente sintomática, debe plantearse un procedimiento intervencionista si los síntomas y la extensión del trombo no mejoran con la terapia conservadora.
- En el síndrome postrombótico, la reapertura endovascular de las venas ocluidas puede mejorar significativamente la calidad de vida de los pacientes sintomáticos. Además, se trata de una terapia eficaz para la curación a largo plazo de las úlceras venosas.
- En las estenosis venosas no trombóticas (por ejemplo, la estenosis de May-Thurner), la tasa de apertura tras la intervención es de aproximadamente el 90% al cabo de 5 años.
Literatura:
- Razavi MK, Jaff MR, Miller LE: Seguridad y eficacia de la colocación de endoprótesis para la obstrucción del flujo venoso iliofemoral: revisión sistemática y metaanálisis. Circ Cardiovasc Interv 2015; 8: e002772.
- Kahn SR, Shrier I, Julian JA, et al: Determinantes y evolución temporal del síndrome postrombótico tras una trombosis venosa profunda aguda. Ann Intern Med 2008; 149: 698-707.
- Prandoni P, Lensing AW, Cogo A, et al: La evolución clínica a largo plazo de la trombosis venosa profunda aguda. Ann Intern Med 1996; 125: 1-7.
- Johnson BF, Manzo RA, Bergelin RO, Strandness DE, Jr: Relación entre los cambios en el sistema venoso profundo y el desarrollo del síndrome postrombótico tras un episodio agudo de trombosis venosa profunda de las extremidades inferiores: un seguimiento de uno a seis años. J Vasc Surg 1995; 21: 307-312; discusión 13.
- Akesson H, Brudin L, Dahlstrom JA, et al: Función venosa evaluada durante un periodo de 5 años tras una trombosis venosa aguda ilio-femoral tratada con anticoagulación. Eur J Vasc Surg 1990; 4: 43-48.
- Ashrani AA, Heit JA: Incidencia y carga económica del síndrome postrombótico. J Thromb Thrombolysis 2009; 28: 465-476.
- Guanella R, Ducruet T, Johri M, et al: Carga económica y factores determinantes del coste de la trombosis venosa profunda durante los 2 años siguientes al diagnóstico: una evaluación prospectiva. J Thromb Haemost 2011; 9: 2397-2405.
- Directriz S2: Diagnóstico y tratamiento de la trombosis venosa y la embolia pulmonar. www.awmf.org/leitlinien/detail/ll/065-002.html. Situación actual: 10 de octubre de 2015.
- Agnelli G, Buller HR, Cohen A, et al: Apixaban para el tratamiento prolongado de la tromboembolia venosa. N Engl J Med 2013; 368: 699-708.
- Weitz JI, Lensing AWA, Prins MH, et al: Rivaroxaban o aspirina para el tratamiento prolongado de la tromboembolia venosa. N Engl J Med 2017; 376: 1211-1222.
- Comerota AJ, Kearon C, Gu CS, et al: Extracción endovascular de trombos para la trombosis venosa profunda iliofemoral aguda. Circulation 2019; 139: 1162-1173.
- Heckmann MB, Wangler S, Katus HA, Erbel C: Tratamiento endovascular asistido por ecografía de las trombosis venosas agudas. Vasa 2019; 48: 443-449.
- Kahn SR, Shapiro S, Wells PS, et al: Medias de compresión para prevenir el síndrome postrombótico: un ensayo aleatorizado controlado con placebo. Lancet 2014; 383: 880-888.
- Carrier M, Lazo-Langner A, Shivakumar S, et al: Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med 2015; 373: 697-704.
- Robin P, Le Roux PY, Planquette B, et al: Cribado limitado con o sin (18)F-fluorodeoxiglucosa PET/TC para detectar malignidad oculta en el tromboembolismo venoso no provocado: un ensayo controlado aleatorio abierto. Lancet Oncol 2016; 17: 193-199.
- Khan F, Vaillancourt C, Carrier M.: ¿Debemos realizar un cribado exhaustivo del cáncer tras una trombosis venosa no provocada? BMJ 2017; 356: j1081.
- Levitan N, Dowlati A, Remick SC, et al: Tasas de enfermedad tromboembólica inicial y recurrente entre pacientes con neoplasia maligna frente a aquellos sin neoplasia maligna. Análisis de riesgos utilizando datos de reclamaciones de Medicare. Medicina (Baltimore) 1999; 78: 285-291.
- Gary T: Tromboembolismo venoso relacionado con el cáncer: profilaxis y terapia. Vasa 2014; 43: 245-251.
- Akl EA, Rohilla S, Barba M, et al: Anticoagulación para el tratamiento inicial del tromboembolismo venoso en pacientes con cáncer: una revisión sistemática. Cáncer 2008; 113: 1685-1694.
- Akl EA, Kahale L, Neumann I, et al: Anticoagulación para el tratamiento inicial del tromboembolismo venoso en pacientes con cáncer. Cochrane Database Syst Rev 2014: CD006649.
- Akl EA, Kahale L, Barba M, et al: Anticoagulación para el tratamiento a largo plazo del tromboembolismo venoso en pacientes con cáncer. Cochrane Database Syst Rev 2014: CD006650.
- Hull RD, Pineo GF, Brant RF, et al: Heparina de bajo peso molecular a largo plazo frente a atención habitual en pacientes con trombosis venosa proximal y cáncer. Am J Med 2006; 119: 1062-1072.
- Lee AYY, Kamphuisen PW, Meyer G, et al: Tinzaparina frente a warfarina para el tratamiento del tromboembolismo venoso agudo en pacientes con cáncer activo: un ensayo clínico aleatorizado. JAMA 2015; 314: 677-686.
- Raskob GE, van Es N, Verhamme P, et al: Edoxaban para el tratamiento del tromboembolismo venoso asociado al cáncer. N Engl J Med 2018; 378: 615-624.
- Young AM, Marshall A, Thirlwall J, et al: Comparación de un inhibidor oral del factor Xa con la heparina de bajo peso molecular en pacientes con cáncer y tromboembolismo venoso: Resultados de un ensayo aleatorizado (SELECT-D). J Clin Oncol 2018; 36: 2017-2023.
- Agnelli G, Becattini C, Meyer G, et al: Apixaban para el tratamiento del tromboembolismo venoso asociado al cáncer. N Engl J Med 2020; 382: 1599-1607.
- Galanaud JP, Sevestre MA, Genty C, et al: Incidencia y factores predictivos de la recurrencia del tromboembolismo venoso tras una primera trombosis venosa profunda distal aislada. J Thromb Haemost 2014; 12: 436-443.
- Baglin T, Douketis J, Tosetto A, et al: ¿La presentación clínica y la extensión de la trombosis venosa predicen la probabilidad y el tipo de recurrencia? Un metaanálisis a nivel de pacientes. J Thromb Haemost 2010; 8: 2436-2442.
- Marik PE, Plante LA: Enfermedad tromboembólica venosa y embarazo. N Engl J Med 2008; 359: 2025-2033.
- Chan WS, Spencer FA, Ginsberg JS: Distribución anatómica de la trombosis venosa profunda en el embarazo. CMAJ 2010; 182: 657-660.
- Ginsberg JS, Brill-Edwards P, Burrows RF, et al: Trombosis venosa durante el embarazo: pierna y trimestre de presentación. Thromb Haemost 1992; 67: 519-520.
- Morse M: Establecimiento de un intervalo normal para los niveles de dímero D durante el embarazo como ayuda en el diagnóstico de la embolia pulmonar y la trombosis venosa profunda. J Thromb Haemost 2004; 2: 1202-1204.
- Chan WS, Lee A, Spencer FA, et al: Prueba del dímero D en pacientes embarazadas: hacia la determinación del siguiente “nivel” en el diagnóstico de la trombosis venosa profunda. J Thromb Haemost 2010; 8: 1004-1011.
- Goodacre S, Horspool K, Nelson-Piercy C, et al: The DiPEP study: an observational study of the diagnostic accuracy of clinical assessment, D-dimer and chest x-ray for suspected pulmonary embolism in pregnancy and postpartum. BJOG 2019; 126: 383-392.
- Konstantinides SV, Meyer G, Becattini C, et al: 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020; 41: 543-603.
- van der Pol LM, Tromeur C, Bistervels IM, et al: Algoritmo YEARS adaptado al embarazo para el diagnóstico de la sospecha de embolia pulmonar. N Engl J Med 2019; 380: 1139-1149.
- Tan M, Mol GC, van Rooden CJ, et al: La imagen directa del trombo por resonancia magnética diferencia la trombosis venosa profunda ipsilateral recurrente aguda de la trombosis residual. Sangre 2014; 124: 623-627.
- Chan WS, Rey E, Kent NE, et al: Tromboembolia venosa y tratamiento antitrombótico en el embarazo. J Obstet Gynaecol Can 2014; 36: 527-553.
- Cohen H, Arachchillage DR, Middeldorp S, et al: Manejo de los anticoagulantes orales directos en mujeres en edad fértil: guía del CSE de la ISTH. J Thromb Haemost 2016; 14: 1673-1676.
- Bauersachs, et al.: Dtsch Med Wochenschr 2018; 143: 1-6 (13).
CARDIOVASC 2022; 21(1): 12-19