Un documento de revisión resumió los resultados de cuatro estudios aleatorizados doble ciego controlados con placebo o con referencias de un preparado combinado de Sabal-Urtica en hombres mayores de 50 años con SVUI asociados a la HBP. El fitopreparado demostró ser una alternativa válida a los fármacos sintéticos. El perfil favorable de efectos secundarios es un punto a favor, especialmente para la terapia a largo plazo.
En aproximadamente la mitad de los hombres mayores de 50 años se producen cambios tisulares benignos en la próstata en forma de aumento del tejido conjuntivo, músculo y/o células epiteliales (hiperplasia prostática benigna, HPB). Debido a la hiperplasia del órgano, la compresión de la uretra puede provocar un aumento de la resistencia a la salida de la vejiga: obstrucción prostática benigna (OPB). La HBP es la principal causa de los síntomas del tracto urinario inferior (STUI), que incluyen la retención de la vejiga, el vaciado y los síntomas miccionales [1]. En particular, los antagonistas del receptor adrenérgico α1, los inhibidores de la 5α-reductasa y las fitoterapias se utilizan como terapia de primera línea para los síntomas del STUI asociados a la HBP [2].
Existe un interés creciente por las opciones de tratamiento fitoterapéutico, entre otras cosas porque algunos pacientes no están satisfechos con los efectos adversos de los fármacos sintéticos [3]. La terapia con antagonistas de los receptores adrenérgicos α1 e inhibidores de la 5α-reductasa, por ejemplo, puede asociarse a efectos secundarios sexuales como disfunción eréctil y trastornos de la eyaculación [4]. Además, en general se informa de un riesgo relativamente alto de efectos secundarios relacionados con el sistema vascular para la mayoría de los antagonistas de los α-adrenoceptores [5]. Los efectos secundarios cardiovasculares, como la hipotensión, acompañada de mareos o síncope, afectan principalmente a los hombres mayores, es decir, al principal grupo de pacientes con SVUI/HBP que requieren tratamiento farmacológico [6–8].
El fármaco PRO 160/120 (Prostaplant®-F) es una prometedora alternativa fitoterapéutica para el tratamiento del STUI. El preparado combinado contiene 160 mg de extracto del fruto de la serenoa (Serenoa repens o Sabal serrulata) y 120 mg de extracto seco de raíz de ortiga (Urtica dioica) como principales principios activos farmacológicos (caja ) [9].
| Mecanismos de acción de PRO 160/120 El preparado fitofarmacológico combinado de extractos de sabal (extracto de serenoa) y úrtica (raíz de ortiga) muestra efectos sinérgicos. Entre otras cosas, se induce una conversión de la testosterona en dihidrotestosterona y la actividad de la aromatasa [18]. La relajación del tejido prostático inflamado provoca una reducción de la presión sobre la uretra. Gracias a su efecto antiinflamatorio, PRO 160/120 reduce la irritación de la próstata [19]. Se ha demostrado que el extracto de serenoa inhibe la 5α-reductasa sin mostrar actividad de unión a andrógenos [20,21] y provoca una inhibición no competitiva de los α1-adrenoceptores humanos in vitro [22]. También inhibe selectivamente los receptores muscarínicos del tracto urinario inferior [23,24]. El extracto de raíz de ortiga inhibe la actividad Na+, K+-ATPasa de la membrana prostática, lo que puede limitar el metabolismo y el crecimiento de las células prostáticas [25]. Además, se han descrito efectos antiproliferativos, antiflogísticos y antiedematosos para ambos agentes [27,28]. |
Puntuación internacional de los síntomas prostáticos (I-PSS)
En los estudios incluidos en la revisión, la mejoría de los síntomas se evaluó mediante la Puntuación Internacional de los Síntomas Prostáticos (I-PSS) [10–13]. Se trata de una herramienta de medición fiable y válida utilizada habitualmente para evaluar los STUI asociados a la HBP, con siete preguntas sobre la micción, cada una de ellas puntuada de 0 a 5 [2,14]. Las preguntas suelen referirse al mes anterior. En cada uno de los cuatro estudios [10–13], se consiguió una mejora de más de tres puntos en la puntuación total de la I-PSS, lo que se clasifica como un cambio clínicamente significativo [16]. Se recogieron los siguientes parámetros como criterios de valoración adicionales: Volumen de tiempo de orina o volumen de tiempo de orina, tiempo de flujo de orina, flujo medio de orina, flujo máximo de orina, volumen de micción, duración de la micción (tiempo de vaciado de la vejiga), volumen de orina residual, volumen prostático, calidad de vida. Además, se registraron los acontecimientos adversos y las señales de seguridad de los diagnósticos de laboratorio.
Resultados importantes del estudio de un vistazo
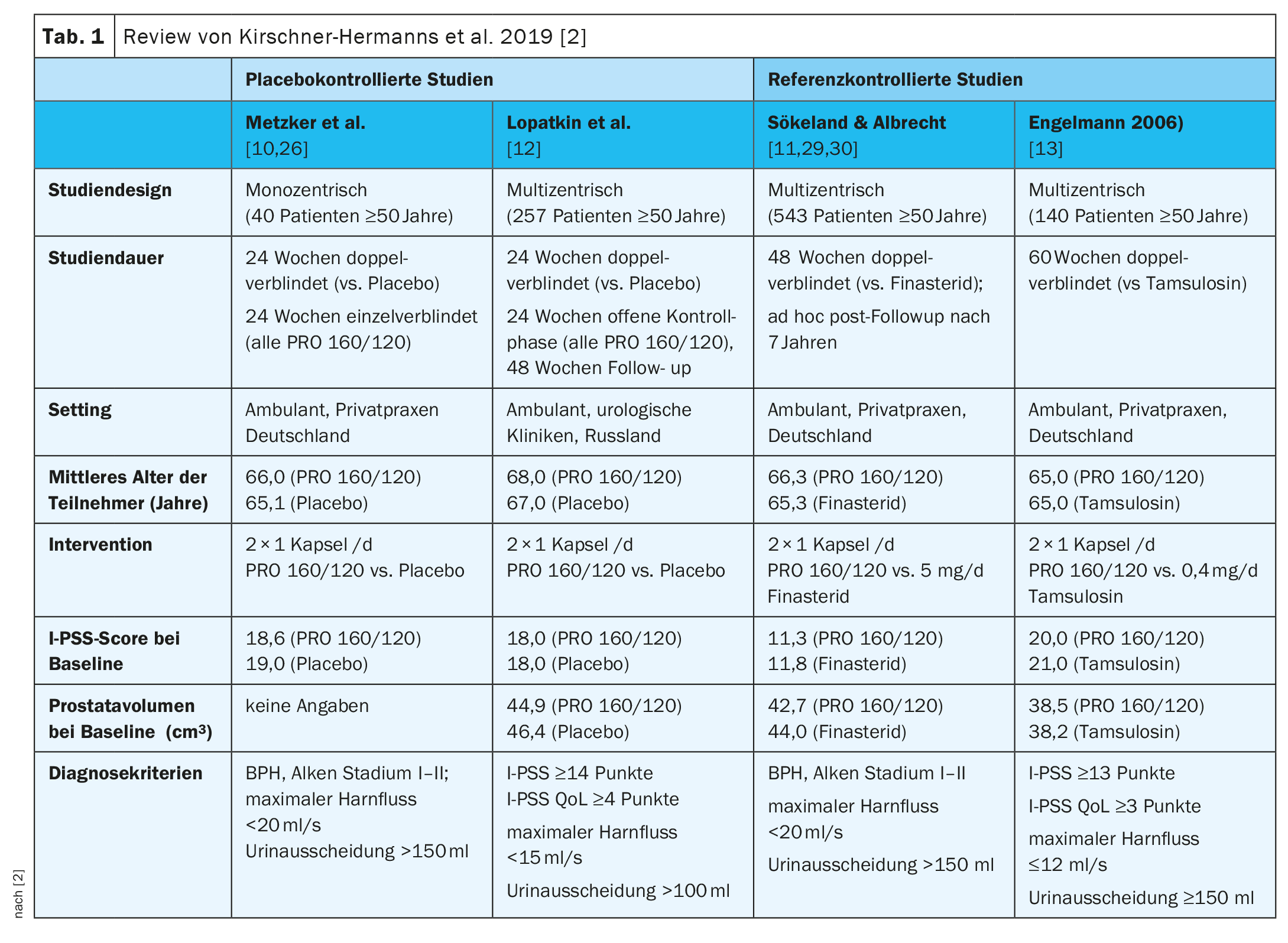
Los datos clave de los cuatro estudios pueden verse en la tabla 1 [2,10–13]. En Metzker et al. y Lopatkin et al. fueron controlados con placebo y en Engelmann et al. y Sökeland & Albrecht para los estudios controlados de referencia [2,10–13].
Metzker et al (n=40) [10]: En la fase de tratamiento doble ciego, la I-PSS media disminuyó desde unos valores basales de 18,6 puntos en el grupo PRO 160/120 y 19,0 puntos en el grupo placebo hasta 11,1 y 17,6 puntos en la semana 24, respectivamente (p=0,002; prueba U de dos caras). En una evaluación post hoc de estos resultados, que se centró en los ítems de la I-PSS que evaluaban los denominados síntomas irritativos, se demostró que había una mejora estadísticamente significativa en la urgencia urinaria y la frecuencia miccional según el PRO 160/120 durante esta fase de tratamiento [26]. En la fase posterior de tratamiento simple ciego, la I-PSS también disminuyó en los pacientes que habían pasado del placebo al tratamiento con PRO 160/120. Sin embargo, en la semana 48, seguía existiendo una ventaja a favor del grupo que estaba en el brazo de tratamiento activo (PRO 160/120) en ambas fases del estudio (p=0,009; prueba U de dos caras).
Lopatkin et al. (n=257) [12]: Tras la fase de tratamiento doble ciego, se observó una diferencia de grupo estadísticamente significativa en el descenso de la I-PSS a favor del PRO 160/120; -6 puntos en el brazo de tratamiento y -4 puntos en el brazo de placebo (p<0,01, prueba U unilateral estratificada). Al final de la fase de control, la I-PSS se redujo en otros 2 puntos en los antiguos pacientes tratados con placebo (que ahora también eran tratados con PRO 160/120) y en 1 punto más en los pacientes que habían sido tratados con PRO 160/120 desde el inicio del estudio. Esta diferencia entre los dos grupos de tratamiento también fue estadísticamente significativa (p=0,01, prueba U estratificada unilateral). Al final de la fase de control, la reducción de la I-PSS media en ambos grupos de tratamiento fue de siete puntos en comparación con el valor inicial, lo que indica que los antiguos pacientes tratados con placebo se beneficiaron del tratamiento con PRO 160/120 en la misma medida que los pacientes que ya habían sido tratados con PRO 160/120 desde el inicio del tratamiento doble ciego [15]. Tras la fase de control, 213 pacientes (PRO 160/120: 106; placebo: 107) participaron en la posterior extensión abierta del estudio (semanas 49-96) [17]. En los pacientes en los que no faltaban las puntuaciones basales de la I-PSS (PRO 160/120: 106; placebo: 103), se observó una reducción mediana adicional de la puntuación de 1 punto en cada grupo, lo que dio lugar a una reducción mediana global de 9 puntos en ambos grupos en comparación con el valor basal. Esto corresponde a una reducción del 52,9% en la puntuación total de la I-PSS en comparación con el valor inicial.
Sökeland & Albrecht (n=543) [11]Al final del estudio, los síntomas de los pacientes tratados con PRO 160/120 habían mejorado en una medida similar en comparación con los pacientes tratados con finasterida, con un aumento de la I-PSS de 11,3 ± 6,5 puntos (PRO 160/120) y 11,8 ± 6,6 puntos (finasterida) al inicio del estudio a 8,2 ± 5,8 puntos (PRO 160/120) y 8,0 ± 5,7 puntos (finasterida) en la semana 24. 11,8 ± 6,6 puntos (finasterida) al inicio del estudio a 8,2 ± 5,8 puntos (PRO 160/120) y 8,0 ± 5,7 puntos (finasterida) en la semana 24 y 6,5 ± 5,8 puntos (PRO 160/120) y 6,2 ± 5,2 puntos (finasterida) en la semana 48 (medias ± DE). La mejora de la calidad de vida según la puntuación C de la AUA también fue similar en comparación con la finasterida. El aumento del flujo urinario máximo con PRO 160/120 (+1,9 ml/s) y finasterida (+2,4 ml/s) resultó ser terapéuticamente comparable dentro de un margen de equivalencia de ±1,5 ml/s (p=0,037; prueba t modificada para hipótesis cambiadas).
Engelmann et al. (n=140) [13]: La puntuación total de la IPSS había mejorado una media de 9 puntos al final del tratamiento en ambos grupos a partir de una puntuación inicial de unos 20 puntos. Un 32,4% de los pacientes tratados con PRO 160/120 y un 27,9% de los tratados con tamsulosina fueron respondedores (es decir, puntuación total de IPSS ≤7 al final del tratamiento; p=0,034, prueba de no inferioridad de Farrington-Manning; umbral de no inferioridad 10%). En un análisis de subgrupos según la puntuación I-PSS basal, el PRO 160/120 y la tamsulosina fueron comparativamente eficaces tanto en pacientes con síntomas moderados (puntuación I-PSS basal ≤19 puntos) como en pacientes con síntomas graves (puntuación I-PSS basal ≥20 puntos). La calidad de vida de las pacientes mejoró en una mediana de 2 puntos en el grupo PRO 160/120 y en 1 punto en el grupo de tamsulosina (valores iniciales: 3 puntos y 4 puntos, respectivamente; medianas).
Literatura:
- S2e-Leitlinie Diagnostik und Therapie des Benignen Prostatasyndroms (BPS), Registernummer: 043-034, Langversion 5.0 – Stand Februar 2023.
- Kirschner-Hermanns R, Funk P, Leistner N: WS PRO 160 I 120 mg (una combinación de extracto de sabal y urtica) en pacientes con STUI relacionados con la HBP. Ther Adv Urol 2019 Oct 11;11:1756287219879533.
- Geavlete P, Multescu R, Geavlete B: Extracto de Serenoa repens en el tratamiento de la hiperplasia benigna de próstata. Ther Adv Urol 2011; 3: 193-198.
- Mirone V, et al: Tratamiento actual de la hiperplasia benigna de próstata: impacto en la función sexual y gestión de los acontecimientos adversos sexuales relacionados. Int J Clin Pract 2011; 65: 1005-1013.
- Nickel JC, Sander S, Moon TD: Un metaanálisis del perfil de seguridad vascular y la eficacia de los bloqueantes alfaadrenérgicos para los síntomas relacionados con la hiperplasia benigna de próstata. Int J Clin Pract 2008; 62: 1547-1559.
- Logan IC, Witham MD: Eficacia de los tratamientos para la hipotensión ortostática: una revisión sistemática. Envejecimiento 2012; 41: 587-594.
- Man in’t Veld AJ: HBP sintomática e hipertensión: ¿afecta la comorbilidad a la calidad de vida? Eur Urol 1998; 34(Suppl. 2): 29-36.
- Schimke L, Schimke J: Implicaciones urológicas de las caídas en los ancianos: síntomas del tracto urinario inferior y medicamentos alfabloqueantes. Urol Nurs 2014; 34: 223-229.
- Información sobre medicamentos, www.swissmedicinfo.ch,(último acceso 15.09.2023)
- Metzker H, Kieser M, Hölscher U: Eficacia de un preparado combinado de Sabal-Urtica en el tratamiento de la hiperplasia benigna de próstata (HBP). Urólogo B 1996; 36: 292-300.
- Sökeland J, Albrecht J: Combinación de extracto de sabal y urtica frente a finasterida en la HBP (stad. I a II según Alken). Comparación de la eficacia terapéutica en un estudio doble ciego de un año. Urólogo A 1997; 36: 327-333.
- Lopatkin N, et al: Eficacia y seguridad a largo plazo de una combinación de extracto de sabal y urtica para los síntomas del tracto urinario inferior – un ensayo multicéntrico, doble ciego, controlado con placebo. World J Urol 2005; 23: 139-146.
- Engelmann U, et al.: Eficacia y seguridad de una combinación de extracto de sabal y urtica en los síntomas del tracto urinario inferior. Un estudio aleatorizado a doble ciego frente a la tamsulosina. Arzneimittelforschung 2006; 56: 222-229.
- McConnell J, et al. (Eds): Disfunción del tracto urinario inferior masculino. Evaluación y gestión. En: Actas de la6ª Consulta Internacional sobre Nuevos Avances en Cáncer de Próstata y Enfermedades Prostáticas, París, Francia, 24-27 de junio de 2005. Health Publications, 2006.
- Sivkov A, et al: Eficacia y seguridad a largo plazo de una combinación de extractos de sabal y urtica en los STUI: un ensayo multicéntrico, doble ciego y controlado con placebo. Urologist A 2001; 40(Suppl. 1): S19.
- Barry MJ, et al: Medidas específicas del estado de salud de la hiperplasia benigna de próstata en la investigación clínica: ¿cuánto cambio en el índice de síntomas de la Asociación Americana de Urología y en el índice de impacto de la hiperplasia benigna de próstata es perceptible para los pacientes? J Urol 1995; 154: 1770-1774.
- Lopatkin et al: Eficacia y seguridad de una combinación de extracto de sabal y urtica en los síntomas del tracto urinario inferior – seguimiento a largo plazo de un ensayo multicéntrico, doble ciego y controlado con placebo. Int Urol Nephrol 2007; 39: 1137-1146.
- Madersbacher S, et al.: Asociación entre las prescripciones de PRO 160/120 y la incidencia de complicaciones de la hiperplasia prostática benigna en Alemania: un estudio de cohortes retrospectivo. Postgrad Med 2023; 135(2): 149-154.
- Koch E: Extractos de frutos de serenoa (Sabal serrulata) y raíces de ortiga (Urtica dioica): alternativas viables en el tratamiento médico de la hiperplasia benigna de próstata y los síntomas asociados de las vías urinarias bajas. Planta Med 2001; 67(6): 489-500.
- Casarosa C, et al.: Ausencia de efectos de un extracto liposterólico de Serenoa repens sobre los niveles plasmáticos de testos-terona, hormona folículo-estimulante y hormona luteinizante. Clin Ther 1988; 10: 585-588.
- Düker EM, Kopanski L, Schweikert HU: Inhibición de la actividad de la 5α-reductasa por extractos de Sabal serrulata. Planta Med 1989; 55: 587.
- Goepel M, et al.: Los extractos de serenoa inhiben de forma potente y no competitiva los 1-adrenoceptores humanos in vitro. Próstata 1999; 38: 208-215.
- 23 Abe M, et al: Pharmacologically relevant receptor binding characteristics and 5α-reductase inhibitory activ-ity of free fatty acids contained in saw palmetto extract. Biol Pharm Bull 2009; 32: 646-650.
- Suzuki M, et al.: Muscarinic and alpha 1-adrenergic receptor binding characteristics of saw palmetto ex-tract in rat lower urinary tract. Urología 2007; 69: 1216-1220.
- Hirano T, Homma M, Oka K: Efectos de los extractos de raíz de ortiga y sus componentes esteroideos sobre la Na+, K+-ATPasa de la hiperplasia prostática benigna. Planta Med 1994; 60: 30-33.
- Popa G, Hägele-Kaddour H, Walther C: Eficacia sintomática de un preparado combinado de Sabal-Urtica en la terapia del síndrome prostático benigno. Resultados de un estudio doble ciego controlado con placebo. MMW Fortschr Med 2005; 147(Originalien III): 103-108.
- Koch E, Biber A: Efectos farmacológicos de los extractos de sabal y urtica como base para un tratamiento farmacológico racional de la hiperplasia benigna de próstata. Urólogo B 1994; 34: 90-95.
- Lichius JJ, et al.: Efecto antiproliferativo de una fracción polisacárida de un extracto metanólico al 20% de raíces de ortiga sobre células epiteliales de la próstata humana (LNCaP). Pharmacy 1999; 54: 768-771.
- Sökeland J: Extracto combinado de sabal y urtica comparado con finasterida en hombres con hiperplasia benigna de próstata: análisis del volumen prostático y resultado terapéutico. BJU Int 2000; 86: 439-442.
- Sökeland J, Schläfke S: Efectos a largo plazo de PRO 160/120 en pacientes con HBP. Uro-News Therapie Report aktuell 2007; 164: 2-3.