La identificación e investigación de biomarcadores moleculares puede ayudar a descomponer el complejo fenotipo de la dermatitis atópica en subfenotipos. Un objetivo a largo plazo de esta investigación traslacional es la estratificación y selección de pacientes en función de biomarcadores diagnósticos, pronósticos y predictivos como base para una estrategia terapéutica individual óptima.
Numerosas publicaciones recientes abordan el tema de los enfoques de investigación traslacional en el contexto de la dermatitis atópica (DA). Incluido un artículo de revisión publicado en Cellular & Molecular Immunology 2023 por Facheris et al. y una revisión de Balato et al. publicada en Life 2022 [1,2]. A continuación se resumen algunas de las principales conclusiones abordadas en [1,2].
Investigación traslacional para enfoques terapéuticos personalizados
Los recientes avances en la comprensión de la patogénesis de la EA han revolucionado la investigación traslacional y han conducido a una expansión exponencial de la cartera terapéutica [1]. Además de los biológicos ya aprobados (Dupilumab, Tralokinumab) y los inhibidores de JAK (Baricitinib, Upadacitinib, Abrocitinib), actualmente se están desarrollando otros numerosos principios activos innovadores, como biológicos y “pequeñas moléculas”, para el área de indicación de la dermatitis atópica. Entre ellos se encuentran el lebrikizumab (anti-IL13), el nemolizumab (anti-31-R), el tezepelumab (anti-TSLP), el anti-Ox-40-Ak, así como el brepocitinib (inhibidor tópico de TYK2/JAK1) y los moduladores de los receptores de hidrocarburos de arilo [1,2]. Partiendo de la base de que las manifestaciones sintomáticas heterogéneas y la evolución de la enfermedad reflejan diferencias fundamentales a nivel molecular, en el futuro debería ser posible identificar subgrupos de pacientes con diferentes subtipos de la enfermedad y diferentes respuestas a determinadas terapias.
| Proyectos de investigación traslacional En el proyecto “BIOMAP “* (Biomarcadores en Dermatitis Atópica y Psoriasis) [14], se investigan las causas y los mecanismos de la DA y la psoriasis con el objetivo de identificar biomarcadores responsables de la variación en el curso de la enfermedad. El proyecto “CHAMP“$ (CHildhood Allergy and tolerance: bioMarkers and Predictors) [15] se centra en la investigación de los factores determinantes de diversas enfermedades alérgicas (alergia alimentaria, dermatitis atópica, asma, fiebre del heno) desde el nacimiento hasta la adolescencia. Se presta especial atención a los factores que determinan la tolerancia primaria (=no aparición de enfermedades) y la tolerancia adquirida (=remisión de enfermedades existentes). El proyecto de estudio identificará biomarcadores clínicamente relevantes que puedan utilizarse para predecir la aparición temprana, la progresión y la remisión. |
* Duración: 01.04.2019-31.03.2024 $ Duración: 2017-2022 |
EA: fisiopatología multifactorial con predisposición genética
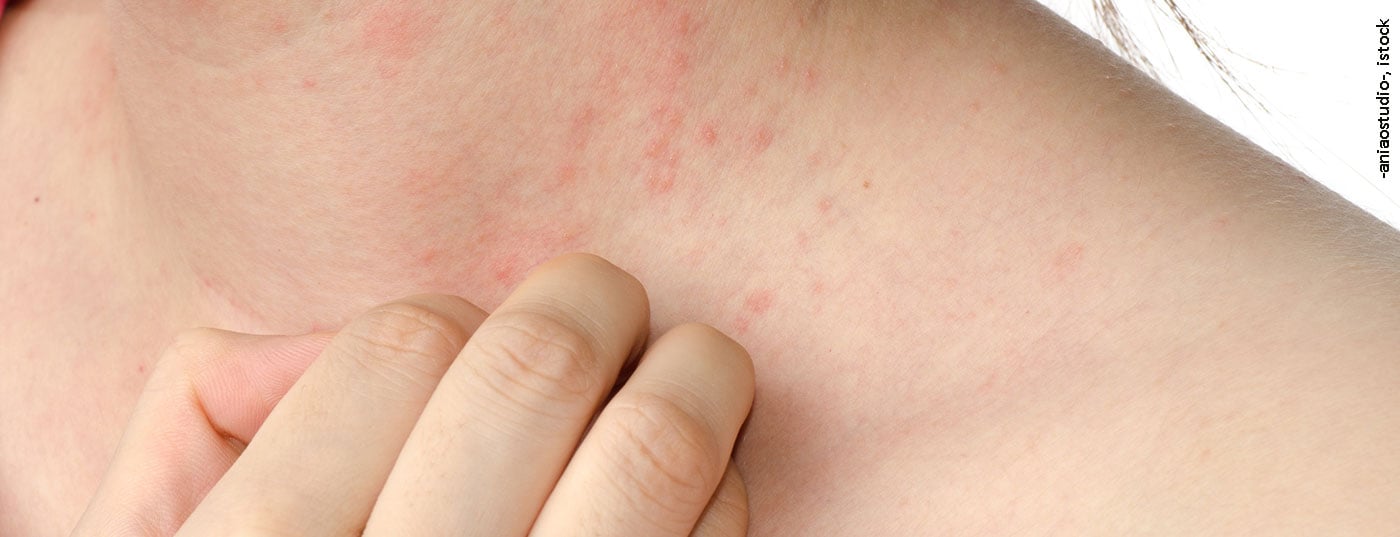
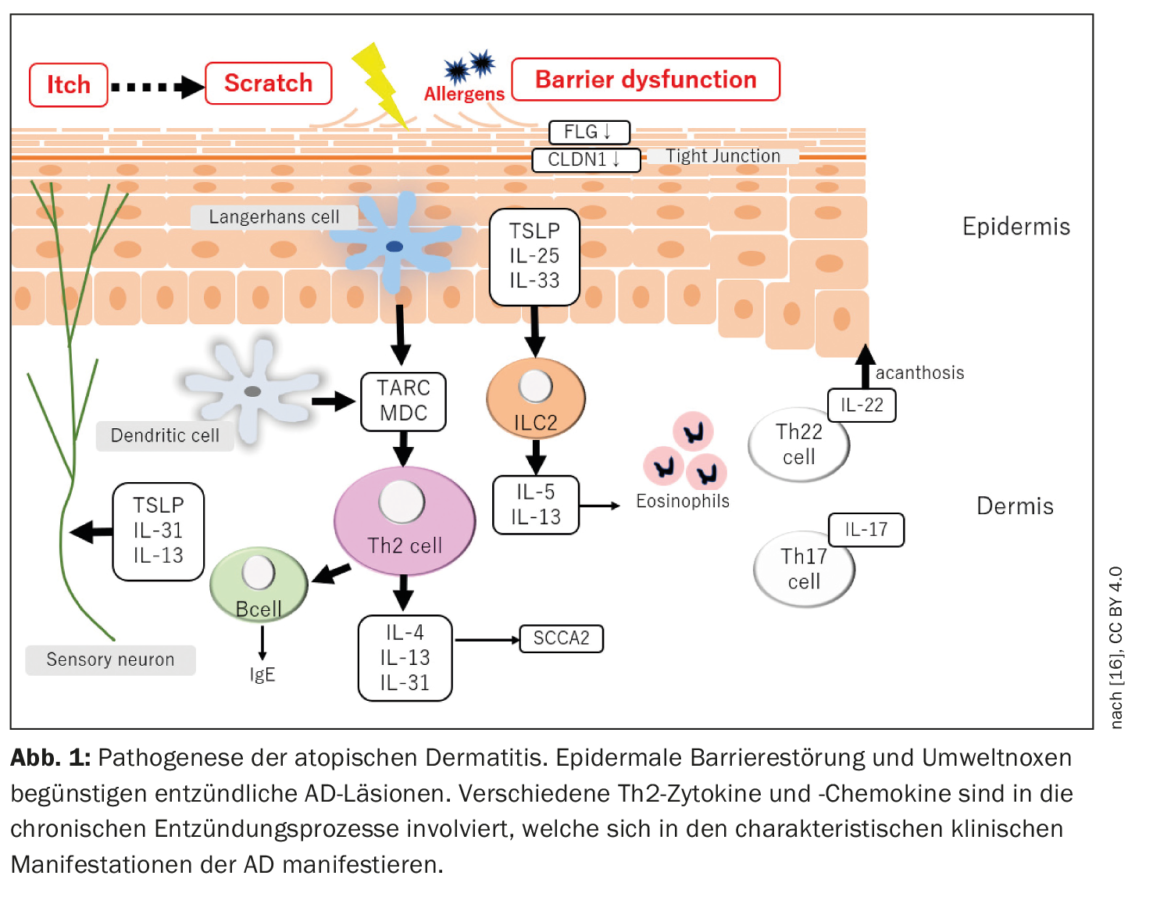
La dermatitis atópica se caracteriza por un curso crónico recurrente con aparición en la primera infancia. Los brotes agudos se acompañan de lesiones cutáneas inflamatorias y picor intenso, por lo que la calidad de vida de los pacientes se ve considerablemente mermada [3]. La fisiopatología de la EA es compleja (Fig. 1) : Las interacciones entre el deterioro de la función de barrera de la piel y las respuestas inmunitarias modificadas contribuyen al desarrollo y mantenimiento de la enfermedad [2].
Se sabe que una predisposición genética es un requisito previo para el desarrollo de la EA. El factor de riesgo genético más conocido es una mutación en el gen FLG, que provoca una reducción de la expresión de filagrina en la piel y un trastorno asociado de la barrera epidérmica [4]. Además del FLG, se han identificado más de 30 loci genéticos asociados a la EA [5,6]. Además, las variantes en el gen IL-13 o en la región del receptor IL-6, así como varias variantes raras codificantes de proteínas, explican casi el 30% de la susceptibilidad genética a la EA [7]. La EA se considera una enfermedad mediada por Th2, lo que se ve respaldado por los hallazgos de niveles aumentados de mediadores Th2 y niveles disminuidos de IFN-γ en la sangre de pacientes con EA grave [1,8]. Varios estudios han confirmado que las lesiones de EA están mediadas principalmente, aunque no de forma exclusiva, por Th2 y asociadas a la sobreproducción de importantes citocinas y quimiocinas Th2. Sin embargo, el Th22 también parece estar implicado, como refleja una sobreproducción de IL-22, mientras que la implicación de los ejes Th1 y Th17 varía aparentemente en función del endofenotipo de la EA [1].
La identificación de biomarcadores clínicamente relevantes sigue siendo un reto
Los proyectos de investigación de biomarcadores clínicamente relevantes utilizan los últimos avances técnicos en medicina traslacional con el objetivo a largo plazo de mejorar las opciones de tratamiento y la “gestión de la enfermedad”.
Un criterio para los biomarcadores moleculares es que se detecten y midan en la sangre, en otros fluidos corporales o en los tejidos y que puedan utilizarse como indicadores de procesos relevantes para la enfermedad en el organismo [9].
En la actualidad, se conocen al menos 18 biomarcadores sanguíneos o séricos asociados a la actividad de la enfermedad de Alzheimer, como los niveles de granulocitos eosinófilos, la deshidrogenasa láctica, la IgE total o los niveles del receptor soluble de IL-2 [10]. Además, varias quimiocinas# (CCL17, CCL18, CCL22, CCL26, CCL27) e interleucinas (IL-13, IL-22, IL-24, IL-25, IL-31, IL-33), así como la “Thymic Stromal Lymphopoietint” (TSLP), la periostina y el antígeno-2 del carcinoma de células escamosas se consideran biomarcadores en la EA [10]. CCL18, TSLP y CCL26 se asociaron con el asma comórbida en un estudio danés en niños que padecían EA [11]. Los investigadores estudiaron cuatro grupos de niños de 6 a 12 años: (1) EA pasada o presente sin asma, (2) EA pasada o presente y asma actual, (3) asma actual sin EA. (4) controles sanos. Se realizó un ensayo clínico exploratorio para investigar qué biomarcadores se asocian a la respuesta al tratamiento de la inhibición del receptor-α de la IL-4 mediante el anticuerpo monoclonal dupilumab en la EA moderada a grave. Se demostró que el dupilumab reduce el aumento de la expresión de firmas Th2 como IL-13, IL-31, CCL17, CCL18, CCL22 y CCL26 en la sangre y la piel lesional de la EA [12,13]. Balato et al. indican que se necesitan más estudios para averiguar más sobre las posibles asociaciones de estos biomarcadores con la enfermedad y los resultados del tratamiento en la EA [2].
# Las quimiocinas son un subgrupo de las citocinas; son proteínas pequeñas (8-10 kDa), quimiotácticamente activas (proteínas de señalización).
Literatura:
- Facheris P, et al: La revolución traslacional en la dermatitis atópica: el cambio de paradigma de la patogénesis al tratamiento. Cell Mol Immunol 2023,
https://doi.org/10.1038/s41423-023-00992-4,(última consulta: 24.02.2023). - Balato A, et al: El impacto de la psoriasis y la dermatitis atópica en la calidad de vida: una investigación bibliográfica sobre biomarcadores. Life. 2022; 12(12): 2026.
- Arima K, et al: Carga de la dermatitis atópica en adultos japoneses: análisis de datos de la Encuesta Nacional de Salud y Bienestar de 2013. J Dermatol 2018; 45, 390-396.
- Irvine AD, et al: Mutaciones de la filagrina asociadas a enfermedades cutáneas y alérgicas. N Engl J Med 2011; 365: 1315-1327.
- Ellinghaus D, et al.: Un estudio de genotipado de alta densidad identifica cuatro nuevos loci de susceptibilidad para la dermatitis atópica. Nat Genet 2013; 45: 808-812.
- Løset M, et al: Genética de la dermatitis atópica: de la secuencia del ADN a la relevancia clínica. Dermatología 2019; 235: 355-364.
- Mucha S, et al.: Las variantes codificantes de proteínas contribuyen al riesgo de dermatitis atópica y a la expresión génica específica de la piel. J Allergy Clin Immunol 2020, 145, 1208-1218.
- Gittler JK, et al: La activación progresiva de citoquinas T(H)2/T(H)22 y proteínas epidérmicas selectivas caracteriza la dermatitis atópica aguda y crónica. J Allergy Clin Immunol 2012; 130: 1344-1354.
- Agencia Europea de Medicamentos (EMA). Cualificación de metodologías novedosas para el desarrollo de medicamentos. Regulación humana. Investigación y desarrollo. Opiniones y cartas de apoyo sobre la calificación de metodologías novedosas para el desarrollo de medicamentos. Disponible en línea: www.ema.europa.eu/en/glossary/biomarker,(último acceso: 24.03.2023).
- Nakahara T, et al: Exploración de biomarcadores para predecir la mejoría clínica de la dermatitis atópica en pacientes tratados con dupilumab: Un protocolo de estudio. Medicina 2020; 99: e22043.
- Basu MN, et al: Biomarcadores en el asma en el contexto de la dermatitis atópica en niños pequeños. Pediatr Allergy Immunol 2022; 33: e13823.
- Guttman-Yassky E, et al: Dupilumab mejora progresivamente las anomalías sistémicas y cutáneas en pacientes con dermatitis atópica. J Allergy Clin Immunol 2019; 143: 155-172.
- Hamilton JD, et al: Dupilumab mejora la firma molecular en la piel de pacientes con dermatitis atópica de moderada a grave. J Allergy Clin Immunol 2014; 134: 1293-1300.
- Medicina de precisión en la inflamación crónica, www.precisionmedicine.de/fileadmin/user_upload/cluster/pmi/downloads/PMI-Magazin2021_digital_Doppelseiten.pdf,(última consulta: 24.03.2023)
- BMFB: CHAMP – Alergia y tolerancia en la infancia: biomarcadores y predictores, www.gesundheitsforschung-bmbf.de/de/champ-allergie-und-toleranz-im-kindesalter-biomarker-und-pradiktoren-7268.php,(última consulta: 24.03.2023)
- Itamura M, Sawada Y: Implicación de la dermatitis atópica en el desarrollo de enfermedades inflamatorias sistémicas. Revista Internacional de Ciencias Moleculares. 2022; 23(21): 13445, www.mdpi.com/1422-0067/23/21/13445,(última consulta: 23.03.2023).
PRÁCTICA DERMATOLÓGICA 2023; 33(2): 28-29