La metaplasia intestinal, denominada epitelio de Barrette, puede desarrollarse a partir del epitelio escamoso esofágico normal debido a diversos factores. Éstas pueden convertirse en displasia de bajo o alto grado, que a su vez puede asociarse a un peligroso adenocarcinoma. El siguiente artículo analiza el curso, los factores de riesgo y las posibilidades y necesidades de vigilancia. La terapia de las displasias de “alto grado” mediante resección de la mucosa o ablación por radiofrecuencia muestra muy buenos resultados.
El esófago de Barrett se define (al menos en nuestras latitudes) como la presencia de epitelio cilíndrico en el esófago distal con metaplasia intestinal especializada adicional (presencia de células caliciformes, Fig. 1). En otros países (por ejemplo, Inglaterra, Francia o Japón), la evidencia histológica del epitelio cilíndrico por sí sola es suficiente para el diagnóstico del esófago de Barrett [1, 2].
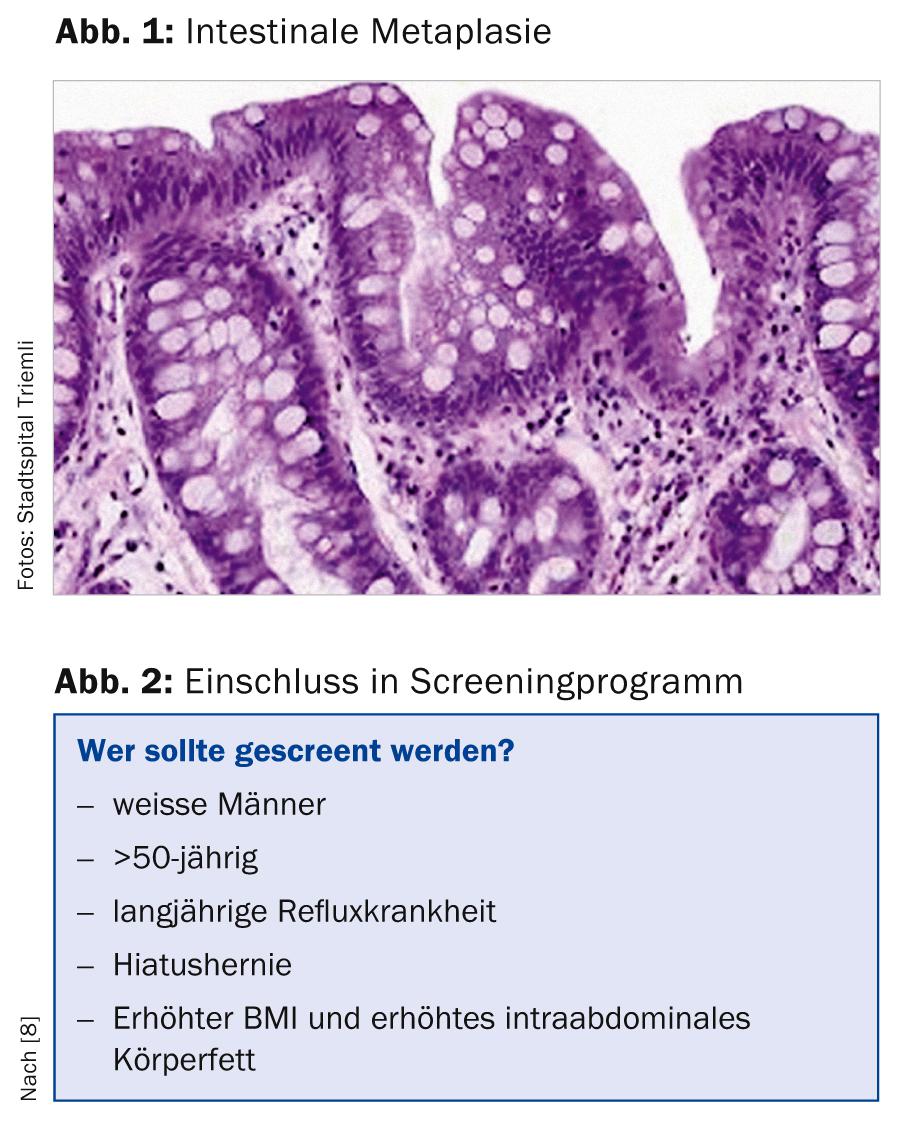
Distinguimos un esófago de Barrett de segmento largo (lengua epitelial de al menos 3 cm de longitud) de un esófago de Barrett de segmento corto (lengua de Barrett de menos de 3 cm).
Curso
La metaplasia intestinal puede desarrollarse a partir del epitelio escamoso esofágico normal debido a diversos factores y se encuentra en aproximadamente el 5-20% de todas las panendoscopias superiores. A partir de este epitelio llamado de Barrette puede desarrollarse una displasia de “bajo grado” o de “alto grado”, a partir de la cual puede desarrollarse un adenocarcinoma. A pesar de la mejora de las opciones de tratamiento (radioquimioterapia neoadyuvante), el adenocarcinoma de esófago -especialmente cuando se detecta tarde- sigue teniendo un pronóstico muy malo, con una supervivencia a 5 años ligeramente inferior al 20% [3, 4].
Factores de riesgo conocidos para el desarrollo del esófago de Barrett
Conocemos los siguientes factores de riesgo para el desarrollo de un epitelio en barretina [5, 6]:
- Edad
- Sexo masculino
- Quejas por reflujo
- Descendencia caucásica
- Fumar
- Longitud del esófago de Barrett
- Obesidad central
- Diabetes de tipo 2.
Cribado y vigilancia: General
El riesgo anual de adenocarcinoma de esófago probablemente se sobreestimó de forma significativa en los estudios más antiguos y se sitúa en un nivel bajo de entre el 0,1 y el 0,3% anual en pacientes con esófago de Barrett no displásico en estudios más recientes (y de mayor tamaño). Según un estudio de cohortes de Gran Bretaña, los pacientes con esófago de Barrett mueren en más de un 95% no de carcinoma esofágico, sino principalmente de enfermedades cardiovasculares, pulmonares o de otros tumores [7]. Por este motivo, según la Asociación Americana de Gastroenterología (AGA), los pacientes con múltiples factores de riesgo deberían someterse principalmente a un cribado (Fig. 2) [8]. El argumento a favor del cribado de estos pacientes es que el esófago de Barrett es una afección precancerosa que suele presentarse de forma asintomática. Además, como se ha descrito anteriormente, el adenocarcinoma de esófago tiene un mal pronóstico, que puede mejorarse con una terapia temprana.
El principal argumento contra el cribado es el hecho de que la progresión natural del esófago de Barrett a carcinoma es pequeña. Además, las endoscopias y las biopsias conllevan ciertos riesgos y costes (aunque pequeños).
La vigilancia, al igual que el cribado, tiene por objeto reducir la mortalidad del adenocarcinoma de esófago. La inclusión en un programa de vigilancia habla en favor de que la displasia de “alto grado” o el carcinoma precoz puedan detectarse lo antes posible y las intervenciones tempranas pueden suponer una reducción de los costes de seguimiento y de la mortalidad. Además, la vigilancia suele dar una sensación de seguridad tanto al paciente como al médico.
Un argumento en contra de la inclusión en un programa de vigilancia es que la detección endoscópica de la displasia puede ser relativamente difícil y las biopsias aleatorias pueden dar lugar a “errores de muestreo”. Además, la interpretación histológica de las biopsias tomadas también puede resultar difícil y, como ya se ha mencionado, las endoscopias conllevan riesgos potenciales y generan costes.
Cribado y vigilancia: directrices
Existen varias directrices internacionales para el tratamiento de los pacientes con esófago de Barrett. A continuación, nos gustaría comentar brevemente las directrices de la Asociación Americana de Gastroenterología (ACG), a las que nos adherimos esencialmente en el Stadtspital Triemli (Fig. 3) [9]:
Los pacientes con esófago de Barrett sin displasia deben someterse a una segunda gastroscopia en el plazo de un año y a un seguimiento cada tres años si la displasia sigue sin detectarse.
Si se detecta una displasia de “bajo grado”, se recomienda repetir la gastroscopia en un plazo de seis meses y que un segundo patólogo confirme la displasia. A partir de entonces, se recomiendan controles anuales hasta que la mucosa esté libre de displasia dos veces.
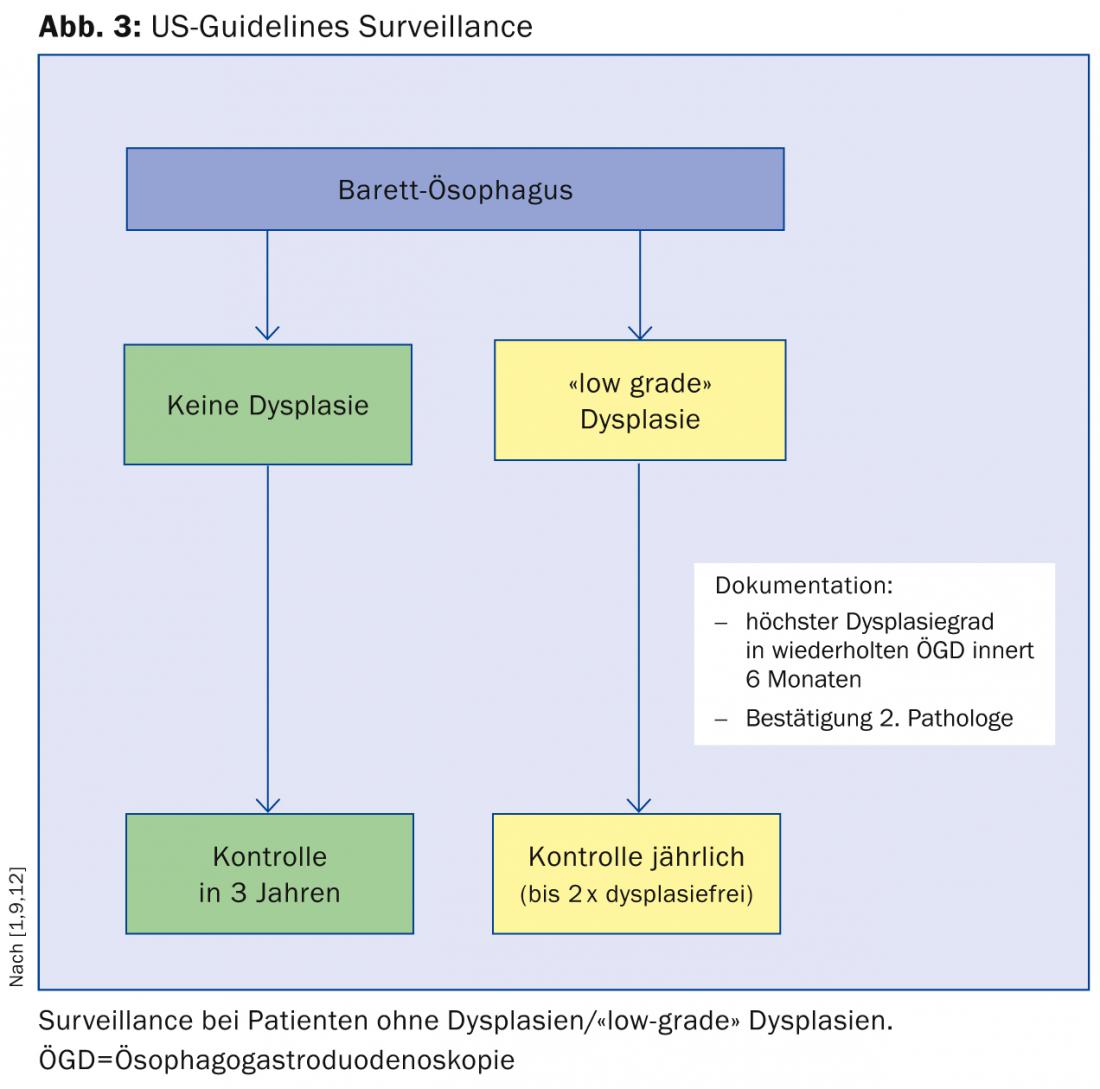
Si se detecta una displasia de “alto grado”, también es necesaria la confirmación por un segundo instituto patológico. El procedimiento posterior depende entonces de la edad del paciente, la experiencia del centro respectivo y las comorbilidades.
Terapias para el esófago de Barrett y el adenocarcinoma
Terapia con inhibidores de la bomba de protones: Se recomienda la terapia con un inhibidor de la bomba de protones (IBP, dosis 20-40 mg/día) como terapia a largo plazo. Esto es así a pesar de que no existen estudios aleatorizados controlados con placebo que demuestren que la terapia con IBP provoque una regresión del epitelio metaplásico o una reducción del desarrollo de carcinomas [8].
Terapias para displasias de “alto grado “: Las lesiones pequeñas y visibles macroscópicamente se tratan endoscópicamente mediante mucosectomía o ablación por radiofrecuencia (ARF). Los pacientes con lesiones grandes deben ser discutidos interdisciplinariamente entre gastroenterólogos y cirujanos. Sin embargo, según las recomendaciones de un grupo multidisciplinar internacional de expertos, la resección endoscópica suele ser preferible a la terapia quirúrgica, ya que se asocia a una mayor tasa de complicaciones [10].
Durante la mucosectomía, se aspiran grandes zonas de mucosa en un capuchón que se fija a la punta del endoscopio. A continuación, las lesiones pueden resecarse con una unidad de corte. Este método permite no sólo una terapia de las displasias de “alto grado” y los carcinomas precoces, sino también una estadificación definitiva.
La ablación por radiofrecuencia -el segundo método más utilizado para la ablación del epitelio de Barrett- ablaciona la mucosa de Barrett mediante el uso de energía de radiofrecuencia liberada por un balón.
El resultado a largo plazo de estos métodos es muy bueno.
Por ejemplo, en un estudio reciente, tres años después de la ablación por radiofrecuencia, el 98% de los pacientes seguían libres de displasia y el 91% de los pacientes no presentaban indicios de mucosa de Barrett [11].
CONCLUSIÓN PARA LA PRÁCTICA
- El epitelio de barretina puede dar lugar a una displasia de “bajo grado” o de “alto grado” y, en el peor de los casos, a un peligroso adenocarcinoma.
- En pacientes con esófago de Barrett sin displasia: una segunda gastroscopia (en el plazo de un año) y seguimiento (cada tres años) si la displasia sigue sin detectarse.
- Displasias de “bajo grado”: repetición de la gastroscopia en un plazo de seis meses y confirmación por un segundo patólogo. A partir de entonces, dos controles anuales hasta que la mucosa esté libre de displasia.
- Displasia de “alto grado”: confirmación también por un segundo instituto patológico. El procedimiento posterior depende de la edad del paciente, la experiencia del centro respectivo y las comorbilidades.
- Se recomienda la terapia con un IBP.
- La terapia de las displasias de “alto grado” mediante resección de la mucosa o ablación por radiofrecuencia muestra muy buenos resultados.
- Sampliner RE, et al: Am J Gastroenterol 2002; 97: 1888-1895.
- Messmann H, et al: Z Gastroenterol 2005; 43: 184-190.
- Shaheen N, et al: Gastroenterology 2005; 128: 1554-1566.
- Siegel R, et al: Estadísticas sobre el cáncer, 2012. Cancer J Clin 2012; 62: 10.
- Prasag G, et. al: Clin Gastroenterol Hepatol 2013; 11: 1108.
- Wani, et al: Clin Gastroent and hepatol 2011; 9: 220-227.
- Masoud S: Gastroenterología 2013: 144: 1375.
- Panel de posición médica del Instituto AGA: Gastroenterología 2011.
- Wang KK: AM J Gastroenterol 2008; 103: 788-797.
- Bennett, et al: Gastroenterología 2012; 143: 336.
- Shaheen NJ: Gastroenterol 2011; 141: 460-468.
- Sharma P: NEJM 2009; 361: 2548-2556.
PRÁCTICA GP 2014; 9(1): 23-25











