Los síntomas vasomotores (SVM), como los sofocos y los sudores, se encuentran entre los síntomas menopáusicos más comunes. La terapia hormonal menopáusica (THM) es la terapia más eficaz. La decisión a favor o en contra de la THM se basa, entre otras cosas, en la intensidad de las molestias individuales, las comorbilidades, el riesgo individual de padecer ciertas enfermedades y en la actitud personal hacia la menopausia y la terapia de los síntomas relacionados con la menopausia. En 2015, se actualizaron las recomendaciones del SGGG sobre la MHT.
Los sofocos y la sudoración (síntomas vasomotores, SVM) se encuentran entre las quejas más comunes durante la menopausia. La prevalencia de estas molestias es de hasta el 50% en la fase reproductiva y la perimenopausia y de hasta el 80% en la posmenopausia. La mediana de la duración total de los SVM frecuentes (es decir, ≥6 días con SVM en las últimas dos semanas) es de 7,4 años, e incluso de más de 11,8 años para la aparición en la pre y perimenopausia temprana [1]. Los SVM se atribuyen a una disfunción termorreguladora hipotalámica debida a la reducción de la actividad opioide central endógena inducida por la deficiencia de estrógenos asociada a la menopausia [2].
Diagnóstico
Los diagnósticos básicos para el VMS incluyen la historia clínica y el laboratorio:
- Historial médico: ¿Está la mujer en la menopausia? (amenorrea secundaria durante doce meses); cuestionario sobre los síntomas de la menopausia, por ejemplo, Escala de Valoración de la Menopausia (MRS) II
- Laboratorio: ¿Existe hipogonadismo hipergonadotrópico? (FSH >40 UI/l con tres mediciones a intervalos de unas semanas; deficiencia de estrógenos con E2 <30 pg/ml)
En el diagnóstico diferencial del VMS, se distingue entre “sofocos húmedos” y “sofocos secos”, es decir, si la sensación de calor se acompaña también de sudoración (Tab. 1) [3,4]. En consecuencia, el diagnóstico diferencial incluye:
- Diagnóstico de laboratorio en suero o sangre. Sangre EDTA: FSH, estradiol, progesterona, TSH, fT3, fT4, anti-TPO, TRAK, recuento sanguíneo diferencial, transaminasas, Krea-.
- tinina, potasio, glucemia en ayunas, hemocultivos si es necesario, prueba del VIH, prueba TINE, triptasa, VIP (péptido intestinal vasoactivo), calcitonina
- Diagnósticos de laboratorio en la recogida de orina de 24 horas: 5-Hy-
- ácido droxiindolacético (5-HIAA), catecolaminas (adrenalina, noradrenalina) o metabolitos de catecolaminas (metanefrinas, normetanefrina), metilhistamina o ácido 1,4-metilimidazolacético.
- Si es necesario, diagnóstico por imagen: radiografía de tórax, tomografía computarizada de tórax, ecografía renal
- Biopsia de médula ósea si es necesario.

Terapia
Para el tratamiento del síndrome premenstrual existen la terapia hormonal menopáusica convencional (THM), la medicina alternativa y complementaria y la farmacoterapia no hormonal. A continuación, se tratará la THM con más detalle, ya que en 2015 la carta de expertos sobre la THM fue actualizada por la Sociedad Suiza de Ginecología y Obstetricia (SGGG) [5].
Terapia hormonal para la menopausia (THM)
Indicación, dosis y forma de aplicación: Por THM convencional se entiende el uso de estrógenos, progestágenos y, con restricciones, andrógenos. Las indicaciones para la MHT sistémica son el VMS. También pueden mejorarse o eliminarse otros síntomas asociados a la menopausia, como los trastornos del sueño, los estados de ánimo depresivos, la disminución del rendimiento y la memoria, los síntomas óseos y articulares, los cambios en la visión, la piel y las mucosas, y la caída del cabello.
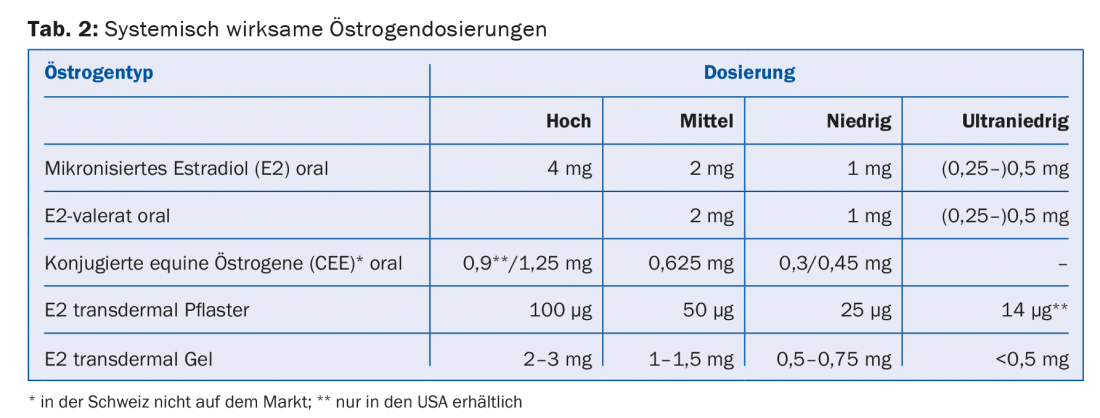
Los estrógenos sistémicamente activos están disponibles en diferentes dosis (alta, media, baja y ultrabaja) y formas de aplicación (comprimido, gel, parche) (tab. 2). En mujeres con útero, está indicada la administración adicional de un progestágeno para la protección del endometrio. Como alternativa, existe la administración directa de un progestágeno mediante un DIU (Mirena®). Tanto la dosis de estrógeno como la de progestágeno deben elegirse lo más bajas posible. Sin embargo, en el caso de la menopausia prematura (<40 años de edad) y la menopausia precoz (<45 años de edad), el reemplazo hormonal “real” debe continuarse hasta al menos los 51 años de edad. Cada MHT debe ser reevaluado anualmente. No es necesario ni razonable limitar arbitrariamente la duración de la aplicación de la MHT.
Contraindicaciones: Las contraindicaciones absolutas de la THM son el embarazo, la hemorragia vaginal inexplicada, el carcinoma de mama y de endometrio y el tromboembolismo arterial y venoso. Las contraindicaciones relativas incluyen la enfermedad hepática aguda, la disfunción hepática crónica grave, los cálculos biliares, ciertos trastornos lipometabólicos, la hipertensión y la migraña.
Beneficios adicionales de la MHT
Prevención de fracturas: la THM reduce significativamente el riesgo de fracturas relacionadas con la osteoporosis en todas las localizaciones en un 25-40%. En las mujeres con un mayor riesgo de fractura, la THM es por tanto una terapia de primera elección incluso en los casos asintomáticos. Faltan datos sobre fracturas en los preparados de MHT de dosis baja y ultrabaja. No se recomienda iniciar la THM con el único propósito de prevenir las fracturas después de los 60 años. Por el contrario, la THM individualizada sola para la prevención de fracturas puede continuarse más allá de los 60 años, siempre que se consideren los beneficios y riesgos potenciales a largo plazo en comparación con las terapias alternativas no hormonales. El tratamiento específico está indicado para la osteoporosis manifiesta (con fractura).
Enfermedad coronaria (EC): La monoterapia estrogénica a dosis medias reduce significativamente el riesgo de EC y la mortalidad por todas las causas en las mujeres que inician la THM a la edad de <60 años o en los diez años siguientes a la menopausia (“ventana favorable”). Una administración combinada de estrógeno-progestágeno con inicio dentro de la ventana favorable muestra un efecto de neutro a positivo dependiendo del progestágeno utilizado. La prevención cardiovascular primaria por sí sola no es una indicación para la THM. La THM para la prevención secundaria y en presencia de una cardiopatía coronaria sintomática está contraindicada.
Riesgos de la MHT
Eventos cerebrovasculares (CVI): El riesgo adicional de ictus isquémico atribuible a la THM aumenta con la edad bajo THM oral. No existen las “ventanas baratas”. El riesgo absoluto sigue siendo bajo en las mujeres <60 años en la Iniciativa para la Salud de la Mujer (WHI) [6] y en grandes estudios observacionales con uno a dos casos por 10.000 mujeres-año. Después de los 60 años, el riesgo de IVC puede llegar a ser significativo con la THM oral. El riesgo es menor con la MHT transdérmica en dosis bajas o medias. Por lo tanto, el estrógeno transdérmico debería preferirse para las mujeres con un mayor riesgo inicial de IVC.
Tromboembolismo venoso (TEV): No existe una “ventana favorable”. Con la THM, el riesgo adicional de TEV con CEE más acetato de medroxiprogesterona (AMP) en el grupo de edad de 50-59 años es de 11 y con CEE sola de cuatro casos por 10.000 mujeres-año (WHI). El mayor riesgo se encuentra en los primeros meses tras iniciar la terapia. Con la MHT transdérmica en dosis bajas o medias, el riesgo es menor o no aumenta. La duración del uso y el tipo/dosis de progestágeno pueden influir en el riesgo de TEV en combinación con estrógenos. El riesgo parece ser menor con la progesterona micronizada y la dydrogesterona que con las progestinas sintéticas.
Sistema nervioso central: Aún se desconocen en gran medida las consecuencias a largo plazo de la THM iniciada en la peri o postmenopausia temprana para la cognición y la demencia. La THM iniciada tardíamente (>65 años de edad) podría tener un efecto desfavorable sobre la cognición. La THM iniciada alrededor de la menopausia y continuada hasta diez años puede estar asociada a un menor riesgo de EA.
Carcinoma de mama: Con respecto al riesgo de carcinoma de mama, hay que distinguir entre la monoterapia con estrógenos y la terapia con estrógenos-progestágenos. Según el estudio WHI, el riesgo de cáncer de mama y la mortalidad por cáncer de mama no se reducen significativamente en las mujeres histerectomizadas durante siete años de terapia sólo con CEE. En los estudios WHI, Danish Osteoporosis Prevention Study (DOPS) [7] y Nurses’ Health Study (NHS) [8], la monoterapia con estrógenos no mostró sistemáticamente un aumento del riesgo de incidencia y mortalidad por cáncer de mama hasta un periodo de observación acumulado de 13, 16 y 19 años respectivamente. Con la monoterapia con estrógenos ≥20 años, se observó un aumento del riesgo de cáncer de mama en las mujeres de peso normal, pero no en las obesas y con sobrepeso.
La situación es diferente con la terapia de estrógeno-progestina. Con CEE + AMP, el riesgo de cáncer de mama no aumenta en las usuarias primerizas en los primeros 5,6 años de tratamiento. Después, el riesgo empieza a aumentar. Con CEE + AMP, se observaron nueve casos más por cada 10.000 mujeres-año de cáncer de mama invasivo en el WHI que en el grupo de control tras un periodo de observación acumulado de 13 años. En cambio, con E2 + acetato de noretisterona (NETA) en DOPS, el riesgo de cáncer de mama no aumentó en el periodo de observación de 16 años. La progesterona micronizada y la dydrogesterona en combinación con un estrógeno pueden asociarse a un riesgo menor que los progestágenos sintéticos. Por lo tanto, la magnitud del aumento del riesgo en la terapia combinada de estrógenos y progestágenos depende del tipo de progestágeno utilizado y de la duración de su uso.
Mortalidad
Tanto los metanálisis como los ensayos controlados aleatorios y los estudios observacionales muestran una reducción de la mortalidad por todas las causas cuando las participantes en el estudio recibieron monoterapia con estrógenos a dosis intermedias antes de los 60 años o dentro de los diez primeros años posmenopáusicos (“ventana favorable”). En el DOPS, la mortalidad por todas las causas no disminuyó significativamente con E2 ni con E2 + NETA. Por el contrario, en consonancia con otros estudios, el ENS muestra que la ovariectomía bilateral profiláctica se asocia a una mayor mortalidad a largo plazo en mujeres menores de 50 años. Tras 13 años (WHI) o 16 años (DOPS) de observación, la mortalidad cardiaca y la mortalidad por cáncer de mama se redujeron significativamente con la monoterapia estrogénica, además de la mortalidad por todas las causas.
Influencia en otros riesgos
En el WHI, al igual que en el estudio BCDDP, se observó una reducción significativa del cáncer de colon con la administración oral combinada de CEE/MPA, pero no con la monoterapia oral de CEE. La MHT transdérmica no parece reducir la incidencia del cáncer de colon. No existen pruebas epidemiológicas de un cambio en el riesgo de carcinoma bronquial o de vesícula biliar debido a la THM. Por otro lado, la THM oral (pero no la transdérmica) aumenta el riesgo de colelitiasis y colecistectomía.
Literatura:
- Avis NE, et al: Duración de los síntomas vasomotores menopáusicos durante la transición a la menopausia. JAMA Intern Med 2015; 175(4): 531-539.
- Freedman RR: Sofocos: tratamientos conductuales, mecanismos y relación con el sueño. Am J Med 2005; 118 Suppl 12B: 124-130.
- von Wolff M, Stute P: Endocrinología ginecológica y medicina de la reproducción: el libro de la práctica. 1 ed. Schattauer GmbH, Stuttgart 2013.
- Fazio SB: Abordaje del rubor en adultos. Uptodate 2015.
- Birkhäuser M, et al.: Recomendaciones actuales sobre la terapia hormonal menopáusica (THM). Carta del experto nº 42. Sociedad Suiza de Ginecología y Obstetricia 2015.
- Manson JE, et al: Terapia hormonal menopáusica y resultados de salud durante las fases de intervención y postoperatoria ampliada de los ensayos aleatorizados de la Iniciativa de Salud de la Mujer. JAMA 2013; 310(13): 1353-1368.
- Schierbeck LL, et al: Efecto de la terapia hormonal sustitutiva sobre los eventos cardiovasculares en mujeres posmenopáusicas recientes: ensayo aleatorizado. BMJ 2012; 345: e6409.
- Chen WY, et al: Terapia estrogénica sin oposición y riesgo de cáncer de mama invasivo. Arch Intern Med 2006; 166(9): 1027-1032.
PRÁCTICA GP 2016, 11(2): 14-17