La apoplejía es una enfermedad muy extendida. La mayoría de las veces conduce a una discapacidad permanente en la edad adulta. Por ello, se están llevando a cabo proyectos de investigación para mejorar el diagnóstico y la terapia.
La apoplejía es una enfermedad muy extendida. A nivel mundial, el número de pacientes con ictus isquémico y hemorrágico aumentó un 37% y un 47% respectivamente entre 1990 y 2010. Dado que el número absoluto de muertes también ha aumentado como consecuencia de ello y que el ictus es la enfermedad que con más frecuencia provoca una discapacidad permanente en la edad adulta, se están llevando a cabo numerosos proyectos de investigación dirigidos principalmente a mejorar el diagnóstico, la terapia aguda y la prevención secundaria. A continuación, se esbozarán los resultados de los estudios actuales y las consecuencias para la rutina clínica. Dado que los accidentes cerebrovasculares isquémicos (CI) representan el 85-90% de todos los accidentes cerebrovasculares y que los resultados más importantes se obtuvieron en pacientes con CI, este artículo se centrará en ellos.
Terapia aguda: ¡”el tiempo es cerebro”!
Las terapias recanalizadoras son la base y el prerrequisito básico para el éxito del tratamiento agudo de la IS. En la actualidad, esto incluye el tratamiento trombolítico intravenoso con activador del plasminógeno tisular recombinante (rtPA) [1] y la trombectomía mecánica, normalmente realizada con recuperadores de stents [2]. Ambas opciones de tratamiento tienen en común el hecho de que la terapia requiere tiempo, lo que se resume en el conocido eslogan “el tiempo es cerebro”. Se calcula que en la IS aguda se destruyen de forma irreversible casi dos millones de neuronas por minuto. Fisiopatológicamente relevante es el concepto de penumbra, según el cual el llamado núcleo del infarto se pierde de forma irreversible muy rápidamente tras la aparición de los síntomas, y la penumbra rodea al núcleo del infarto, pero al menos brevemente abastecida por colaterales y, por tanto, potencialmente salvable. En un momento dado, el daño potencial de la medida de recanalización supera el beneficio esperado, por lo que entonces no debe llevarse a cabo la terapia. Mientras que hace sólo unos años se intentó definir ventanas temporales generalmente vinculantes (trombólisis intravenosa: 4,5 horas; trombectomía: 6 horas), cada vez está más claro que existen grandes diferencias interindividuales en la dinámica de progresión del infarto, que presumiblemente dependen en gran medida del estado colateral del paciente respectivo. En consecuencia, la terapia, es decir, la evaluación de la ventana temporal, del tratamiento recanalizador también debe adaptarse individualmente. A continuación, varios ejemplos explicarán la situación actual del estudio en este campo.
La trombectomía a veces tiene éxito incluso horas después del inicio de los síntomas
El estudio DAWN [3] investigó los resultados de las trombectomías dentro de una ventana temporal de seis a veinticuatro horas (“última vez que se le vio bien”). Se incluyó a los pacientes con oclusión de la arteria carótida interna intracraneal (ACI) o del segmento M1 de la arteria cerebral media (ACM) detectada mediante angiografía por TC (ATC) o angiografía por RM (ARM) si existía un desajuste entre el volumen del infarto y la gravedad de los síntomas clínicos. Otros criterios de inclusión incluían una escala de Rankin modificada (mRS) premórbida de 0-1. Los pacientes fueron asignados aleatoriamente al grupo de trombectomía (n=107) y al grupo de control (n=99). La puntuación media de la escala de ictus de los Institutos Nacionales de la Salud (NIHSS) fue de 17 en ambos grupos y el volumen medio del infarto fue de 7,6 ml en el grupo de trombectomía y de 8,9 ml en el grupo de control. Después de 90 días, el 49% del grupo de trombectomía era funcionalmente independiente (mRS 0-2), en comparación con sólo el 13% del grupo de control. Ya a las 24 horas, se observó una diferencia en el volumen medio del infarto (8 ml en el grupo de trombectomía frente a 22 ml en el grupo de control). Los puntos finales adversos no difirieron en los dos grupos.
Otro estudio que investigó el procedimiento de trombectomía dentro de una ventana de tiempo ampliada es el estudio DEFUSE-3 [4]. Se investigó una ventana temporal de 6-16 horas (grupo de trombectomía: n=92; grupo de control: n=90), con un volumen inicial del infarto de un máximo de 70 ml y una relación entre el volumen del infarto y el área amenazada de al menos 1,8 con una penumbra de al menos 15 ml. Tenía que haber oclusión de la ACI o de la ACM proximal confirmada con ATC o ARM. Se eligió como criterio de valoración primario la puntuación mRS a los 90 días. Además, se evaluaron el volumen del infarto tras 24 horas, el aumento del volumen del infarto, la reperfusión así como la reapertura de la arteria ocluida. Después de 90 días, el 45% del grupo de trombectomía y el 17% del grupo de control eran funcionalmente independientes. En el grupo de trombectomía, el aumento medio del volumen del infarto fue de 23 ml, en el grupo de control fue de 33 ml.
Ambos estudios indican que, en pacientes seleccionados, la trombectomía puede realizarse con éxito clínico incluso muchas horas después del inicio de los síntomas. Es imperativo que esto se tenga en cuenta en la rutina clínica.
Resonancia magnética de emergencia 24 horas al día, 7 días a la semana, en caso de que el plazo no esté claro
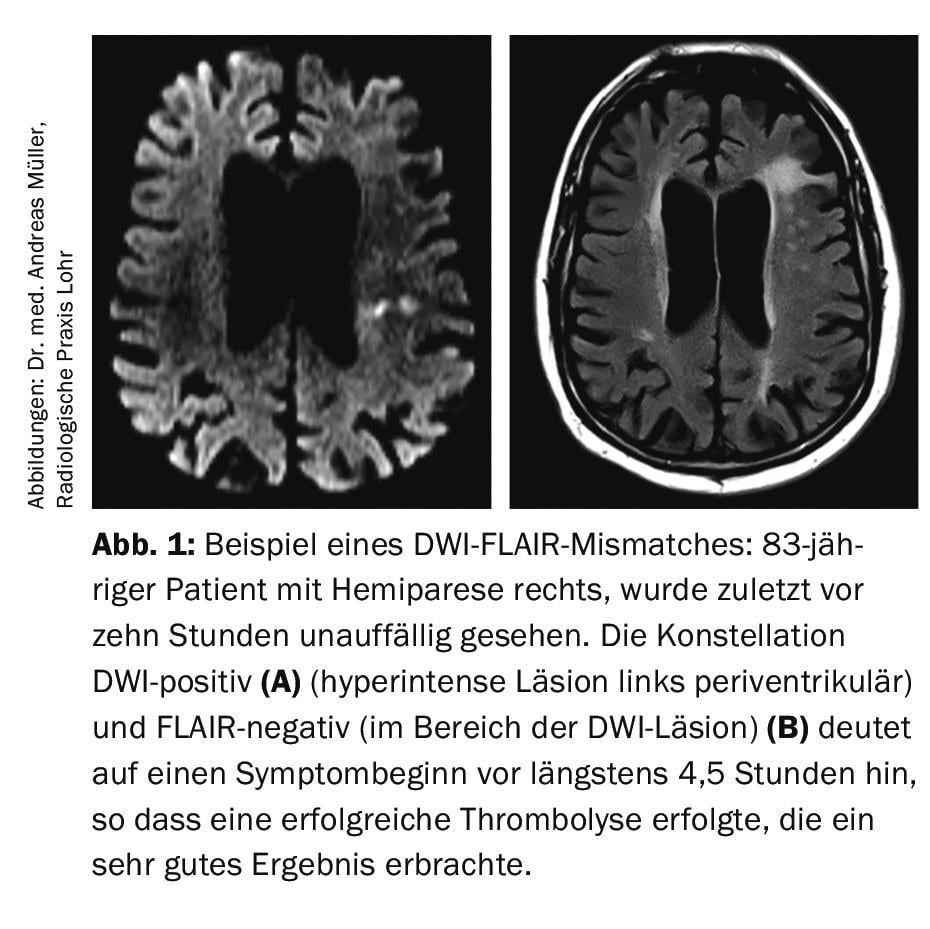
Se sabe que hasta en un 30% de los casos de IS se desconoce la ventana temporal (es decir, el inicio de los síntomas), por lo que formalmente, según los criterios de aprobación del rtPA, existe una contraindicación para la trombólisis intravenosa. Con el objetivo de tratar a estos pacientes con trombólisis intravenosa después de todo, el grupo de trabajo de Hamburgo dirigido por el Prof. Dr. med. Götz Thomalla evaluó la denominada imagen de desajuste DWI-FLAIR (DWI=”imagen ponderada por difusión”; FLAIR=”recuperación de inversión atenuada por fluidos”). La secuencia DWI muestra un edema citotóxico, que suele desarrollarse muy pronto tras el inicio de un ictus isquémico. Por el contrario, la secuencia FLAIR indica edema vasogénico, que no suele desarrollarse hasta 4,5 horas después del inicio del infarto. De ello se deduce que si un paciente muestra una señal DWI-positiva pero ninguna anormalidad en la señal FLAIR, es relativamente probable que el momento de aparición de los síntomas sea dentro de las 4,5 horas anteriores a la realización de la RMN (Fig.1). En el estudio multicéntrico aleatorizado y controlado con placebo sobre el despertar, se incluyeron pacientes con IS (DWI-positivo, FLAIR-negativo) y se aleatorizaron 1:1 entre rtPA 0,9 mg/kg de peso corporal o placebo [5]. El estudio se interrumpió antes de tiempo porque en un análisis provisional el criterio de valoración primario (mRS después de 90 días 0-1 puntos) se alcanzó con una frecuencia significativamente mayor en el grupo verum (53,3%) que en el grupo placebo (41,8%). La tasa de hemorragias intracraneales aumentó de forma no significativa en el grupo verum con un 2,0% en comparación con el grupo placebo con un 0,4%. En general, el estudio fue aclamado como un gran éxito. De ahí surgió la idea de que se debería disponer de un servicio de resonancia magnética de urgencia las 24 horas del día para no perder ninguna oportunidad trombolítica si el margen de tiempo no está claro.
Los neurólogos con pensamiento crítico se preguntan desde hace tiempo si, en el caso de un paciente individual, no sería también concebible a) a pesar de una ventana temporal <4,5 horas (por ejemplo, porque las colaterales son muy escasas y al cabo de poco tiempo ya hay un núcleo de infarto grande o una penumbra pequeña o inexistente), o b) a pesar de una ventana de tiempo >4,5 horas para realizar la trombólisis en los casos en los que hay un núcleo de infarto relativamente pequeño y una penumbra grande.
Mientras que la constelación a) apenas se ha estudiado y también es probable que ocurra con mucha menos frecuencia, es la constelación b) frecuentes en la rutina clínica. Hay estudios recientes que investigaron la trombólisis intravenosa hasta 9 horas después del inicio de un ictus isquémico. El ensayo multicéntrico aleatorizado y controlado con placebo EXTEND incluyó a 225 pacientes con IS y zonas cerebrales hipoperfundidas, incluida la penumbra potencialmente salvable, en la ventana temporal de 4,5 a 9 horas tras el inicio de los síntomas y aleatorizados 1:1 a los grupos de 0,9 mg/kg de peso corporal o placebo [6]. Tras la publicación del estudio positivo del despertar [5], el estudio EXTEND también finalizó prematuramente. El criterio de valoración primario (mRS a los 90 días 0-1 puntos) se cumplió en el 35,4% de los pacientes del grupo verum y en el 29,5% de los pacientes del grupo placebo (p=0,04). Se diagnosticaron hemorragias intracerebrales en el 6,2% de los casos del grupo verum y en el 0,9% de los casos del grupo placebo (p=0,05).
En resumen, la trombólisis intravenosa entre 4,5 y 9 horas después del inicio de los síntomas en una población de pacientes seleccionada conduce a un mejor resultado clínico a los 90 días a pesar de una mayor tasa de hemorragia cerebral. Esta afirmación está respaldada por un metaanálisis reciente [7]. Sin embargo, una transferencia inmediata de estos resultados a la rutina clínica general parece demasiado prematura. En última instancia, sin embargo, cabe suponer que en los próximos años se producirá una individualización cada vez mayor de la terapia aguda del ictus isquémico basada en la imagen multimodal.
¿Tenecteplasa como alternativa a la alteplasa?
Para la trombólisis, actualmente sólo se utiliza alteplasa (0,9 mg/kg de peso corporal, máx. 90 mg) está aprobado. Se siguen investigando sustancias alternativas con el objetivo de conseguir una terapia con mayor seguridad y eficacia. La tenecteplasa podría ser una alternativa prometedora.
La tenecteplasa tiene una mayor afinidad por la fibrina y una semivida más larga. Esto permitiría la administración mediante un bolo frente a la infusión de una hora con alteplasa. En el estudio NOR-TEST [8], se trató a 1100 pacientes, 549 con tenecteplasa (0,4 mg/kg) y 551 con alteplasa (0,9 mg/kg). El criterio de valoración de una mRS de 0-1 a los tres meses lo alcanzaron el 64% de los pacientes del grupo de tenecteplasa y el 63% del grupo de control. No hubo superioridad de la tenecteplasa sobre la alteplasa, ni el perfil de seguridad mostró diferencias significativas.
Por otra parte, en el estudio EXTEND-IA TNK [9] se investigó la denominada lisis puente antes de la trombectomía mediante tenecteplasa (n=101, dosis 0,25 mg/kg) en comparación con alteplasa (n=101). Los pacientes se encontraban en la franja horaria de 4,5 horas y estaban programados para una trombectomía por oclusión probada de la ACI, la ACM o la arteria basilar. El criterio de valoración primario fue la reperfusión de al menos el 50% o la ausencia de trombo interventricular. Este criterio de valoración se alcanzó en el 22% de los pacientes del grupo de tenecteplasa y en el 10% del grupo de control. El resultado funcional a los 90 días también mejoró en el grupo de tenecteplasa (mediana de mRS 2 frente a 3), sin agrupación de efectos adversos. Otros estudios, TASTE y ATTEST, no demostraron la superioridad de la tenecteplasa sobre la alteplasa, pero la agrupación de pacientes mostró una ventaja para aquellos pacientes que presentaban una oclusión completa del vaso con una recanalización completa a las 24 horas en el 71% del grupo de tenecteplasa frente al 43% del grupo de control [10].
Se están realizando más estudios. Los resultados obtenidos hasta el momento sugieren al menos una no inferioridad de la tenecteplasa con un modo de aplicación más sencillo, lo que podría suponer una ventaja relevante especialmente en el caso del transporte secundario antes de la trombectomía. Los próximos años mostrarán si la muy prometedora alternativa de trombólisis con tenecteplasa se convertirá realmente en parte de la rutina clínica.
Prevención secundaria mediante anticoagulación oral o cierre del apéndice auricular
Cualquier tratamiento antitrombótico aprobado actualmente para la prevención secundaria de la IS aumenta la probabilidad de complicaciones hemorrágicas. En el caso de la fibrilación auricular, la terapia farmacológica consiste en la anticoagulación oral. Para ello son posibles los antagonistas de la vitamina K (por ejemplo, fenprocumón, objetivo INR 2-3) o los anticoagulantes orales no dependientes de la vitamina K (NOAK, inhibidores anti-Xa o el inhibidor directo de la trombina dabigatrán), que reducen aproximadamente a la mitad el riesgo de hemorragia cerebral en comparación con los antagonistas de la vitamina K.
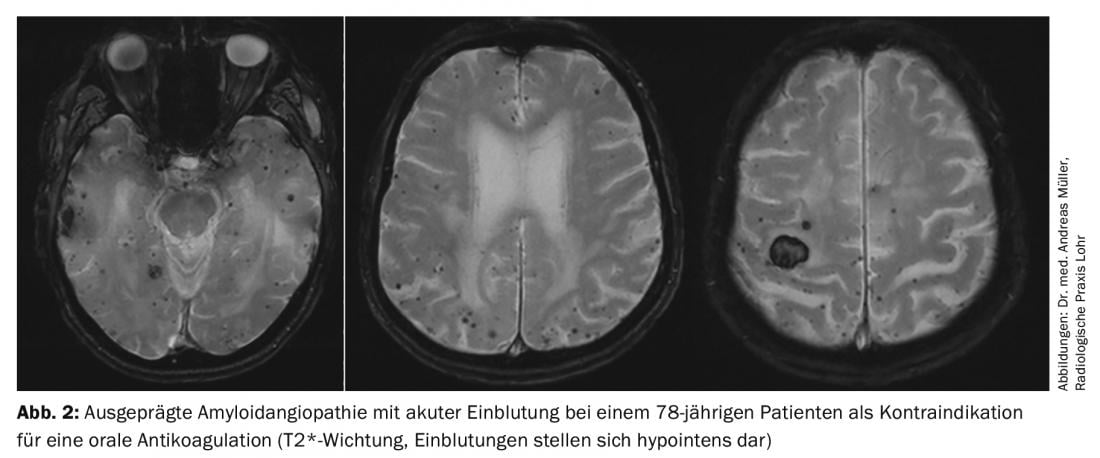
No obstante, hay pacientes que no pueden ser tratados con anticoagulantes orales debido a un mayor riesgo de hemorragia. Para ellos, el cierre intervencionista del apéndice auricular es en principio una opción. Se cree que el 90% de todos los trombos cardíacos se forman en la aurícula izquierda. Se han desarrollado varios dispositivos para el cierre del apéndice auricular, pero los datos actuales son mejores para el llamado dispositivo Watchman®. Recientemente se han publicado los datos a 5 años de los ensayos PREVAIL y PROTECT AF, que muestran un menor riesgo de hemorragia y una menor mortalidad en comparación con la warfarina [11]. En resumen, el cierre intervencionista de la orejuela auricular izquierda mediante el dispositivo Watchman® puede ofrecer ventajas, sobre todo en pacientes con alto riesgo de hemorragia (puntuación HASBLED elevada) o contraindicación para la anticoagulación oral, ya que se reduce significativamente el riesgo de sangrado (especialmente de hemorragia cerebral) (Fig. 2) . Es fundamental tener en cuenta: a) Falta de datos a largo plazo, b) Complicaciones periintervencionistas, c) Posibilidad de que se formen trombos cardíacos fuera de la orejuela auricular, d) Necesidad de una doble inhibición temporal de la función plaquetaria. La comparación entre los NOAK y el cierre del apéndice auricular, de la que aún no se ha publicado ningún estudio, sigue siendo objeto de debate. Es concebible que la ventaja del cierre del apéndice auricular en términos de reducción de las complicaciones hemorrágicas no esté presente con la anticoagulación con NOAK.
Los menores de 60 años con ESUS y FOP se benefician del cierre del FOP más el TFH
Para otra intervención cardiaca, la situación del estudio cambió significativamente en 2017. Mientras que hasta entonces los pacientes con IS y foramen oval persistente (FOP) como causa putativa del ictus eran tratados únicamente con un inhibidor de la función plaquetaria (TFH), varios trabajos han demostrado que en pacientes seleccionados de hasta 60 años de edad con ictus criptogénico y FOP con al menos una derivación derecha-izquierda moderada, el cierre intervencionista del FOP más el TFH es superior al TFH solo [12–14]. La anticoagulación oral no ofrece explícitamente ninguna ventaja. El límite de edad de 60 años se basa en la suposición de que los pacientes de más edad tienen más probabilidades de sufrir una causa alternativa de ictus que los más jóvenes (a saber, principalmente fibrilación auricular). En última instancia, sin embargo, la línea se traza de forma arbitraria y queda por ver si los pacientes mayores de 60 años no se benefician también del cierre del FOP.
Dado que el término “ictus criptogénico” no está definido con precisión, en 2014 se introdujo el término ESUS (“ictus embólico de origen indeterminado”) [15]. Basándose en esta definición precisa, se investigó si los pacientes con ESUS (es decir, con sospecha de fibrilación auricular pero no demostrada) están mejor protegidos de una recidiva de IS mediante NOAK que mediante AAS. El ensayo NAVIGATE-ESUS, en el que se comparó el rivaroxabán con el AAS, tuvo que interrumpirse prematuramente después de 3609 pacientes porque no cabía esperar ninguna ventaja en el grupo de intervención. [16]. El estudio RE-SPECT-ESUS también confirmó que la anticoagulación oral frente a la TFH con AAS no beneficia al grupo global de pacientes con ESUS [17]. En este último estudio participaron 5390 pacientes de 564 centros de estudio. Recibieron AAS 100 mg o dabigatrán a 110 mg o 150 mg dos veces al día. El criterio de valoración primario fue la recurrencia de la IS. Tras una mediana de 19 meses, el 4,1% de los pacientes del brazo de dabigatrán tuvieron un segundo acontecimiento al año, en comparación con el 4,8% al año en el brazo de AAS del estudio. La reducción del riesgo relativo del 15% no alcanzó significación estadística (p=0,10). Se produjeron hemorragias graves en el 1,7% (dabigatrán) y el 1,4% (AAS) de los pacientes al año. Hubo una diferencia significativa en detrimento del dabigatrán en las hemorragias no graves clínicamente relevantes (1,6 frente a 0,9% al año). Los ensayos ATTICUS y ARCADIA que comparan el apixaban con el AAS siguen pendientes. Independientemente de esto, cada vez hay más pruebas de que, en el caso del ESUS, la anticoagulación oral con NOAK es superior a la TFH en pacientes seleccionados (por ejemplo, con FOP [18] o agrandamiento de la aurícula izquierda [19]). Sin embargo, se necesitan más estudios para reproducir estos resultados.
La doble TFH puede prevenir las recidivas
Desde hace muchos años está claro que la doble TFH permanente (normalmente con AAS y clopidogrel) es desfavorable en el balance riesgo-beneficio. En ciertas constelaciones, sin embargo, un doble TFH temporalmente limitado puede ser útil y necesario. Los motivos conocidos son, por ejemplo, las estenosis intracraneales sintomáticas [20] o la colocación de endoprótesis en las arterias que irrigan el cerebro. En cambio, es nuevo el hallazgo de que los pacientes con AIT y alto riesgo de recurrencia (puntuación ABCD2 ≥4) o IS leve (“ictus menor”, NIHSS ≤3) están mejor protegidos frente a los episodios de recurrencia isquémica precoz mediante la doble TFH con AAS y clopidogrel durante una duración de 10-21 días que con la monoterapia con AAS [21,22]. Aumenta el riesgo de hemorragia. Sin embargo, los autores del ensayo POINT estiman que la doble TFH previene tres veces más las IS recurrentes que las hemorragias graves [22]. Se espera que pronto se incluya una recomendación en las directrices de la Sociedad Alemana de Neurología (DGN). Ya se ha publicado una declaración positiva sobre el procedimiento en la página web de la DGN.
Outlook
Los logros terapéuticos enumerados de los últimos años son expresión de una intensa actividad investigadora y de un enfoque estrictamente basado en la evidencia. Es de esperar y también de suponer que esta evolución continúe. Con toda probabilidad, el tratamiento del ictus se complicará a medida que se identifiquen cada vez más pacientes individuales (grupos) que respondan particularmente bien o mal a una opción terapéutica concreta. La individualización de la medicina avanza.
Literatura:
- Hacke W, et al: Trombolisis con alteplasa entre 3 y 4,5 horas después de un ictus isquémico agudo. N Engl J Med 2008; 359(13): 1317-1329.
- Berkhemer OA, et al: Un ensayo aleatorizado de tratamiento intraarterial para el ictus isquémico agudo. N Engl J Med 2015; 372(1): 11-20.
- Nogueira RG, et al: Trombectomía de 6 a 24 horas después del ictus con desajuste entre déficit e infarto. N Engl J Med 2018; 378: 11-21.
- Albers GW, et al: Trombectomía para el ictus de 6 a 16 horas con selección mediante imágenes de perfusión. N Engl J Med 2018; 378(8): 708-718.
- Thomalla G, et al: Trombolisis guiada por resonancia magnética para el ictus con hora de inicio desconocida. N Engl J Med 2018; 379(7): 611-622.
- Ma H, et al: Trombolisis guiada por imagen de perfusión hasta 9 horas después del inicio del ictus. N Engl J Med 2019; 380(19): 1795-1803.
- Campbell BCV, et al: Ampliación de la trombólisis a 4,5-9 h e ictus de despertar mediante imágenes de perfusión: revisión sistemática y metaanálisis de datos de pacientes individuales. Lancet 2019; 394(10193): 139-147.
- Logallo N, et al: Tenecteplasa frente a alteplasa para el tratamiento del ictus isquémico agudo (nor-test): un ensayo de fase 3, aleatorizado, abierto y con resultados ciegos. Lancet Neurol 2017; 16: 781-788.
- Campbell BCV, et al: Tenecteplase frente a alteplase antes de la trombectomía para el ictus isquémico. N Engl J Med 2018; 378(17): 1573-1582.
- Bivard A, et al: La tenecteplasa en el ictus isquémico ofrece una mejor recanalización. Neurología 2017; 89(1): 62-67.
- Reddy VY, et al: 5-Year Outcomes After Left Atrial Appendage Closure: From the PREVAIL and PROTECT AF Trials. J Am Coll Cardiol 2017; 70(24): 2964-2975.
- Søndergaard L, et al: Cierre del foramen oval permeable o terapia antiplaquetaria para el ictus criptogénico. N Engl J Med 2017; 377(11): 1033-1042.
- Mas JL, et al: Cierre del foramen oval permeable o anticoagulación frente a antiplaquetarios tras un ictus. N Engl J Med 2017; 377(11): 1011-1021.
- Saver JL, et al: Resultados a largo plazo del cierre del foramen oval permeable o de la terapia médica tras un ictus. N Engl J Med 2017; 377(11): 1022-1032.
- Hart RG, et al: Accidentes cerebrovasculares embólicos de origen indeterminado: argumentos a favor de un nuevo constructo clínico. Lancet Neurol 2014; 13(4): 429-438.
- Hart RG, et al: Rivaroxaban para la prevención del ictus tras un ictus embólico de origen indeterminado. N Engl J Med 2018; 378(23): 2191-2201.
- Diener HC, et al: Dabigatrán para la prevención del ictus tras un ictus embólico de origen indeterminado. N Engl J Med 2019; 380(20): 1906-1917.
- Kasner SE, et al: Rivaroxaban or aspirin for patent foramen ovale and embolic stroke of undetermined source: a prespecified subgroup analysis from the NAVIGATE ESUS trial. Lancet Neurol 2018; 17(12): 1053-1060.
- Healey JS, et al: Accidente cerebrovascular recurrente con rivaroxaban en comparación con aspirina según los predictores de fibrilación auricular: Análisis secundario del ensayo clínico aleatorizado NAVIGATE ESUS. JAMA Neurol 2019, en prensa.
- Chimowitz MI, et al: Colocación de endoprótesis versus tratamiento médico agresivo para la estenosis arterial intracraneal. N Engl J Med 2011; 365(11): 993-1003.
- Prasad K, et al: Terapia antiplaquetaria dual con aspirina y clopidogrel para el accidente isquémico transitorio agudo de alto riesgo y el ictus isquémico menor: guía de práctica clínica. BMJ 2018; 363: k5130.
- Johnston SC, et al: Clopidogrel y aspirina en el ictus isquémico agudo y el AIT de alto riesgo. N Engl J Med 2018; 379(3): 215-225.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(5): 5-9