Las infecciones agudas activan diversos mecanismos inflamatorios y procoagulatorios y se consideran factores de riesgo transitorios de tromboembolismo venoso (TEV). Las infecciones no asociadas al reposo en cama y la hospitalización también aumentan el riesgo de TEV. La estructura causa-efecto es compleja. Para evaluar el riesgo de trombosis en pacientes con infecciones, se pueden utilizar las “banderas rojas” como guía. En cuanto a los pacientes infectados con fibrilación auricular, la anticoagulación está indicada si no existe una tendencia hemorrágica específica.
Según los conocimientos actuales, las infecciones están asociadas a un aumento del riesgo comparable al de los factores de riesgo tradicionales, entre los que se encuentran las operaciones importantes en los últimos tres meses, la inmovilización de al menos tres días o una enfermedad tumoral activa en los últimos seis meses, explica el Prof. Philip Tarr, MD, Kantonsspital Baselland, Bruderholz [1]. Aunque las infecciones aún no se incluyen en las puntuaciones diagnósticas para determinar la probabilidad clínica previa a la prueba, su asociación con el tromboembolismo venoso (TEV) está bien documentada en la literatura [1].
Mayor riesgo de TEV tras infecciones respiratorias o del tracto urinario
Los pacientes hospitalizados con una infección tienen aproximadamente el doble de riesgo de TEV que los pacientes hospitalizados sin infección [1]. Incluso las infecciones banales sin confinamiento en cama ni hospitalización aumentan el riesgo de TEV, por ejemplo las infecciones respiratorias y las infecciones del tracto urinario, que afectan a varios cientos de miles de personas en Suiza cada año. “El riesgo de tromboembolia es mayor en las primeras 1-2 semanas tras una infección, pero -y esto es emocionante- el mayor riesgo de trombosis persiste durante varios meses, hasta medio año después de una infección, al menos estadísticamente”, afirmó el ponente. Se cree que un riesgo entre 2 y 5 veces mayor de TEV persiste durante unas 2 a 4 semanas después de una simple infección respiratoria o del tracto urinario [1,6]. Aunque este riesgo disminuye con el tiempo, sigue siendo elevado entre 6 y 12 meses después de la infección, tanto en pacientes hospitalizados como no hospitalizados, según los análisis científicos (Tab. 1) [1].
Reconocer las señales de alarma: ¿qué pacientes infecciosos corren especial riesgo?
Parece plausible una asociación entre la inflamación y la tendencia a la trombosis, pero el papel de la PCR aún no se ha aclarado del todo (recuadro) [2]. En cuanto al dímero D, el Prof. Tarr desaconseja la determinación rutinaria porque a menudo se produce una elevación. Sin embargo, un dímero D normal es un buen argumento contra la TVP/LE [1]. El ponente resumió así las “señales de alarma” relativas a la trombosis venosa profunda / embolia pulmonar en pacientes infecciosos [1]:
- Disnea/dolor torácico
- Diferencia circunferencial extremidad (también brazo con catéter venoso central, puerto, línea picc)
- Si el curso clínico es más acorde con una TVP/LE y no con una (presunta) infección
- Si la fiebre no cede, a pesar de una terapia antibiótica adecuada
- En caso de fiebre sin causa identificable
- Erisipela: La TVP está presente en el 2-3% de los casos.
Patomecanismos: tríada de Virchow
La relación causa-efecto entre infección y trombosis es extremadamente compleja. Se sabe que la infección aguda activa diversos mecanismos inflamatorios y procoagulatorios [1–3]. La famosa tríada de Rudolf Virchow afirma que la trombosis se ve favorecida por tres factores: Activación de la coagulación sanguínea (hipercoagulabilidad), estasis venosa y lesión endotelial (Fig. 1) [1,2,4]. Estos mecanismos están influidos por las infecciones. Así, un estado inflamatorio activa varias proteínas de fase aguda de la cascada de la coagulación, que tienen un efecto procoagulante y aumentan por tanto el riesgo de trombosis. Entre ellos se incluyen, por ejemplo, la PCR, el fibrinógeno, el factor VIII, la interleucina-6 y el factor von Willebrand (FvW) [1,2]. No se comprende del todo si la inflamación relacionada con la infección, local o sistémica, desempeña el papel clave y si bacterias específicas (por ejemplo, S. aureus o bacilos gramnegativos) aumentan especialmente el riesgo de TEV [2,5]. Los anticuerpos antifosfolípidos (aPL), que rara vez se desencadenan por infecciones y más frecuentemente por enfermedades autoinmunes como el lupus eritematoso, también están asociados a la aparición de trombos y son un factor desencadenante del llamado síndrome antifosfolípido (SAF) [2]. Además, ciertas toxinas bacterianas e infecciones víricas como el SARS-CoV-2, el citomegalovirus o el virus de Epstein-Barr pueden dañar el endotelio [2]. Los factores de riesgo de TEV como la inmovilización, la edad, la enfermedad tumoral o la inmunosupresión aumentan aún más el riesgo de infección [2].
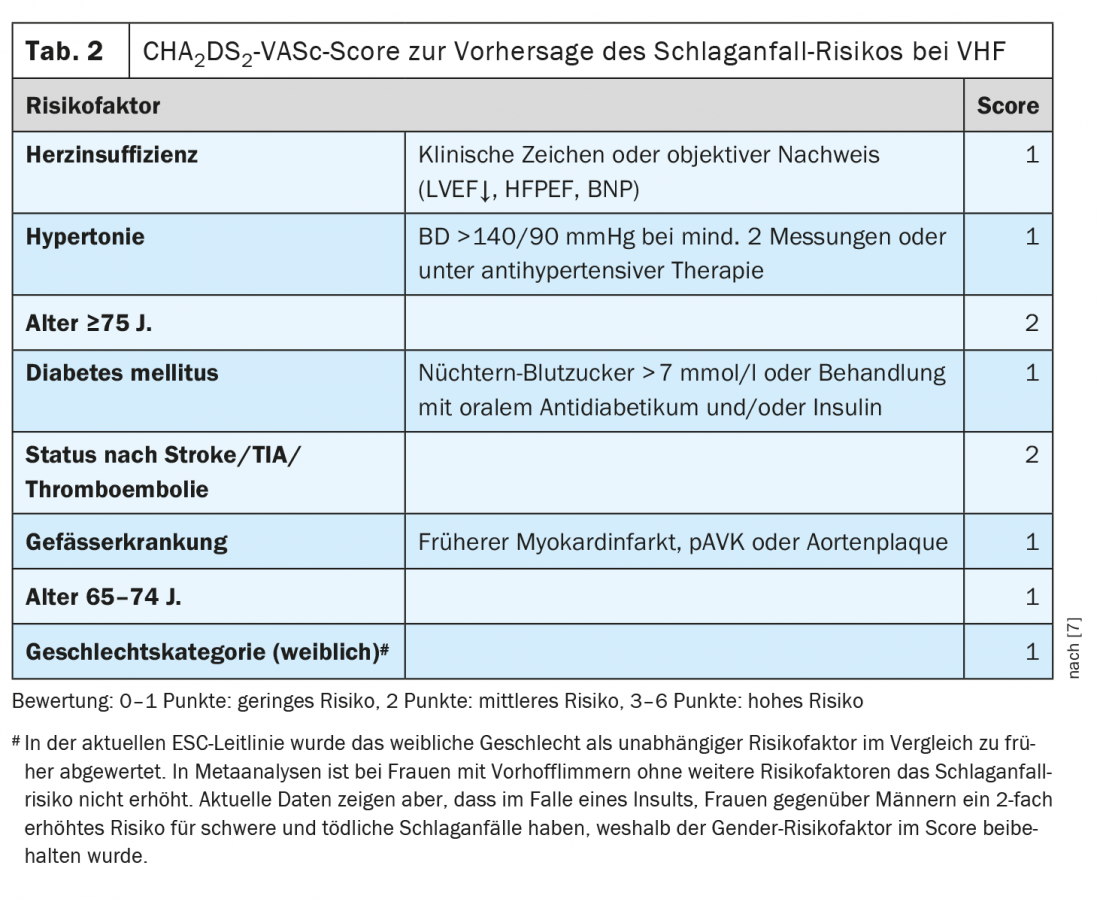
Anticoagulación en pacientes infecciosos con fibrilación auricular
“La neumonía se asocia a un acontecimiento cardiovascular en aproximadamente 1 de cada 5 pacientes”, subraya el ponente [1]. Puede tratarse de un síndrome coronario (agudo) o de un infarto de miocardio, pero también puede producirse una arritmia de nueva aparición (especialmente fibrilación auricular) o una descompensación en una insuficiencia cardiaca conocida. “La neumonía da lugar a mecanismos procoagulatorios que se activan con la inflamación”, explica el profesor Tarr [1]. Los episodios cardiovasculares en la neumonía suelen pasar desapercibidos y se asocian a un aumento de la mortalidad. El riesgo de síndrome coronario agudo (SCA) aumenta proporcionalmente con el incremento de la gravedad de la neumonía, pero también aumenta con un curso leve de la neumonía durante varias semanas o meses. La asociación con el SCA está documentada no sólo para la neumonía, sino también para la gripe, las infecciones del tracto urinario y la bacteriemia. Las infecciones también pueden desencadenar la fibrilación auricular. Esto aumenta el riesgo de accidentes cerebrovasculares embólicos. Esto tiene implicaciones terapéuticas. “Si un paciente entra en fibrilación auricular en el contexto de una neumonía: ¿se trata ahora de una fibrilación auricular provocada que sólo necesita ser anticoagulada durante un breve periodo de tiempo?”. Desde la perspectiva actual, la respuesta es “desgraciadamente no”, afirma el profesor Tarr. “Deberíamos ignorar la infección como desencadenante de la fibrilación auricular”, añade el conferenciante y añade: “El hecho de que la fibrilación auricular se haya producido debido a un desencadenante infeccioso indica que la aurícula está enferma/dilatada. En el contexto de la infección, la inflamación y los cambios electrolíticos, puede producirse una alteración de la actividad parasimpática o simpática que, en última instancia, desencadene la fibrilación auricular” [1]. En función de la puntuación CHA2DS2-VASc, las directrices de la ESC y la AHA recomiendan la anticoagulación de por vida si se produce fibrilación auricular (tab. 2) [1,7–9]. Aparentemente, existe una predisposición a la fibrilación auricular y, según los conocimientos actuales, el riesgo de ictus embólico en la fibrilación auricular paroxística desencadenada por infarto es comparable al de la fibrilación auricular permanente [1].
Fuente: Medical Congress Davos
Literatura:
- Tarr P: Infección y trombosis: Folie à deux. Prof. Philip Tarr, MD. Congreso Médico Davos, 10-11.02.2022
- Pfister T, et al: Infección y trombosis, parte 1: Antecedentes. Prim Hosp Care Allg Inn Med 2021; 21(04): 125-130.
- Riva N, Donadini MP, Ageno W: Epidemiología y fisiopatología del tromboembolismo venoso: similitudes con la aterotrombosis y papel de la inflamación. Thromb Haemost 2015; 113(6): 1176-1183.
- Bagot CN, Arya R: Virchow y su tríada: una cuestión de atribución. Revista Británica de Hematología 2008; 143(2): 180-190.
- White RH: Identificación de los factores de riesgo del tromboembolismo venoso. Circulation 2012; 125(17): 2051-2053.
- Smeeth L, et al: Riesgo de trombosis venosa profunda y embolia pulmonar tras una infección aguda en un entorno comunitario. Lancet 2006; 367(9516): 1075-1079.
- Rosemann A: Fibrilación auricular, 11/2018, www.medix.ch/media/gl_vorhofflimmern_2018_31.10.19_mh.pdf, (última consulta: 28.03.2022).
- Kirchhof P, et al: Revista Europea del Corazón. 2016 Oct 7;37(38): 2893-2962.
- January CT, et al: Circulation 2019 Jul 9; 140(2).
HAUSARZT PRAXIS 2022; 17(4): 36-37 (publicado el 6.4.22, antes de impresión).