El virus SARS-CoV-2 es un problema particular para los pacientes hematológicos. peligro. Por un lado, su sistema inmunitario suele estar debilitado por la enfermedad y, por otro, numerosas terapias reducen adicionalmente la respuesta inmunitaria. ¿Qué hacer cuando el cáncer de sangre y la COVID-19 se encuentran? ¿Y cuál es la importancia de la vacunación?
En vista de la pandemia, no sólo está en peligro el cuidado de los pacientes hematológicos, sino que ha surgido otra amenaza para ellos en forma de virus potencialmente mortal. Mientras que la mortalidad relacionada con el COVID-19 en el sector hospitalario es de aproximadamente el 12,1% para los pacientes no oncológicos en general, es del 20,5% para los pacientes oncológicos, una diferencia estadísticamente significativa. Estas cifras proceden del registroeuropeo LEOSS (Lean European Open Survey on SARS-CoV-2 infected patients). Incluso después de un tratamiento médico intensivo de la infección, según el registro, la mortalidad de los pacientes afectados por el cáncer es superior a la de los pacientes sin diagnóstico oncológico. Los afectados por una enfermedad hematológica corren un riesgo adicional, como muestra un estudio publicado en la revista científica Nature en agosto de 2020 [1]. Esto demostró lo que muchos ya sospechaban entonces: La mortalidad COVID-19 de los pacientes hematológicos es especialmente elevada. Es superior a la de todos los demás pacientes oncológicos y comparable a la de los pacientes inmunodeprimidos. En el primer año de terapia, el riesgo de morir a causa del virus del SRAS-CoV-2 se multiplica incluso por 2 en comparación con la población general. En lo que respecta a la enfermedad subyacente, los linfomas en particular parecen ser un mal prerrequisito para el curso de la infección por SRAS-CoV-2 [2]. Estos hallazgos de los dos últimos años dan motivos para un enfoque diferenciado de la enfermedad por COVID-19 en pacientes hematológicos y subrayan la importancia de la mejor profilaxis posible en esta población, un reto dada la situación dinámica y el joven panorama de los estudios.
¿Qué pacientes corren especial riesgo?
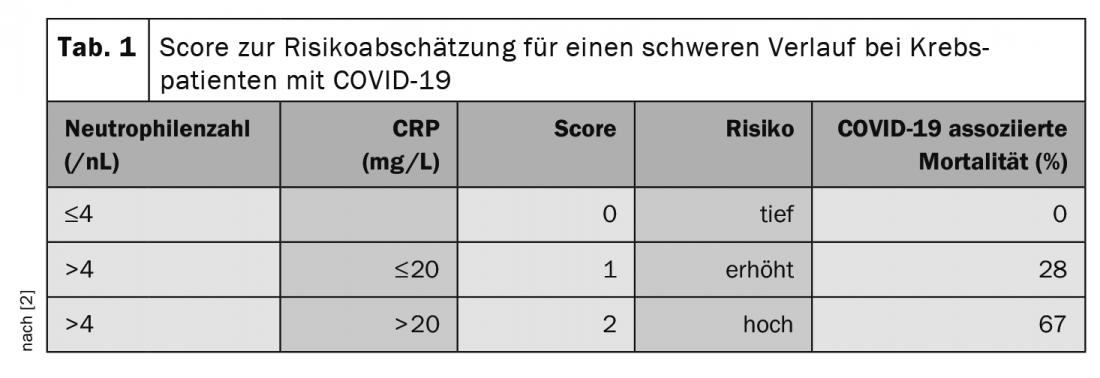
En la reunión anual de las Sociedades Alemana, Austriaca y Suiza de Hematología y Oncología Médica celebrada en octubre, el Prof. Clemens Wendtner, MD, Médico Jefe de la Clínica Schwabing de Múnich y Secretario Científico del Grupo Alemán de Estudio de la LLC (DCLLSG), destacó la importancia del tratamiento del riesgo asociado a COVID-19. En particular, corren riesgo los pacientes sometidos a terapia con anticuerpos anti-CD20 como el Rituximab y a tratamiento con esteroides, por lo que ya >10 mg/d equivalente de prednisona durante >5 días debe considerarse crítico. Los inhibidores de los puntos de control también se asocian a una mayor letalidad [2]. Un estudio también buscó factores para predecir la progresión grave de la COVID-19 en pacientes con tumores [2]. En este caso, el recuento de neutrófilos (>4,4/nL) y el valor de la PCR (>20 mg/L) antes de la infección parecen tener valor pronóstico. Los autores desarrollaron una puntuación a partir de este hallazgo (Tab. 1).
Manejo del SARS-CoV-2 en pacientes hematológicos: Bailando con el diablo
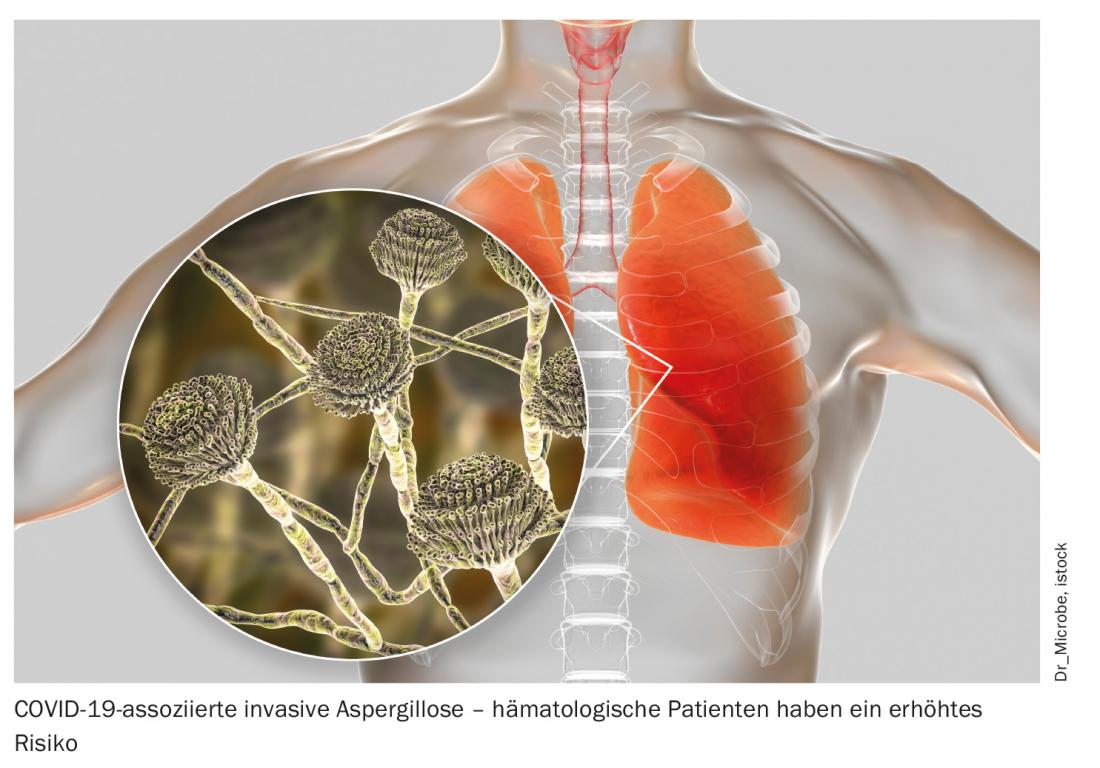
Además de la mayor susceptibilidad a los cursos graves y mortales de COVID-19, también se observa una excreción viral prologada de hasta 70 días tras el diagnóstico en los afectados por neoplasias hematológicas. Esto supone un riesgo potencial de infección para los contactos -incluso si el paciente es asintomático- y no debe pasarse por alto en el tratamiento de estos pacientes [3]. Además del estricto cumplimiento de las medidas de higiene en beneficio de todos los implicados, el tratamiento precoz es de especial importancia. Al mismo tiempo, el mejor enfoque terapéutico sigue sin estar claro. Según los expertos del congreso, la optimización de las medidas de apoyo, en particular, se encuentra indiscutiblemente en primer plano. Esto incluye la anticoagulación profiláctica en los pacientes hospitalizados, pero también una buena profilaxis antibiótica, antivírica y antifúngica y la terapia de las infecciones secundarias. Por ejemplo, el blindaje consistente del fármaco conduce a una incidencia significativamente menor de aspergilosis pulmonar asociada a COVID-19 [4]. Las inmunoglobulinas intravenosas (IGIV) también pueden y deben utilizarse en casos de deficiencia secundaria demostrada de inmunoglobulinas. Actualmente no está claro si debe suspenderse la inmunosupresión ante la enfermedad COVID-19 y debe decidirse de forma individual. En general, el tratamiento de este grupo de pacientes especialmente vulnerables debe individualizarse y orientarse estrechamente a la inmunosupresión y al título de anticuerpos.
En cuanto a la terapia específica de la COVID-19, al igual que en los pacientes no hematológicos, se utilizan sobre todo el antiviral Remdesivir, la Dexametasona y el Tocilizumab. Cada vez más, el tratamiento mediante terapia pasiva con anticuerpos también está cobrando importancia. Esto desempeña un papel cada vez más importante sobre todo en los pacientes seronegativos – y los pacientes inmunodeprimidos y los afectados por neoplasias hematológicas suelen pertenecer a este grupo. Mientras tanto, existen algunos estudios sobre la combinación de los principios activos casirivimab e imdevimab, también conocida como REGEN-COV. Como alternativa, puede utilizarse plasma convaleciente, aunque actualmente no existen estudios positivos en pacientes inmunodeprimidos. En cualquier caso, el tratamiento precoz en los 3-5 días siguientes a la aparición de los síntomas es el más prometedor. El uso en pacientes de alto riesgo como parte de una profilaxis postexposición -por ejemplo tras un brote nosocomial- es concebible y se está investigando actualmente. En un estudio correspondiente, este procedimiento mostró una reducción del riesgo del 83% cuando se utilizaba en una fase temprana, y se está tramitando su aprobación ante la Administración de Alimentos y Medicamentos de EE.UU. [5]. Especialmente en pacientes de alto riesgo, como los que reciben una terapia de depleción de células B, el uso de un tratamiento con anticuerpos aún puede considerarse más adelante en el curso de la enfermedad si existe la sospecha de que la producción propia del paciente es insuficiente. Así lo recomienda el STAKOB alemán (Grupo de Trabajo Permanente de Centros de Competencia y Tratamiento de Enfermedades Causadas por Patógenos Altamente Patógenos), especialmente si la carga viral es elevada. Además, según la STAKOB, deben tomarse anticuerpos antipúas y no es necesario esperar el resultado. Con la terapia de anticuerpos, no debe descuidarse el riesgo de reacciones alérgicas; es necesario un estrecho control clínico con un periodo de seguimiento de al menos una hora.
En cuanto a la eficacia de REGEN-COV, se observan ciertas lagunas tanto en la variante sudafricana como en la brasileña y escocesa. Por otro lado, el sotrovimab (VIR-7831), más reciente, parece ser plenamente eficaz también en este caso. Con la continua aparición de nuevas variantes, es probable que los médicos y la industria farmacéutica se enfrenten a algunos retos. Es importante mantener una estrecha vigilancia en todas las fases de la pandemia y mantenerse al día a nivel individual. Es la única manera de garantizar la mejor atención posible.
Vacunar, vacunar, vacunar
También en el contexto de la vacunación, la aparición de nuevas variantes está siempre en el punto de mira, con preocupaciones sobre la eficacia de la inmunización activa que no pueden descartarse sin más. Esto varía entre las diferentes variantes del virus. Y aquí también los afectados por enfermedades hematológicas constituyen un caso especial. Por ejemplo, un análisis de 88 pacientes tras un trasplante de células madre hematopoyéticas que habían recibido la vacunación con ARNm mostró que el 41% no desarrollaron una protección vacunal suficiente [6]. La respuesta a la vacunación fue especialmente pobre si la inmunosupresión se había llevado a cabo en los últimos tres meses, el trasplante había tenido lugar menos de un año antes y el recuento de linfocitos era <1 G/L – todos ellos factores ya conocidos de otras vacunaciones.
Pero incluso con una respuesta de vacunación demostradamente más pobre, los expertos de la conferencia anual estuvieron de acuerdo: la vacunación sigue siendo la medida de prevención más importante – y la baja tasa de vacunación el mayor problema. Porque aunque la protección de la vacunación sea menor en los pacientes inmunodeprimidos, la vacunación no hace daño. También se recomienda antes, durante o después de la terapia hemato-oncológica, independientemente del tipo de tratamiento. Dado que la protección no sólo está mediada por las células B, sino también por las células T, ni siquiera el agotamiento de las células B y la terapia de altas dosis con trasplante de células madre hematopoyéticas son contraindicaciones absolutas según las directrices Onkopedia actualmente vigentes [7]. Sin embargo, la respuesta a la vacunación es mayor cuanto mayor es el intervalo de tiempo transcurrido desde el trasplante de células madre hematopoyéticas. Por lo tanto, teniendo en cuenta la situación infecciosa, puede estar justificado un enfoque de esperar y ver.
Actualmente hay puestas grandes esperanzas en la tercera dosis de vacuna, que debería aumentar la respuesta y la duración de la respuesta de vacunación. En el caso de los pacientes con trasplantes de órganos, ya se ha demostrado que esto tiene un efecto duradero en la respuesta inmunitaria [8]. El riesgo de cursos graves en la población general también puede reducirse significativamente con la tercera dosis, según datos israelíes [9]. Según los datos, esta cifra se multiplica por 19,5 en las personas mayores de 60 años sin vacunación de refuerzo. El Prof. Wendtner sospecha que este efecto también se notará en los pacientes con neoplasias hematológicas. En un estudio con pacientes tras un trasplante alogénico de células madre, se demostró una mejora significativa de la respuesta a la vacunación con la tercera vacunación. Sin embargo, el 22% de los participantes en el estudio no alcanzaron una respuesta de vacunación suficiente [10]. Según el Prof. Wendtner, dependiendo de la situación, una vacunación de refuerzo ya es posible después de 3-4 meses, una administración simultánea con la vacunación antigripal no es problemática y es una opción. La tercera vacunación debe realizarse siempre con un agente basado en ARNm, incluso si antes se ha utilizado una vacuna vectorial. El experto también aconseja un seguimiento de bajo umbral de la respuesta a la vacunación en pacientes hematológicos y oncológicos para tranquilizar a pacientes y profesionales.
Fuente: Conferencias “COVID 19 en enfermedades hematológicas” por Clemens-Martin Wendtner y “COVID-19 en receptores de células madre alogénicas” por Eduard Schulz en el simposio científico “COVID 19 – Parte 1”. Reunión anual de las sociedades alemana, austriaca y suiza de hematología y oncología médica, 02.10.2021, Berlín (D).
Literatura:
- Williamson EJ, et al: Factores asociados a la muerte relacionada con COVID-19 utilizando OpenSAFELY. Naturaleza 2020; 584(7821): 430-436.
- Kiani A, et al: Los parámetros de laboratorio previos a la infección pueden predecir la gravedad del COVID-19 en pacientes tumorales. Cancer Med 2021; 10(13): 4424-4436.
- Avanzato VA, et al.: Case Study: Prolonged Infectious SARS-CoV-2 Shedding from an Asymptomatic Immunocompromised Individual with Cancer. Cell 2020; 183(7): 1901-1912.e9.
- Hatzl S, et al: Profilaxis antifúngica para la prevención de la aspergilosis pulmonar asociada a COVID-19 en pacientes críticos: un estudio observacional. Cuidados Intensivos 2021; 25(1): 335.
- O’Brien MP, et al: Combinación subcutánea de anticuerpos REGEN-COV para prevenir la Covid-19. N Engl J Med 2021; 385(13): 1184-1195.
- Redjoul R, et al: Respuesta de anticuerpos tras la segunda dosis de BNT162b2 en receptores de HSCT alogénico. Lancet 2021; 398(10297): 298-299.
- Lilienfeld-Toal M, et al: Infección por coronavirus (COVID-19) en pacientes con trastornos sanguíneos y cáncer – Directriz de Onkopedia. Estado Abril de 2021. www.onkopedia.com/de/onkopedia/guidelines/coronavirus-infektion-covid-19-bei-patient-innen-mit-blut-und-krebserkrankungen/@@guideline/html/index.html.
- Kamar N, et al: Tres dosis de una vacuna de ARNm Covid-19 en receptores de trasplantes de órganos sólidos. N Engl J Med 2021. 385: 661-662.
- Bar-On YM, et al: Protección del refuerzo de la vacuna BNT162b2 contra el Covid-19 en Israel. N Engl J Med 2021; 385(15): 1393-1400.
- Redjoul R, et al: Respuesta de anticuerpos tras la tercera dosis de BNT162b2 en receptores de HSCT alogénico. Lancet Haematol 2021; 8(10): e681-e683.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(6): 23-24 (publicado el 8.12.21, antes de impresión).