Un niño con una citopenia poco clara y síntomas adicionales como fiebre, linfadenopatía o hepatoesplenomegalia debe ser derivado generosa y rápidamente a un centro. La hiperleucocitosis, el síndrome de lisis tumoral y el tumor mediastínico son complicaciones potencialmente mortales en la fase inicial de esclarecimiento y terapia. La tasa de supervivencia es superior al 80% para la leucemia linfoblástica aguda (LLA) y al 60% para la leucemia mieloide aguda (LMA). En este caso, la respuesta precoz a la terapia y la citogenética de los blastos son determinantes para el pronóstico; en el caso de la LLA, también lo son la edad, el recuento de leucocitos y el inmunofenotipo. Los supervivientes a largo plazo de la leucemia infantil tienen un riesgo significativamente mayor de sufrir efectos tardíos neuropsicológicos, endocrinológicos, metabólicos y cardíacos, así como segundos tumores.
La leucemia infantil aguda es un ejemplo impresionante de la historia de éxitos de la hematología y la oncología pediátricas en los últimos 40 años. La leucemia infantil aguda, por ejemplo, ha pasado de ser una enfermedad casi siempre letal en los años 60 a una enfermedad que ahora es frecuentemente curable con una tasa de supervivencia a largo plazo superior al 80%. La historia del tratamiento de la leucemia muestra la importancia de los ensayos clínicos aleatorios, que constituyen la base de la mejora continua del tratamiento de la leucemia. En el futuro, los nuevos conocimientos sobre la biología de las células leucémicas permitirán una terapia más específica y adaptada al riesgo [1].
Epidemiología
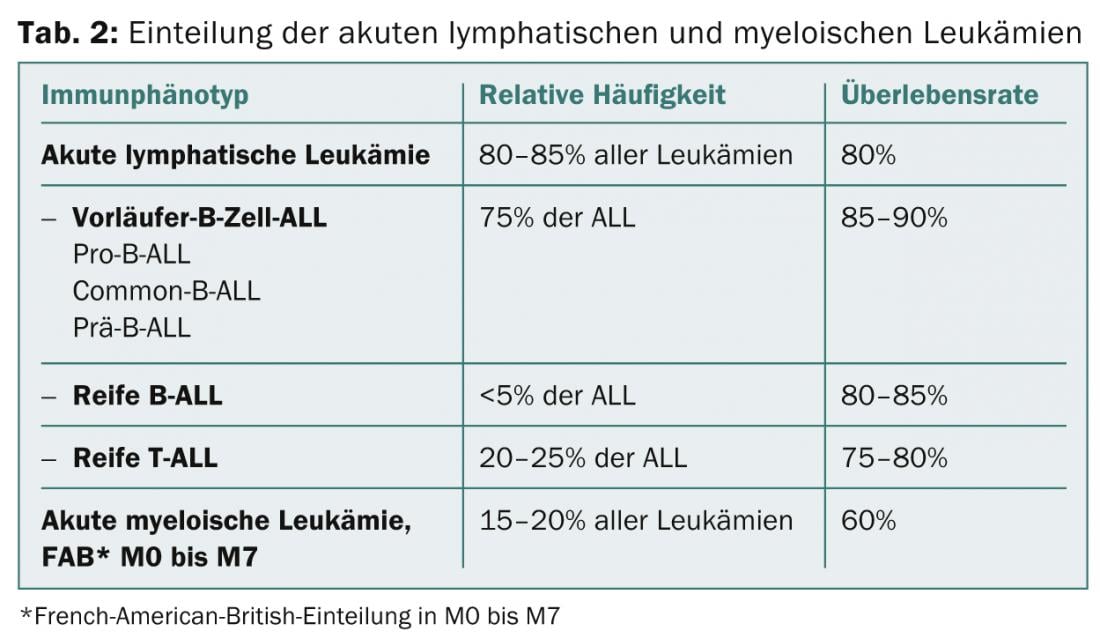
En Suiza, entre 50 y 60 niños (de 0 a 14 años) desarrollan leucemia aguda cada año (incidencia 5/100.000 habitantes) [2]. La leucemia aguda es la enfermedad maligna más frecuente de la infancia (30%) y se divide en un 80% en leucemia linfoblástica aguda (LLA) con LLA de células B y T y un 20% en leucemia mieloide aguda (LMA). Los pacientes con LLA tienen una tasa de supervivencia a largo plazo del 80% y los pacientes con LMA del 55 – 60%. Los niños se ven afectados con algo más de frecuencia que las niñas. La distribución por edades muestra un pico de frecuencia entre el segundo y el quinto año de vida para la LLA y en el primer y segundo año de vida y a partir de la adolescencia para la LMA [1].
Presentación clínica
En la leucemia aguda, la expansión clonal de células progenitoras hematopoyéticas inmaduras en la médula ósea provoca el desplazamiento de la hematopoyesis normal. Esta insuficiencia de la médula ósea provoca anemia, neutropenia y trombocitopenia con los síntomas que se enumeran a continuación (Tab. 1 ). Además, la infiltración leucémica de la médula ósea puede provocar una hiperleucocitosis y una coagulopatía potencialmente mortales. Además, pueden infiltrarse diversos órganos como el hígado, el bazo, los ganglios linfáticos, el timo, los testículos, la piel/mucosa y el SNC (Tab. 1 ) [3]. La mayoría de las veces, los síntomas persisten durante unos días o semanas.
Diagnóstico y clasificación
Si existe una sospecha clínica de leucemia aguda (véanse los síntomas Tab. 1) Un pediatra colegiado o un médico general debe realizar un hemograma. Si el hemograma muestra monocitopenia, bicitopenia o tricitopenia y/o leucocitosis, el niño debe ser derivado generosa y rápidamente a una clínica pediátrica especializada si es posible.

Aquí, tras los diagnósticos iniciales para la detección precoz de un síndrome de lisis tumoral o una masa mediastínica (hemograma diferencial con diferenciación microscópica, valores hepáticos, renales, electrolitos, ácido úrico, LDH, coagulación y radiografía de tórax), se inician los siguientes exámenes específicos de leucemia en la médula ósea (aspiración de médula ósea y biopsia).
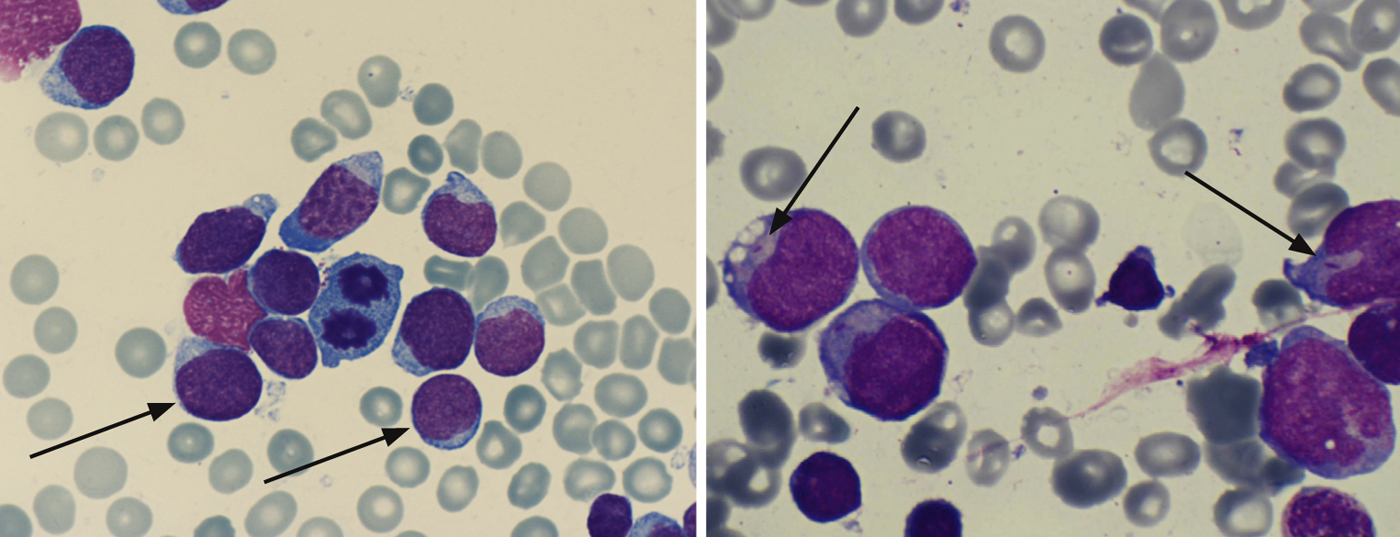
Citología/morfología: Aquí se evalúa la médula ósea bajo un microscopio óptico en lo que respecta a su morfología. Por definición, la LLA tiene ≥ 25 y la LMA ≥ 30% de blastos en la médula ósea. Las tinciones citoquímicas adicionales (mieloperoxidasa, fosfatasa ácida, etc.) pueden dar indicaciones iniciales de los tipos de leucemia (Tab. 2; Figs. 1 y 2) .
Los bastones de Auer demuestran la existencia de LMA y son una expresión del trastorno de maduración de la célula leucémica (Fig. 2).
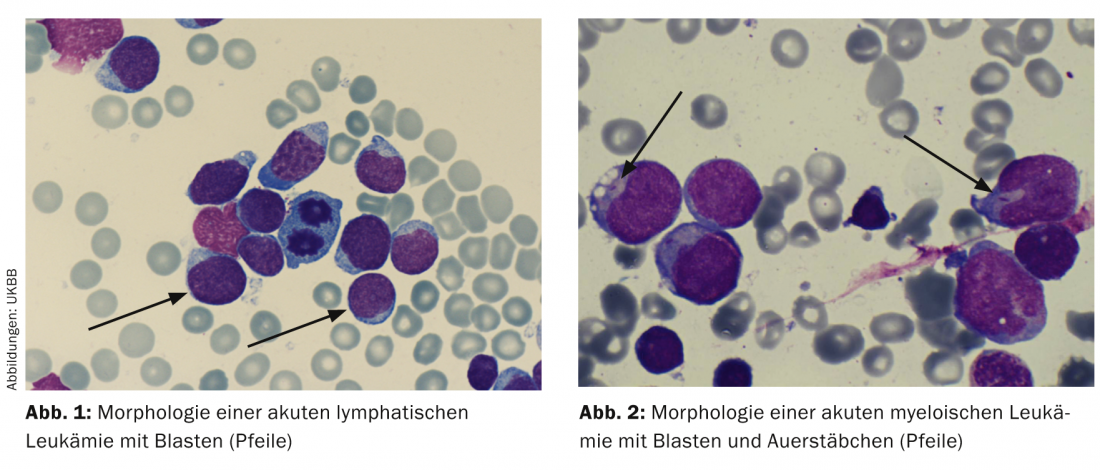
Inmunofenotipado: A partir de los marcadores de superficie específicos de los blastos leucémicos, las células leucémicas se caracterizan mediante inmunofenotipado por citometría de flujo en función de su madurez y su afiliación a la serie de células B o T o a la serie mieloide (Tab. 2).
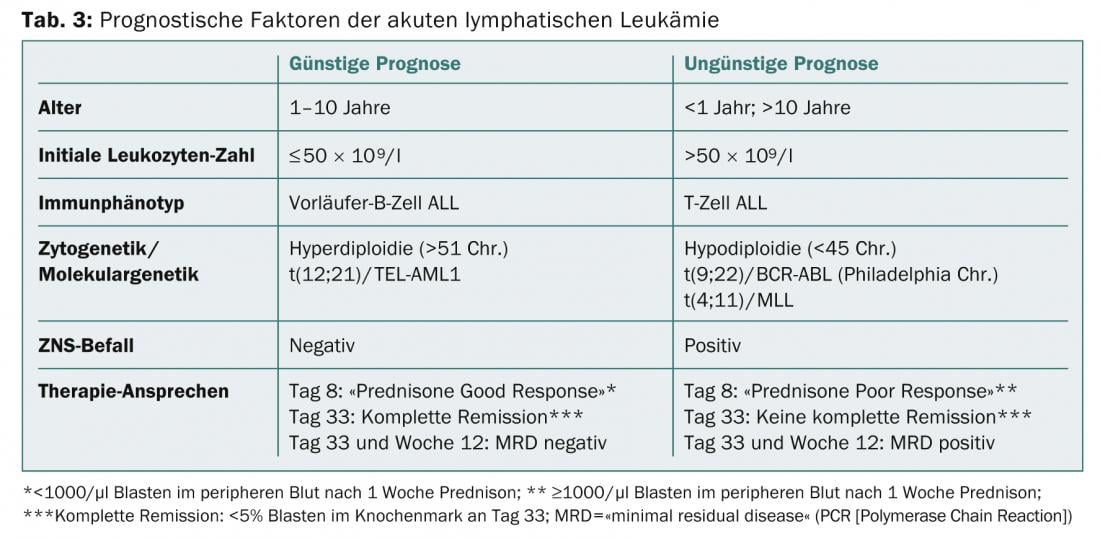
Citogenética y genética molecular: Además, las leucemias agudas pueden caracterizarse en función de las aberraciones cromosómicas de los blastos y dividirse en diferentes grupos de riesgo. Pronósticamente favorables en la LLA-B son, por ejemplo, la hiperdiploidía y la translocación t(12;21)(p13;q21) con el gen de transfusión TEL-AML1; pronósticamente desfavorables son la hipodiploidía y la translocación t(9;22)(q34;q11) (= cromosoma Filadelfia) con el gen de transfusión BCR-ABL (Tab. 3) .
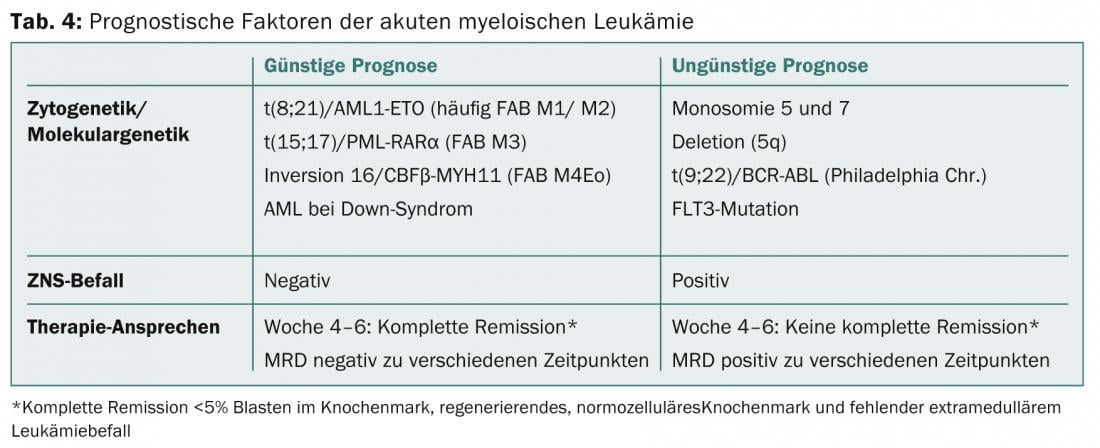
En el diagnóstico de la LMA, la detección de las translocaciones t(8;21) y t(15;17) o la detección de la inversión 16 suponen un pronóstico más favorable, mientras que la detección de la monosomía 5 o 7 se asocia a un mal pronóstico (Tabla 4) [1,4,5].
Terapia
Como ya se ha mencionado, el pronóstico de la leucemia infantil aguda ha mejorado de forma impresionante en los últimos 40 años. En primer lugar, se identificó el sistema nervioso central como lugar frecuente de recidiva y se inició un tratamiento profiláctico del SNC. Por otro lado, se desarrollaron protocolos de quimioterapia complejos y adaptados al riesgo. Además, la terapia de apoyo ha mejorado significativamente, por lo que la morbilidad y la mortalidad asociadas a la terapia han disminuido [1].
Hoy en día, la terapia para la LLA infantil consiste en la poliquimioterapia, que incluye esteroides así como otros agentes quimioterapéuticos (metotrexato, vincristina, asparaginasa, citarabina, ciclofosfamida, antraciclinas, 6-mercaptopurina). Un niño con LLA recién diagnosticada comienza con quimioterapia de inducción, en la que se administra una combinación de cinco a seis agentes quimioterapéuticos durante cinco semanas con el objetivo de minimizar la carga de células leucémicas hasta un nivel que ya no sea clínica ni hematológicamente detectable. La inducción va seguida de quimioterapia de consolidación para tratar el compartimento extramedular (SNC y testículo). Consiste en la administración intratecal y sistémica de altas dosis de metotrexato, que pretende prevenir las recidivas en el SNC y sustituye a la irradiación preventiva del SNC que solía realizarse de forma rutinaria. La quimioterapia de reinducción concluye entonces la fase de tratamiento inicial intensivo al cabo de unos seis meses. Gran parte de las fases de quimioterapia intensiva pueden realizarse en régimen ambulatorio. Posteriormente, se administra quimioterapia de mantenimiento ambulatoria con 6-mercaptopurina y metotrexato durante otros 18 meses.
El trasplante de células madre hematopoyéticas (TCMH) se utiliza en pacientes pediátricos con un perfil de alto riesgo (mala respuesta a la terapia, genética molecular de pronóstico desfavorable, recaída) y un donante adecuado. La irradiación del SNC está indicada si se detectan inicialmente células leucémicas en el líquido cefalorraquídeo [5].
El parámetro pronóstico más importante en el tratamiento de la leucemia infantil es la respuesta a la terapia. Una reducción de los blastos en la sangre periférica a <1000/µl tras una semana de tratamiento con esteroides (día 8), una remisión hematológica completa con <Un 5% de blastos en el frotis de médula ósea al final de la inducción (día 33) y un valor negativo de MRD (“enfermedad mínima residual” por PCR) en el día 33 y en la semana 12 son los predictores más fuertes de la supervivencia libre de recaída (Tab. 3) [5].
En el tratamiento de la LMA infantil, es necesaria una poliquimioterapia muy intensiva consistente en bloques cortos de quimioterapia con antraciclinas, citarabina, etopósido, 6-tioguanina y posiblemente ATRA (“ácido todo-trans-retinoide”) [3]. La quimioterapia comienza con la inducción, seguida de la consolidación y la intensificación, y termina con aproximadamente un año de quimioterapia de mantenimiento con 6-tioguanina y citarabina. Además, se lleva a cabo una terapia extramedular con metotrexato intratecal, citarabina y prednisona a intervalos regulares [6].
Según el estado actual de los estudios internacionales, hoy en día se prescinde de la irradiación craneal preventiva [6,7]. Los pacientes con citogenética desfavorable, una mala respuesta a la terapia o una recaída cumplen los requisitos para un TCMH [6].
Al igual que en la LLA, la respuesta a la terapia también es un factor pronóstico decisivo en la LMA. La remisión en la LMA se define con<5% de blastos en la médula ósea, médula ósea normocelular en regeneración y sin evidencia de leucemia extramedular. Esto suele lograrse tras cuatro a seis semanas de terapia de inducción [4].
Complicaciones
Un efecto secundario importante y frecuente asociado al tratamiento de la leucemia es la mielotoxicidad inducida por la quimioterapia con pancitopenia. Conduce, a través de la neutropenia, a una mayor tendencia a las infecciones con fiebre en neutropenia, infecciones bacterianas, fúngicas y víricas, que a menudo requieren hospitalización. También existe un mayor riesgo de infecciones oportunistas (Pneumocystis jirovecii), por lo que se administra profilaxis antibiótica con trimetoprim-sulfametoxazol. Además, se producen anemia y trombocitopenia, por lo que pueden ser necesarias transfusiones regulares. Además de la médula ósea, también resultan dañadas otras series celulares con un alto índice de división. En consecuencia, se produce una mucositis enoral y gastrointestinal debida al daño de las mucosas y una alopecia debida al daño de los folículos pilosos. Las náuseas y los vómitos también son efectos secundarios comunes que suelen tratarse bien con antieméticos. Además, existen muchos efectos secundarios específicos de los fármacos, aunque menos frecuentes.
Efectos tardíos
Con el aumento de la tasa de supervivencia de los niños que desarrollan leucemia aguda, también aumenta el número de antiguos pacientes de cáncer infantil con efectos tardíos debidos a la enfermedad y al tratamiento [1]. Entre ellos se incluyen problemas neurológicos, endocrinológicos, metabólicos y cardíacos, así como segundos tumores.
Los efectos tardíos neurológicos incluyen déficits neuropsicológicos, que son principalmente el resultado de la irradiación craneal. Se pudo demostrar que la sustitución de la irradiación craneal profiláctica por quimioterapia intratecal conllevaba una reducción de los efectos tardíos neuropsicológicos [8]. Los problemas neuropsicológicos incluyen dificultades en aritmética, memoria verbal a corto plazo, funciones ejecutivas, atención y concentración.
Los efectos tardíos endocrinológicos y metabólicos afectan principalmente a los niños con irradiación craneal e incluyen deficiencia de la hormona del crecimiento, disfunción tiroidea, retraso puberal o pubertas praecox y síndrome metabólico. Los trastornos de la fertilidad se observan casi exclusivamente en pacientes trasplantados.
Debido a las dosis acumulativas relativamente altas de antraciclinas, especialmente en el tratamiento de la LMA, la miocardiopatía dilatada puede aparecer al cabo de años o décadas como una consecuencia cardiaca tardía.
La irradiación craneal aumenta el riesgo de desarrollar tumores cerebrales secundarios benignos y malignos (meningiomas, gliomas), así como adenomas o carcinomas tiroideos. Los pacientes tras quimioterapia exclusiva tienen un mayor riesgo de sufrir síndromes mielodisplásicos o LMA secundaria como expresión de la degeneración premaligna o maligna de la médula ósea inducida por la quimioterapia [1].
Dra. Christina Schindera
Literatura:
- Orkin S, et al: Leucemia linfoblástica aguda y leucemia mieloide, mielodisplasia y enfermedad mieloproliferativa en niños. Oncología de la infancia y la niñez 2009; 297-402. Saunders Elevier.
- Kuehni C: Registro suizo de cáncer infantil, Informe anual 2011/2012. 2013 www.kinderkrebsregister.ch/fileadmin/KKR08/uploads/pdf/AnnualReport_SCCR_2011_2012_FINAL.pdf.
- Bailey S, Skinner R: Manuales del especialista Oxford en pediatría: Hematología y oncología pediátricas. 2010. Oxford Medical Publications, Oxford, Reino Unido.
- Creutzig U, Reinhardt D: Estudio multicéntrico de optimización de la terapia AML-BFM 2004. 2010.
- Schrappe M, AIEOP-BFM ALL 2009: Protocolo de tratamiento colaborativo internacional para niños y adolescentes con leucemia linfoblástica aguda. 2013.
- Creutzig U, Dworzak M, Reinhardt D: Leucemia mieloide aguda en la infancia. 2013. %C3%
- Pui CH, Howard SC: Gestión actual y retos de la enfermedad maligna en el SNC en la leucemia pediátrica. Lancet Oncol 2008; 9(3): 257-268.
- Von der Weid N, et al: Resultado intelectual en niños y adolescentes con leucemia linfoblástica aguda tratados sólo con quimioterapia: diferencias relacionadas con la edad y el sexo. Eur J Cancer 2003; 39(3): 359-365.
InFo Oncología y Hematología 2014; 2(5): 4-7