Las inmunoterapias dirigidas pueden utilizarse para la artritis psoriásica (APs), la psoriasis (PsO) y la dermatitis atópica (DA).1-3 Los datos actuales sobre estas opciones de tratamiento de última generación se presentaron en el Congreso anual 2022 de la Academia Americana de Dermatología (AAD) en Boston, Massachusetts, EE.UU..
Las personas con enfermedades inflamatorias crónicas de la piel suelen sufrir no sólo los síntomas físicos y las comorbilidades de su enfermedad, sino también el estrés psicológico asociado. En general, esto va de la mano de una calidad de vida muy reducida.4, 5 Las opciones de tratamiento para las dermatosis inflamatorias, que muestran una gran heterogeneidad en cuanto a evolución y gravedad, se han limitado durante mucho tiempo a los corticosteroides tópicos (TCS) y a la inmunosupresión inespecífica.1 Sin embargo, los avances en la comprensión de la fisiopatología han conducido en los últimos años al desarrollo de productos biológicos e inhibidores de la Janus quinasa (JAKi), que permiten una inmunoterapia dirigida.1-3
Risankizumab en la APs: análisis de los estudios de fase III KEEPsAKE
El inhibidor selectivo de la IL-23 risankizumab (RZB; SKYRIZI®) está aprobado en Suiza desde marzo de 2022 como monoterapia o en combinación con fármacos antirreumáticos modificadores de la enfermedad no biológicos (csDMARDs) para pacientes adultos con APs que hayan tenido una respuesta inadecuada o sean intolerantes a uno o más DMARDs.2 Los estudios pivotales de fase III aleatorizados, doble ciego, controlados con placebo (PBO) KEEPsAKE-1 y KEEPsAKE-2 investigaron la eficacia y tolerabilidad del biológico en pacientes adultos con APs que recibieron dosis subcutáneas de 150 mg de RZB en las semanas 0, 4 y 16. Mientras que KEEPsAKE-1 incluyó sólo a pacientes que habían respondido de forma inadecuada a ≥ 1 csDMARD, KEEPsAKE-2 incluyó también a pacientes con una respuesta inadecuada a ≤ 2 DMARD biológicos (bDMARD).
En KEEPsAKE-1, el 57,3% de los pacientes en tratamiento con RZB y el 33,5% de los pacientes en tratamiento con OBP (p<0,001) alcanzaron el criterio de valoración primario del estudio de al menos un 20% de mejoría según los criterios del Colegio Americano de Reumatología (ACR 20) a las 24 semanas. En KEEPsAKE-2, esto lo consiguieron el 51,3% de los pacientes del grupo RZB y el 26,5% de los pacientes del brazo PBO (p<0,001). En ambos estudios, menos del 1% de los pacientes que recibieron RZB desarrollaron efectos secundarios que provocaron la interrupción del tratamiento.6, 7
En el congreso de la AAD de este año se examinó con más detalle el efecto de la terapia con RZB en la APs sobre los Resultados Comunicados por los Pacientes(PROs). También se presentaron encuestas sobre ladiferencia mínima clínicamente importante (MCID ) conseguida con el tratamiento.
- Mejora de la calidad de vida, la fatiga y la productividad laboral con el RZB 8
Los estudios KEEPsAKE-1 y KEEPsAKE-2 midieron los PRO relacionados con la calidad de vida relacionada con la salud (CVRS), la fatiga y la productividad en el trabajo. Según un análisis conjunto, tanto la CVRS como la fatiga mejoraron significativamente en el grupo RZB en comparación con el grupo PBO en las primeras 24 semanas de tratamiento. Por ejemplo, la diferencia entre los grupos RZB y PBO en EQ-5D-5L* fue de 5,8 ([IC 95%: 3,6-8,0]) y en la puntuación FACIT-Fatiga* fue de 2,5 ([95% KI:1.5-3.4]) (p<0,001 para todas las puntuaciones). Con la RZB, los pacientes con WPAI-PsA* también mostraron menos deterioro laboral, limitaciones de la actividad y presentismo que con la PBO.8
- Los resultados comunicados por los pacientes también mejoraron en los pacientes con afectación cutánea grave 9
Los pacientes de KEEPsAKE-1 y KEEPsAKE-2 que presentaban una afectación cutánea grave con ≥ 3% de superficie cutánea afectada o un índice de área y gravedad de la psoriasis (PASI) > 10 también lograron una mejoría significativa de la actividad de la enfermedad y el dolor percibidos con el tratamiento con RZB en comparación con el PBO, según un análisis integrado de subgrupos de ambos ensayos. La mejora de la calidad de vida tras 24 semanas en comparación con el inicio, medida como SF-36 (PCS* 6,3 [95% KI:4.2-8.4] & MCS* 4,4 [IC 95%: 2,3-6,6; p<0,001]), el índice EQ-5D-5L (0,1 [IC 95%: 0,1-0,2; p<0,001]) y la puntuación VAS* (8,2 [IC 95%: 2,5-13,9; p<0,01]), también fue significativamente mayor bajo tratamiento con RZB que con PBO.9
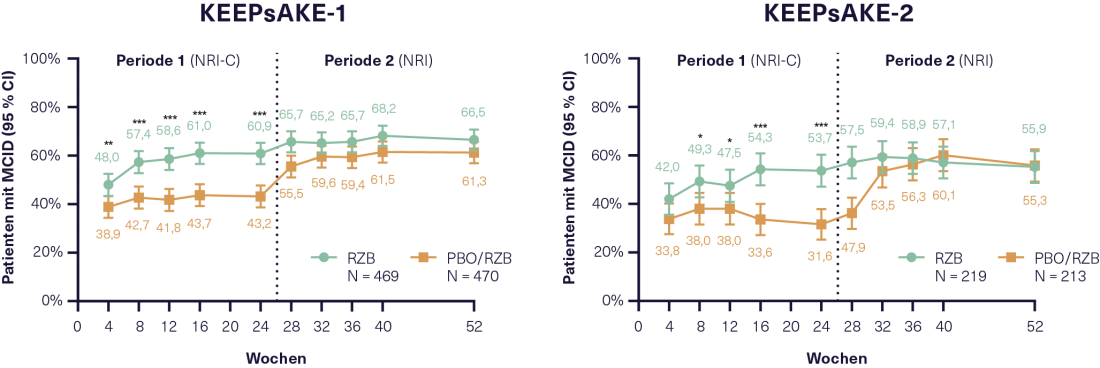
- Alivio del dolor y la inflamación con RZB 10, 11
La eficacia de la RZB sobre la inflamación y el dolor en la APs también fue uno de los temas centrales del Congreso de la AAD. En 1407 pacientes con APs que completaron 24 semanas de tratamiento en KEEPsAKE-1 y KEEPsAKE-2 y participaron en el posterior estudio de extensión abierto, se midió la disminución de la proteína C reactiva (PCR). Esto sugiere una mejora de la inflamación bajo RZB, que también se produjo en los pacientes del grupo PBO una vez que cambiaron al tratamiento con RZB en el estudio de extensión abierto. El dolor en las últimas 24 horas se midió en una escala EVA* horizontal de 100 mm. En ambos ensayos, el doble de pacientes lograron un alivio del dolor del 30% (“significativo”), 50% (“marcado”) y 70% con respecto al valor inicial tanto en RZB como en PBO a las 24 semanas. Una reducción del dolor ≥ 10 mm se clasificó como MCID. Esto se consiguió en KEEPsAKE-1 en un 60,9% y en KEEPsAKE-2 en un 53,7% de los pacientes sometidos a RZB en comparación con el 43,2% y el 31,6% de los pacientes sometidos a OBP, respectivamente (p<0,001 en ambos estudios)(figura 1).10 Además, tras 24 semanas, los pacientes en tratamiento con RZB tenían más probabilidades de alcanzar una MCID en términos de actividad de la enfermedad (PtGA*), fatiga (FACIT-F*), funcionamiento físico (HAQ-DI*) y salud física y mental (SF-36 PCS y MCS*) que los pacientes en tratamiento con PBO.
Los datos mostrados en el Congreso de la AAD subrayan la eficacia clínica del RZB en pacientes con APs e ilustran que los criterios de valoración alcanzados en los ensayos clínicos pivotales KEEPsAKE-1 y KEEPsAKE-2 se traducen directamente en una mejora tangible de la experiencia referida por los pacientes.11
Datos a largo plazo y reales sobre el tratamiento con risankizumab en la PsO
El RZB está aprobado en Suiza desde abril de 2019 para el tratamiento de la PsO en placas de moderada a grave en pacientes adultos que hayan tenido una respuesta inadecuada a otras terapias sistémicas o que presenten una contraindicación o intolerancia a dichas terapias.2 En los ensayos de fase III UltIMMa-1 y UltIMMa-2, aleatorizados, doble ciego y controlados con placebo, los pacientes que recibieron una inyección subcutánea de 150 mg de RZB en las semanas 0, 4, 16, 28 y 40 mostraron una mejor respuesta que los pacientes de los grupos PBO y ustekinumab. Así, el 74,6% de los pacientes sometidos a RZB lograron una respuesta PASI 90. Con ustekinumab, el 47,5% y con PBO el 2% de los pacientes lo consiguieron (p<0,0001). El perfil de seguridad de RZB fue comparable a los perfiles de seguridad de ustekinumab y PBO.12 Otros estudios cara a cara demostraron la eficacia superior del RZB sobre el adalimumab (estudio IMMvent), el secukinumab (estudio IMMerge) y los ésteres de ácido fumárico (NCT03255382) en pacientes con PsO de moderada a grave.13-15 Los datos actuales de la ampliación abierta de estos estudios durante más de 4,5 años hasta la fecha, así como los resultados en el mundo real, se han presentado ahora en el Congreso de la AAD.
- Estudio de ampliación LIMMitless
En el estudio de extensión LIMMitless en curso participaron 897 de los 955 pacientes que habían completado uno de los cinco estudios de referencia mencionados anteriormente. En el momento del análisis actual de 256 semanas, 707 pacientes aún continuaban 12 semanas de tratamiento con 150 mg de RZB. Así se consiguió una eficacia buena y sostenida durante todo el periodo de observación. Así, desde la semana 28 de los estudios basales hasta la semana 256, el 83% de los pacientes en tratamiento con RZB mostraron una respuesta PASI 90 constante y el 52% una respuesta PASI 100 constante(figura 2). La alta eficacia continuada de la RZB también se refleja en una mejora sostenida de la CVRS. Más del 66% de los pacientes tratados con RZB alcanzaron un Índice de Calidad de Vida Dermatológica (DLQI) 0/1 ya 16 semanas después del inicio de los estudios de referencia, lo que significa que apenas sufrieron una reducción de su calidad de vida debido a la enfermedad. Esta condición fue mantenida por el 75% de los pacientes durante el estudio LIMMitless. No se produjeron nuevas señales de seguridad ni casos de infección por Candida, enfermedad inflamatoria intestinal o tuberculosis activa con el RZB durante una duración de exposición de 4.453 pacientes-año en un periodo de observación de hasta 304 semanas. En general, el tratamiento resultó ser bien tolerado.16
- Buena respuesta al RZB incluso en condiciones reales 17, 18
Que el RZB también se asocia a una buena respuesta en la PsO en condiciones reales queda patente en el análisis presentado en el Congreso de la AAD de los datos de 205 pacientes con PsO de moderada a grave del Registro de Psoriasis CorEvitas de EE.UU. y Canadá que habían recibido 150 mg de RZB durante 12 meses (+/-3 meses). Los pacientes padecían PsO desde hacía una media de 16,7 años, tenían en su mayoría mucho sobrepeso y en el 61,0% de los casos habían sido pretratados con biológicos e inmunomoduladores. Tras 12 meses, el tratamiento con RZB mostró una buena eficacia frente a los objetivos de tratamiento orientados al paciente definidos por la Fundación Nacional de Psoriasis (NPF)(Treat-to-Target Skin Clearance Goals). El 89,2% de los pacientes lograron una respuesta aceptable a la NPF, definida como un 3% o menos de superficie corporal afectada (BSA ≤ 3%), o una mejora de la BSA del 75% desde el inicio. El 70,4% de los pacientes en tratamiento con RZB alcanzaron la respuesta objetivo de la NPF de BSA ≤ 1%. El logro de los objetivos de tratamiento definidos por la NPF fue independiente del pretratamiento: el 94,8% y el 85,5% de los pacientes sin tratamiento biológico y con tratamiento biológico, respectivamente, lograron una respuesta aceptable de la NPF y el 81,8% y el 62,4%, respectivamente, lograron una respuesta objetivo de la NPF.17
La mayoría de los pacientes también consiguieron una piel sin síntomas o casi sin síntomas con el tratamiento continuo con RZB: las puntuaciones PASI, de la Evaluación Global del Investigador (IGA) y de la BSA mejoraron un 86,4%, un 71,9% y un 88,0% respectivamente a lo largo de 12 meses (p<0,001 todos los valores). La mejoría de las lesiones cutáneas se acompañó de mejoras en la fatiga, el dolor, el picor, la calidad de vida y la limitación del trabajo y la actividad. Las puntuaciones VAS* para la fatiga y el dolor se redujeron en un 38,0% y un 75,1% respectivamente. La puntuación de la EAV para el picor disminuyó un 69,9% (p<0,001 todos los valores). Los pacientes declararon significativamente menos limitaciones en el trabajo según el cuestionario WPAI. Además, más de dos tercios de los pacientes (66,7%) alcanzaron un DLQI 0/1 tras 12 meses de tratamiento con RZB.18
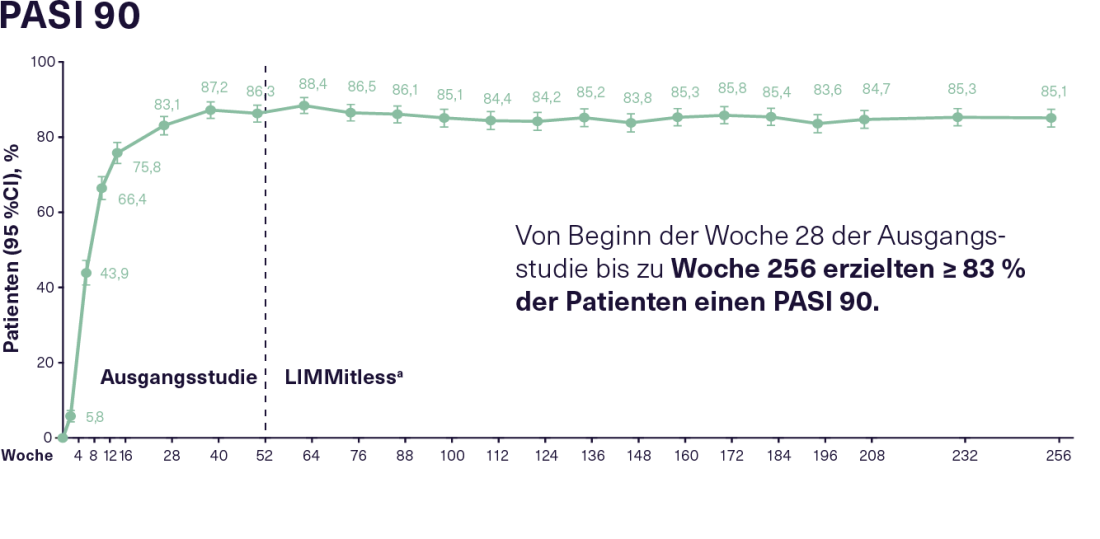
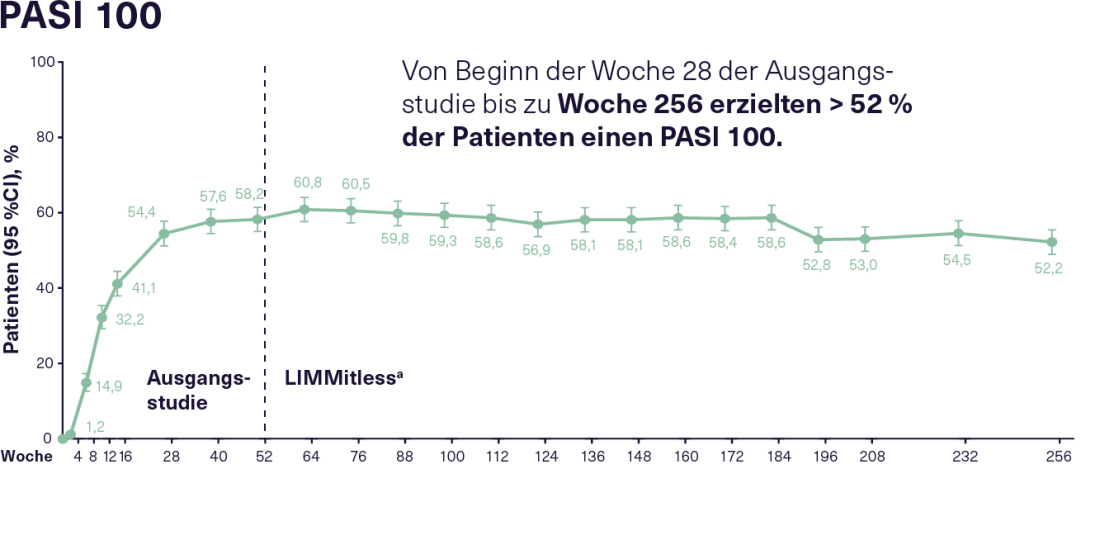 Figura 2: Respuesta PASI 90 y PASI 100 en pacientes con PsO de moderada a grave que recibieron tratamiento continuo con RZB durante un total de 256 semanas en el estudio de extensión abierto LIMMitless. N= 897 de la semana 0 a la semana 256 (mNRI, modified non-responder imputation). RZB: 150 mg cada 12 semanas; PASI 90/100: mejora del 90/100% en el Índice de Área y Gravedad de la Psoriasis; PsO: Psoriasis. a Debido a las diferencias en la duración de los estudios de referencia, algunos pacientes pasaron al estudio LIMMitless antes de las 52 semanas. Adaptado después de 16.
Figura 2: Respuesta PASI 90 y PASI 100 en pacientes con PsO de moderada a grave que recibieron tratamiento continuo con RZB durante un total de 256 semanas en el estudio de extensión abierto LIMMitless. N= 897 de la semana 0 a la semana 256 (mNRI, modified non-responder imputation). RZB: 150 mg cada 12 semanas; PASI 90/100: mejora del 90/100% en el Índice de Área y Gravedad de la Psoriasis; PsO: Psoriasis. a Debido a las diferencias en la duración de los estudios de referencia, algunos pacientes pasaron al estudio LIMMitless antes de las 52 semanas. Adaptado después de 16. |
Seguridad a largo plazo del risankizumab en la PsO y la PsA19 El mayor y más largo registro de seguridad de RZB hasta la fecha incluye 3197 pacientes con PsO y 1542 pacientes con PsA, para un total de 9982,6 y 1594,9 pacientes-año (PY), respectivamente. Se produjeron tasas comparativamente bajas de acontecimientos adversos en ambos grupos de pacientes. La frecuencia de acontecimientos adversos relacionados con el tratamiento fue de 158,3 y 160,8 casos por 100 PY en las poblaciones de PsO y PsA, respectivamente. Los acontecimientos adversos graves se produjeron 7,6 y 8,4 veces en 100 PY, respectivamente, y los acontecimientos adversos que provocaron la interrupción del estudio se produjeron 1,9 y 2,3 veces en 100 PY, respectivamente. Las tasas de infecciones graves, neoplasias malignas y acontecimientos cardiovasculares adversos graves (MACE) en pacientes con PsO y PsA estaban dentro de las tasas de referencia para las poblaciones respectivas. Los acontecimientos adversos más frecuentes en ambos grupos fueron las infecciones, especialmente la nasofaringitis, con 14,5 y 7,9 casos en 100 PY, respectivamente, y las infecciones de las vías respiratorias superiores, con 7,8 y 5,6 casos en 100 PY, respectivamente.19 |
Actualizaciones sobre el upadacitinib en la EA
El inhibidor oral de JAK upadacitinib (UPA; RINVOQ®) actúa específicamente sobre JAK1 y mucho menos sobre JAK2, JAK3 o TYK2. El principio activo está indicado en la dosis oral de 15 mg una vez al día desde noviembre de 2021 para el tratamiento de adultos con EA de moderada a grave cuando la terapia con medicamentos tópicos convencionales no proporciona un control adecuado de la enfermedad o no puede utilizarse.3 Los estudios pivotales de fase III, aleatorizados, doble ciego y controlados con placebo MEASURE Up-1 y MEASURE Up-2 investigaron la eficacia y tolerabilidad de 15 mg de AUP una vez al día como monoterapia. Después de 52 semanas, en un análisis integrado de los dos ensayos, el 80,6% de los pacientes que recibieron 15 mg de UPA mostraron una respuesta EASI* 75 y el 62,0% una respuesta EASI 90.20 Además, se observó una respuesta rápida a la UPA: tras sólo dos días, un número significativamente mayor de pacientes informaron de un alivio significativo del picor con UPA que con PBO.21 En el Congreso de la AAD, se presentó el análisis de los datos de MEASURE Up-1 y MEASURE Up-2 utilizando el concepto de “tratar para alcanzar el objetivo”, basado en la evidencia y recientemente desarrollado.
- El concepto de trato al objetivo 22
Utilizando el concepto “tratar hasta el objetivo”, que integra mejoras en diversos parámetros de la EA relacionados con el aspecto de la piel, el picor y la calidad de vida23 , se analizó a un total de 1299 pacientes adultos con EA de MEASURE Up-1 y MEASURE Up-2, incluyendo una puntuación EASI de > 7, un DLQI > 5 y un marcado picor (WP-NRS* > 4) presentaban síntomas graves. La respuesta inicial aceptable (reducción PGIS-5* ≥ 1 en comparación con el valor basal y una respuesta EASI 50, una reducción SCORAD* del 50% o reducciones en la puntuación WP-NRS, DLQI o POEM* en ≥3, ≥4 y ≥4 en comparación con el valor basal) y se evaluó la respuesta objetivo óptima a los 6 meses (valor absoluto PGIS-5 ≤ 2 y una respuesta EASI 75, una reducción del 75% del valor SCORAD o valores absolutos WP-NRS, DLQI o POEM de ≤4, ≤5 y ≤7, respectivamente). El 79,2% y el 72,4% de los pacientes que recibieron 15 mg de UPA alcanzaron la respuesta objetivo aceptable inicial a los 3 meses en la semana 2 y en la semana 16 de tratamiento, respectivamente. El objetivo más estricto de respuesta óptima a los 6 meses también fue alcanzado por la clara mayoría de los pacientes en tratamiento con AUP a las 2 semanas y en porcentajes similares a las 16 semanas(figura 4). La respuesta rápida y sostenida al tratamiento con UPA quedó demostrada en detalle por el hecho de que el 95% de los pacientes ya había alcanzado ≥ 1 criterio de respuesta objetivo aceptable a los 3 meses al cabo de 2 semanas y alrededor del 80% de los pacientes había alcanzado ≥ 1 criterio de respuesta objetivo óptimo a los 6 meses (p<0,0001 en comparación con la PBO).22
Conclusión
Los pacientes pueden beneficiarse de la buena eficacia y seguridad de las inmunoterapias dirigidas utilizadas en la PsA, la PsO y la EA.2, 3 Esto es evidente en los resultados objetivos de los estudios, pero también en los resultados comunicados por los pacientes y en los datos de los análisis del mundo real.
*Abreviaturas:
EQ-5D-5L = medida EuroQoL 5 dimensiones
FACIT-Fatiga = Evaluación funcional de la terapia de enfermedades crónicas-Fatiga
WPAI-PsA = Productividad laboral y deterioro de la actividad – cuestionario PsA
SF-36 = Encuesta de salud de formato corto de 36 ítems
PCS/ MCS = Resumen de componentes físicos/mentales
EAV = Escala analógica visual
HAQ-DI = Cuestionario de evaluación de la salud-Índice de discapacidad
PtGA = Evaluación global de la actividad de la enfermedad por el paciente
EASI = Índice de área y gravedad del eczema
WP-NRS = Escala de valoración numérica del peor prurito
PGIS-5 = Impresión global de gravedad del paciente
SCORAD = Puntuación de la dermatitis atópica
POEM = Medida del Eccema Orientada al Paciente
Literatura
Los profesionales pueden solicitar las referencias en medinfo.ch@abbvie.com.
Texto: Dr. sc. nat. Katja Becker
Este texto ha sido elaborado con el apoyo financiero de AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Contribución en línea desde el 21.07.2022
CH-SKZD-220096_06/2022