En la Gran Puesta al Día de la SGIM en Interlaken, se debatieron los problemas y retos más comunes a los que se enfrentan los médicos de cabecera cuando tratan a pacientes con linfoma. Es difícil dar nombres significativos: ¿cómo nombrar las más de 70 entidades de linfomas malignos para que siga siendo comprensible para el paciente y sus familiares? El diagnóstico y el seguimiento también son responsabilidad del médico de atención primaria.
El Prof. Dr. med. Andreas Lohri, del Hospital Cantonal de Basellandia, abrió su presentación con datos epidemiológicos: “Los registros suizos de cáncer contabilizan unos 1.600 linfomas malignos al año, un buen tercio de los casos terminan fatalmente. Esto hace que los linfomas sean en conjunto uno de los tipos de cáncer más extendidos, pero si nos atenemos a la clasificación de la OMS, este grupo se divide en más de 70 entidades diferentes”.
Más del 70% de los pacientes con linfoma de Hodgkin están libres de enfermedad al cabo de diez años; en el caso de los linfomas de células B, que son los más frecuentes, la cifra es del 40%, y en el de las variantes de células T, sólo del 20%. Entre 2001 y 2010, hubo un total de 16.000 nuevos casos de linfoma, de los cuales unos 6.000 pacientes sobrevivieron a la enfermedad.
“Si quiere nombrar la entidad concreta, se hace difícil. Mientras que en el caso del linfoma de Hodgkin sigue estando relativamente claro, el médico de cabecera no suele saber qué nombre darle al linfoma difuso de células B grandes (DLBCL), por ejemplo, para que la enfermedad sea también comprensible para el paciente y sus familiares. Suele recurrir entonces al término, en realidad obsoleto, de “linfoma no Hodgkin”. Por ello, la organización suiza de pacientes de linfoma y sus familiares proporciona al paciente información específica sobre los doce linfomas más comunes, incluidos los nombres”, afirma el Prof. Lohri.
¿Reconocería un linfoma?
Los síntomas pueden ser poco claros o conducir en la dirección equivocada. Una encuesta mundial en la que participaron 1606 pacientes con diversas enfermedades linfomatosas demostró que alrededor del 50% acudía al médico por primera vez porque de todos modos tenía una cita para una revisión o porque en general no se sentía bien. “Así que los síntomas iniciales son bastante inespecíficos y el estudio también demostró que el 30% de los pacientes tardaron más de cinco meses en ser diagnosticados correctamente desde su primera visita al médico”, explicó el profesor Lohri. “Aproximadamente la mitad de los linfomas son extraganglionares y muestran una gran variedad de síntomas: neurológicos como en los linfomas del SNC, cutáneos como en los linfomas de células T, o renales y cardiacos en los linfomas productores de amiloide. Los síntomas B típicos se manifiestan bastante tarde, pero incluso antes, algunos pacientes se quejan de fatiga y depresión”.
Por lo tanto, un diagnóstico correcto, realizado preferiblemente en colaboración con un especialista, es crucial. Básicamente, esto incluye:
- un historial médico (síntomas B, antecedentes familiares)
- un laboratorio (Hb, Lc, Tc, PCR, VEB, VHB, VHC, VIH, Toxoplasma, Bartonella)
- un estado (ganglios linfáticos, salas, tamaño del bazo, hígado, ORL, piel)
- una biopsia (existen varios exámenes de tejidos: IHC, FACS, citogenética, PCR, FISH).
- imagen.
“La PET proporciona datos muy buenos sobre la progresión de la enfermedad, da indicaciones sobre el pronóstico y facilita la toma de decisiones sobre el tratamiento”, afirma el Prof. Lohri.
¿Cómo acompaña la terapia el médico de familia?
Una vez confirmado el diagnóstico, el tratamiento suele correr a cargo del especialista; el médico de cabecera puede encargarse de los recuentos sanguíneos provisionales y de la administración de factores de crecimiento y antibióticos.
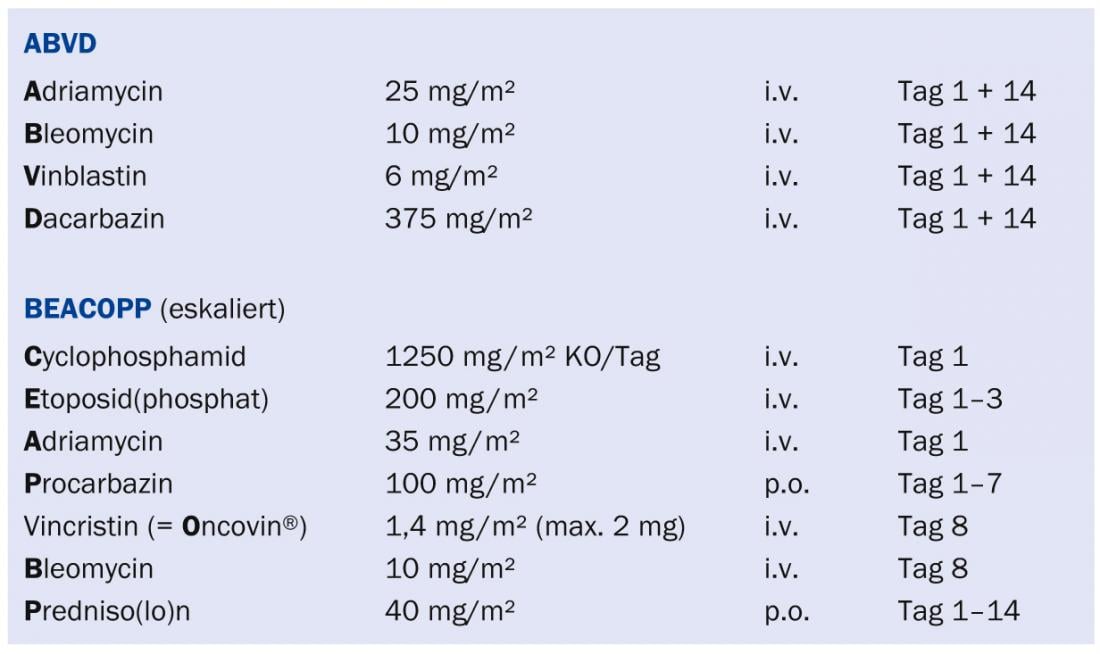
“Los algoritmos terapéuticos deberían planificarse de forma óptima en una conferencia interdisciplinar. Básicamente, la terapia pretende curar al paciente con un régimen que sea lo menos tóxico posible y no le cause efectos secundarios posteriores. Este objetivo no se ha alcanzado hasta la fecha. Por lo tanto, se necesitan nuevas vías de investigación para optimizar aún más el tratamiento. No obstante, no hay que olvidar los grandes avances que se han conseguido con los regímenes terapéuticos utilizados actualmente (especialmente con el régimen ABVD para el linfoma de Hodgkin limitado y el régimen BEACOPP para el linfoma de Hodgkin avanzado) (véase el recuadro) . Para los linfomas de células B y muchos otros linfomas, el régimen R-CHOP (con el anticuerpo rituximab) ha demostrado ser muy eficaz. Para las formas indolentes, las combinaciones con bendamustina son cada vez más importantes. Este fármaco tiene un excelente índice terapéutico, siendo sus principales toxicidades las citopenias y las erupciones cutáneas. Hoy en día, las radioterapias se utilizan con menos frecuencia en el contexto curativo porque los efectos tardíos pueden ser considerables”, explicó el Prof. Lohri.
¿Durante cuánto tiempo son necesarios los exámenes de seguimiento?
Antes del año 2000, muchos pacientes de Hodgkin recibieron dosis de radiación, algunas de ellas importantes. Según estudios recientes, la irradiación mediastínica aumenta significativamente el riesgo de enfermedad cardiaca entre 10 y 25 años después del tratamiento [1]. Dado que el médico de cabecera es el responsable del seguimiento de los llamados “supervivientes del linfoma”, también tiene el papel decisivo de reconocer y diagnosticar correctamente estas complicaciones tardías.
En el seguimiento de los pacientes irradiados, el Colegio Americano de Radiología recomienda el cribado mediante una prueba de esfuerzo y una ecocardiografía de cinco a diez años después del tratamiento debido al aumento del riesgo cardiaco.
El riesgo de segundos tumores también aumenta tras la radioterapia: un estudio demostró que alrededor del 10% de las pacientes que recibieron radioterapia a los 20 años desarrollaron un cáncer de mama en torno a los 50 años [2]. Por ello, se recomienda una resonancia magnética de la mama y una mamografía a partir de los diez años de la radioterapia.
Una mirada al futuro
Por último, el Prof. Lohri habló sobre algunas innovaciones relevantes en la terapia y el diagnóstico del linfoma:
- La PET permitirá una cura con tratamientos menos agresivos en el futuro.
- En el futuro se evitará la radiación en el ámbito curativo.
- Muchos nuevos fármacos moleculares e inmunoterapéuticos están en desarrollo: como los inhibidores de la tirosina quinasa (ibrutinib), los inmunomoduladores, los anticuerpos de segunda generación.
“El médico generalista debe tener siempre el linfoma en su radar de diagnóstico si detecta fatiga, prurito crónico, anemia, síntomas sistémicos de hepatitis vírica o infección crónica por VEB o VIH. Pero también es la persona de contacto central en el tratamiento a largo plazo del paciente con linfoma curado y, por tanto, asume un papel importante en la detección precoz de los efectos tardíos asociados”, concluyó su conferencia el Prof. Lohri.
Fuente: “Linfoma: lo que el médico de cabecera debe saber”, Seminario en la SGIM Gran Actualización, 14-15 de noviembre de 2013, Interlaken
Literatura:
- Galper S, et al: Enfermedad cardiaca clínicamente significativa en pacientes con linfoma de Hodgkin tratados con irradiación mediastínica. Sangre 2011; 117: 412-418.
- Dores GM, et al: Segundas neoplasias malignas entre los supervivientes a largo plazo de la enfermedad de Hodgkin: una evaluación basada en la población durante 25 años. J Clin Oncol 2002; 20(16): 3484-3494.
PRÁCTICA GP 2014; 9(3): 36-37











