- El tratamiento a largo plazo con AUP durante un máximo de 5,5 años no muestra nuevas señales de seguridad (1).
- El AUP tiene un perfil de seguridad consistente en el tratamiento de la artritis reumatoide (AR), la artritis psoriásica (APs) y la espondiloartritis axial (EA), aunque la frecuencia de los efectos secundarios varía debido a las diferencias en la población de pacientes y las comorbilidades relacionadas con la enfermedad (1).
- El UPA tiene un perfil de seguridad comparable al del adalimumab en la AR* y la APs (1).
* Con la excepción de los ya conocidos mayores eventos de herpes zoster y NMSC y mayores niveles de CPK.
UPA en las enfermedades reumáticas
La AR, la APs y la EA son muy estresantes para los afectados: la inflamación subyacente puede causar daños articulares permanentes y reducir significativamente la calidad de vida de los afectados [2, 3]. El upadacitnib (UPA, RINVOQ®) es un inhibidor oral reversible de la Janus quinasa (JAK) que actúa específicamente sobre la JAK1 y, en menor medida, también sobre la JAK2, la JAK3 o la TYK2. El AUP se utiliza en dosis de 15 mg una vez al día para la AR, la EA y la APs y también está aprobado para el tratamiento de adultos con dermatitis atópica (DA) de moderada a grave [4].
El UPA mostró una gran eficacia en los 9 ensayos realizados en AR, APs, EA y EA. Sin embargo, un uso seguro es igualmente crucial para el tratamiento [4]. Los datos del ensayo de vigilancia ORAL, que comparó el inhibidor de la JAK tofacitinib con un inhibidor del factor de necrosis tumoral (TNF) en pacientes ancianos con AR y factores de riesgo cardiovascular, ponen de relieve la necesidad de caracterizar mejor el perfil de seguridad de los inhibidores de la JAK en la terapia de la enfermedad reumática, sobre todo en el contexto de los comparadores activos. Una nueva publicación de Burmester et al. muestra ahora el perfil de seguridad a largo plazo del AUP durante un periodo de hasta 5,5 años en enfermedades reumáticas, en el que no surgieron nuevas señales de seguridad [1].
Tratamiento a largo plazo con UPA
En conjunto, se estudió la seguridad del AUP en 6.000 pacientes con AR, APs, EA y EA a lo largo de 15.000 pacientes-año. En la AR, la EA y la APs, se incluyeron un total de 9 ensayos de fase IIb/III, es decir, se dispone de datos sobre 4298 pacientes tratados que recibieron al menos una dosis de AUP (3209 pacientes con AR, 907 con APs y 182 con EA). Esto corresponde a un total de 11272 pacientes-año (9079,1 para la AR, 1872 para la APs y 320 para la EA, respectivamente) [1]. La duración máxima del tratamiento fue de hasta 5,5 años para la AR, 3,9 años para la APs y 3,3 años para la EA. Alrededor del 80 % de los pacientes de todos los grupos presentaban al menos un factor de riesgo de enfermedad cardiovascular al inicio del estudio (tabla 1). Los pacientes de más edad (> 65 años) estaban representados con mayor frecuencia en la población con AR (20%) que en la población con EA (6%) [1]. Los pacientes que recibieron al menos una dosis de ADA o MTX se utilizaron para la comparación. La mayoría de los pacientes con AR y APE que tomaban AUP recibían tratamiento simultáneo con csDMARD; en los pacientes con EA, el tratamiento adicional con csDMARD era poco frecuente [1].
Tabla 1: Datos demográficos basales y características de la enfermedad de UPA, ADA y MTX en pacientes con AR y UPA y ADA en pacientes con APs y UPA en pacientes con EA, respectivamente.

* La actividad de la enfermedad se mide de la siguiente manera: AR, DAS (puntuación de actividad de la enfermedad)-28 (PCR); APs, DAPSA (índice de actividad de la enfermedad para la artritis psoriásica); EA, ASDAS (puntuación de actividad de la enfermedad para la espondilitis anquilosante).
Los factores de riesgo†CVincluyen antecedentes de eventos cardiovasculares, hipertensión, diabetes mellitus, consumo de tabaco/nicotina, LDL-C elevado y HDL-C disminuido. Adaptado de [1]
No hay nuevas señales de seguridad bajo la UPA
El perfil de seguridad general del UPA fue comparable en la AR, la APs y la EA. Se han observado infecciones graves en pacientes con AR y APs en tratamiento con AUP (Fig. 1), que rara vez han llevado a la interrupción del tratamiento y con una incidencia similar en los pacientes con AR en tratamiento con AUP que en los pacientes en tratamiento con AAD. Por el contrario, no se han notificado infecciones graves en pacientes con EA en tratamiento con AUP. Las mayores tasas de infecciones graves en pacientes con APs bajo UPA parecen estar relacionadas con la COVID-19 [1].
Se notificaron neoplasias malignas (excluido el cáncer de piel no melanoma, CPNM) en todas las fases de la enfermedad con una tasa de hasta un máximo de un acontecimiento por cada 100 pacientes-año (≤1,0 E/100 PY) (Fig. 1), que fue constante en todas las enfermedades y también entre el UPA y los fármacos activos de comparación. No hubo cambios significativos en esta tasa durante toda la duración de la ingesta de AUP. Las tasas de NMSC bajo terapia UPA (≤ 0,8 E/100 PY) fueron en general las mismas para todas las enfermedades excepto la AS – no se observaron neoplasias malignas en esta población de pacientes [1].
Se notificaron acontecimientos cardiovasculares adversos graves (MACE) en todos los grupos de tratamiento en tasas <0,5 por 100 pacientes-año (PY) (Fig. 1). A excepción del tratamiento con UPA de los pacientes con EA, en los que no se observaron eventos cardiovasculares. En general, la tasa de MACE fue comparable en los pacientes con AR y APs en tratamiento con UPA, ADA y MTX. No hubo correlación entre la duración del uso de AUP y la aparición de MACE. La mayoría de los pacientes que sufrieron un MACE tenían al menos un factor de riesgo cardiovascular [1].
Se observó tromboembolismo venoso (TEV) en pacientes en tratamiento con AUP en todos los estadios de la enfermedad en tasas de <0,4 E/100 PY en AR o 0,2 E/100 PY en APs y 0,3 E/100 PY en EA. El número de acontecimientos bajo UPA fue comparable al de ADA (AR y APs) y MTX (AR) (Fig. 1). No se observó ninguna correlación entre la duración de la exposición al AUP y la aparición de TEV. La mayoría de los pacientes que sufrieron TEV tenían al menos un factor de riesgo cardiovascular y/o tromboembólico [1].
Los pacientes que recibieron AUP también presentaron informes de herpes zóster, como era de esperar. En general, fue leve o moderada. El herpes zóster rara vez provocó la interrupción de la terapia y sólo afectó a un único dermatoma. Además, no se pudo establecer ninguna correlación entre la duración del tratamiento y la aparición de herpes zóster [1]. Existe una vacuna contra el herpes zóster. La vacuna debe administrarse 4 semanas antes del tratamiento con un agente inmunomodulador activo como el AUP [4].
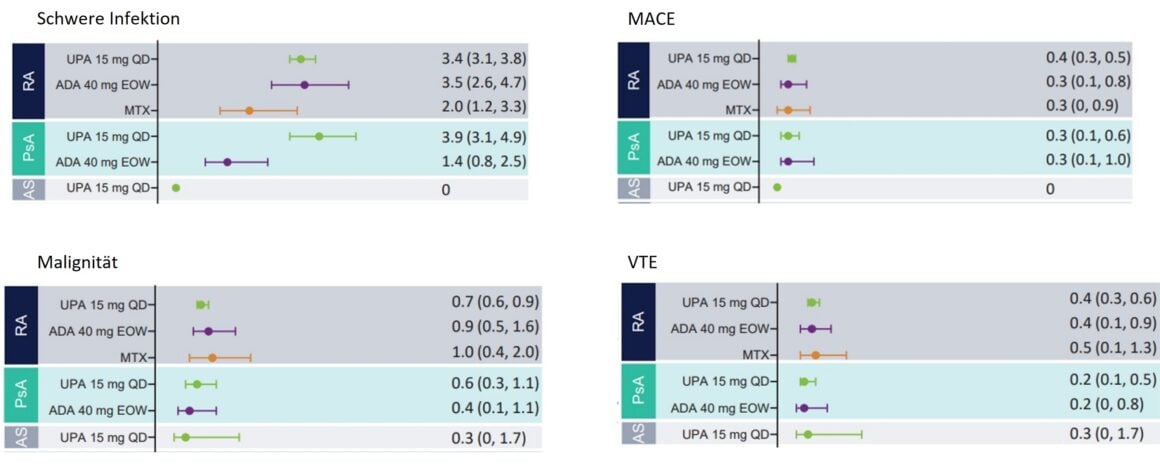
Figura 1: Tasas ajustadas a la exposición de acontecimientos adversos emergentes del tratamiento (AETT) de especial interés en pacientes con AR, APs y EA. MACE, eventos cardiovasculares adversos mayores; TEV, tromboembolismo venoso. Adaptado de [1]
Sopesar el perfil riesgo-beneficio
El tratamiento de las enfermedades reumáticas debe tener como objetivo lograr una remisión sostenida [5]. La remisión no sólo mejora el resultado del tratamiento, sino que también reduce la carga del paciente más allá de los síntomas de la enfermedad. por lo que la remisión reduce el riesgo de infección [6], el riesgo CV [7] y posiblemente también el riesgo de linfoma [8]. Los inhibidores de JAK han demostrado ser una alternativa eficaz para los pacientes con AR, EA y APs con respuesta inadecuada o intolerancia a los csDMARDs o bDMARDs [4]. El inhibidor de JAK UPA ha sido y está siendo investigado en amplios programas clínicos de fase III [1]. Se dispone de los primeros datos a largo plazo de UPA, que investigan la seguridad y eficacia en pacientes con AR y respuesta inadecuada al metotrexato. UPA en combinación con MTX es superior a ADA con MTX en términos de respuesta clínica. La eficacia sobre los síntomas articulares se midió mediante los criterios de respuesta ACR, la intensidad del dolor y la preservación de la función física. Además, una proporción significativamente mayor de pacientes bajo UPA alcanzó la remisión o una baja actividad de la enfermedad. Las tasas de acontecimientos adversos fueron comparables a las del ADA, con excepción del herpes zóster, la linfopenia, la disfunción hepática (principalmente elevaciones de ALT y ALS) y las elevaciones de CPK. Si analizamos los beneficios y los riesgos de la UPA en comparación con la ADA, la UPA mostró mejores resultados clínicos con un perfil comparable de acontecimientos adversos (Fig. 2) [9].

Figura 2: Relación beneficio-riesgo entre UPA y ADA en un contexto clínico. El número incremental de pacientes que alcanzaron los criterios de valoración de eficacia y seguridad se basó en las estimaciones puntuales del Número Necesario a Tratar (NNT) y del Número Necesario para Perjudicar (NND) para el tratamiento con AUP en lugar de ADA. a Diferencia estadísticamente significativa para UPA frente a ADA (Ki del 95%). Adaptado según [9]
Conclusión
En resumen, el perfil de seguridad del AUP en la AR, la APs y la EA es comparable y no se han observado nuevas señales de seguridad incluso con un tratamiento a largo plazo con AUP de hasta 5,5 años (1). Además, el AUP muestra un perfil de seguridad coherente en la AR, la APs y la EA, aunque la frecuencia de los efectos secundarios varía debido a las diferencias en la población de pacientes y las comorbilidades relacionadas con la enfermedad. En general, el perfil de seguridad del UPA en la AR y la APs es comparable al del ADA y el MTX (1).
La publicación completa de Burmester et al. puede consultarse aquí.
ACR: Colegio Americano de Reumatología; ADA: adalimumab; ALT: alanina aminotransferasa; ALS: aspartato aminotransferasa; CV: cardiovascular; CDAI: índice clínico de actividad de la enfermedad; csDMARD: fármacos antirreumáticos modificadores de la enfermedad sintéticos convencionales; DAS28: puntuación de actividad de la enfermedad en 28 articulaciones; HZ, herpes zóster; IR, respuesta inadecuada; IC, intervalo de confianza; LDA, baja actividad de la enfermedad; MACE, acontecimiento cardiovascular adverso mayor; MTX, metotrexato; NNT, número necesario a tratar; CPNM, cáncer de piel no melanoma; NND, número necesario para dañar; UPA, upadacitinib; TEV, tromboembolia venosa.
Referencias:
1. Burmester, G.R., et al, Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open, 2023. 9(1).
Gudu, T. y L. Gossec, Calidad de vida en la artritis psoriásica. Expert Rev Clin Immunol, 2018. 14(5): p. 405-417.
Combe, B., et al, Actualización de 2016 de las recomendaciones EULAR para el manejo de la artritis temprana. Ann Rheum Dis, 2017. 76(6): p. 948-959.
4. Información técnica actual sobre RINVOQ® (upadacitinib) en
www.swissmedicinfo.ch
.
Smolen, J.S., et al, Recomendaciones de la EULAR para el tratamiento de la artritis reumatoide con fármacos antirreumáticos modificadores de la enfermedad sintéticos y biológicos: actualización de 2019. Ann Rheum Dis, 2020. 79(6): p. 685-699.
6 Accortt, N.A., et al, Impacto de la remisión sostenida en el riesgo de infección grave en pacientes con artritis reumatoide. Arthritis Care Res (Hoboken), 2018. 70(5): p. 679-684.
7. Solomon, D.H., et al, Actividad de la enfermedad en la artritis reumatoide y riesgo de eventos cardiovasculares. Arthritis Rheumatol, 2015. 67(6): p. 1449-55.
8 Baecklund, E., et al, Asociación de la inflamación crónica, no de su tratamiento, con un mayor riesgo de linfoma en la artritis reumatoide. Arthritis Rheum, 2006. 54(3): p. 692-701.
9 Conaghan, P., et al, Análisis beneficio-riesgo de upadacitinib comparado con adalimumab en el tratamiento de pacientes con artritis reumatoide de moderada a grave. Rheumatol Ther, 2022. 9(1): p. 191-206.
Los profesionales pueden solicitar las referencias en medinfo.ch@abbvie.com.
Informe: Corinne Peter, MD
Este artículo ha sido elaborado con el apoyo financiero de AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-RNQD-230016_04/2023
En línea desde el 04.05.2023











