Las afecciones venosas crónicas de las piernas son frecuentes y a menudo desembocan en úlceras venosas crónicas. La terapia se basa en el tratamiento local de la úlcera, la terapia de la insuficiencia venosa crónica y la profilaxis de las recidivas. La úlcera suele tratarse principalmente con desbridamiento quirúrgico. A continuación, profesionales cualificados aplican apósitos húmedos a las heridas. La terapia de compresión es la piedra angular del tratamiento de la insuficiencia venosa crónica. La rehabilitación del sistema venoso superficial (venas tronculares y perforantes) sirve para prevenir las recidivas. Métodos más modernos como la ablación endovenosa de venas tronculares y perforantes compiten con la cirugía clásica de varices y muestran resultados alentadores. A pesar de todas las medidas terapéuticas, el potencial de recurrencia de esta afección es elevado.
La mitad de la población adulta presenta estigmas de insuficiencia venosa crónica (IVC). La prevalencia oscila entre el 2 y el 7% en los hombres y entre el 3 y el 7% en las mujeres [1]. Hasta un 1% de la población de los países industrializados sufre una úlcera de pierna a lo largo de su vida, la mayoría de las cuales son venosas [2]. Además del largo sufrimiento de los pacientes, esto también tiene un aspecto socioeconómico que no debe subestimarse.
Etiología
La ulceración venosa crónica (UVC) representa un grupo heterogéneo de defectos cutáneos desencadenados por la hipertensión venosa crónica y el consecuente deterioro de la microcirculación. Desde el punto de vista etiológico, se distingue entre causas primarias y secundarias. Las alteraciones venosas primarias se caracterizan por mecanismos etiológicamente no identificables de disfunción venosa crónica, que se manifiestan con mayor frecuencia en un sistema venoso superficial insuficiente. Las patologías venosas secundarias son principalmente postrombóticas o postflebíticas, menos a menudo postraumáticas.
El reflujo por sí solo es responsable de la IVC primaria, mientras que la IVC secundaria suele ser una combinación de obstrucción y reflujo [3]. Fisiopatológicamente, ambos cambios tienen en común la hipertensión venosa superficial. Los pacientes con patología combinada de obstrucción y reflujo presentan la mayor incidencia de lesiones cutáneas y úlceras crónicas [4]. Una úlcera se denomina crónica si no se cura en seis semanas [4].
Diagnóstico
El diagnóstico de la úlcera venosa crónica se basa en el cuadro clínico apoyado por exámenes complementarios. La distinción con una úlcera arterial es muy importante. Si el dolor es intenso, debe considerarse una causa distinta a la venosa como diagnóstico diferencial.
La CVU típica no es dolorosa y se localiza en la zona medial del tobillo. Son característicos de una génesis venosa de la úlcera el picor, el ardor, los calambres musculares, la hinchazón, la pesadez o las “piernas inquietas”. La inspección revela varices, telangiectasias, edema, cambios en la coloración de la piel, corona flebectásica y posible lipodermatoesclerosis [5]. En cambio, la úlcera arterial suele ser dolorosa, localizada en el maléolo lateral y asociada a una claudicación intermitente. El diagnóstico de sospecha puede confirmarse midiendo el índice tobillo-brazo (ITB).
Diagnóstico ven oso: La ecografía dúplex codificada por colores se ha consolidado para el diagnóstico venoso. Es seguro, no invasivo, rentable y fiable [6]. Existe un amplio acuerdo sobre la evaluación del reflujo en el sistema venoso superficial. Por otro lado, la cuestión de cuándo una vena perforante debe calificarse de insuficiente es controvertida. No existe una norma definida en la literatura. La mayoría de los autores utilizan un flujo dirigido hacia la superficie de ≥500 mseg como criterio de insuficiencia de la vena perforante [5]. Otros estudios consideran relevante el diámetro de la vena perforante [7, 8]. Yamamoto et al. mostraron que las venas perforantes insuficientes tenían un diámetro significativamente mayor que las perforantes suficientes (3,6±0,9 mm frente a 2,6 ±0,9 mm) [8]. Según las directrices de la Sociedad de Cirugía Vascular y el Foro Venoso Americano, un diámetro ≥3,5 mm se considera patológico [7].
Clasificación
La clasificación de la IVC puede realizarse según la clasificación simple de Widmer [9]. El estadio 1 se caracteriza por un edema reversible y una corona flebectásica paraplantar. En el estadio 2, el edema persiste y se manifiestan diversos cambios cutáneos como hemosiderosis, púrpura, dermatoesclerosis, lipodermatoesclerosis, atrofia blanca (Fig. 1), eczema de estasis y cianosis. El estadio 3 según Widmer describe la IVC con ulcus cruris.
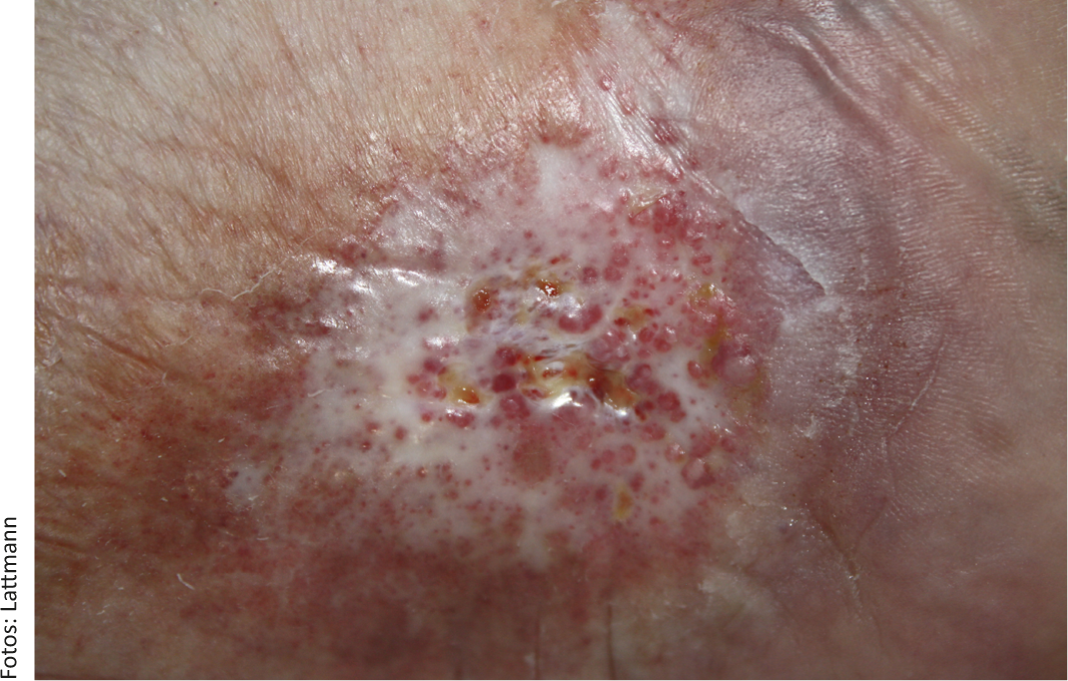
Fig. 1: Úlcera venosa crónica en una paciente de 63 años con una marcada atrofia blanquecina. No hay curación espontánea bajo una terapia de compresión constante
La clasificación mucho más precisa y aceptada internacionalmente es la clasificación CEAP(Tab. 1) [10]. Los principios de la clasificación CEAP se basan en una descripción de los cambios clínicos (C), la etiología (E), los cambios anatómicos venosos patológicos (A) y la fisiopatología subyacente (P). Según la clasificación CEAP, los estadios C5 y C6 son especialmente relevantes en relación con las úlceras crónicas.
Terapia
El tratamiento de la CVU se basa en tres pilares: el tratamiento local de la úlcera, el tratamiento de la IVC y la profilaxis de las recaídas.
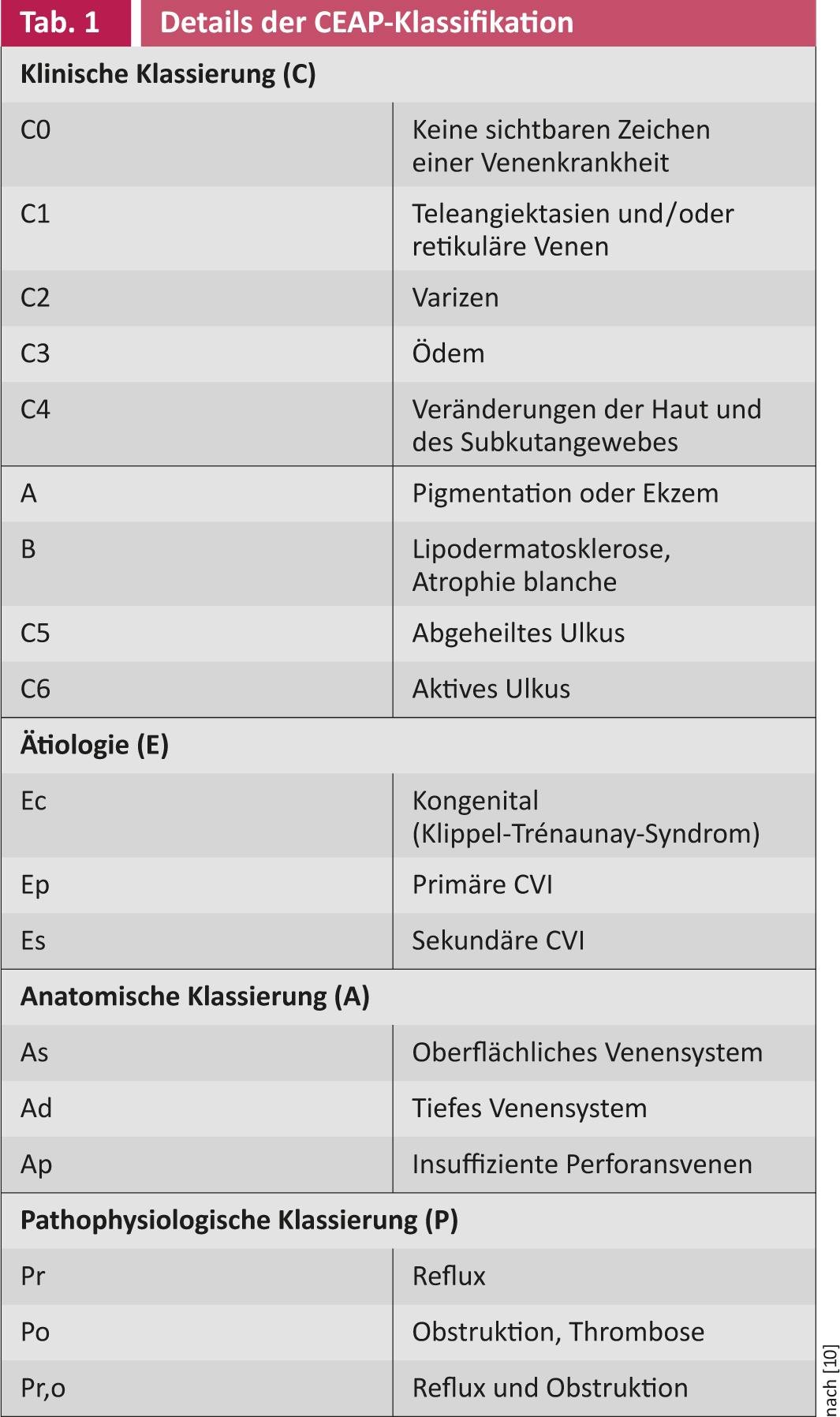
Terapia local: El tratamiento local de la herida suele comenzar con un desbridamiento quirúrgico para eliminar el tejido desvitalizado y la película de fibrina (Fig. 2).
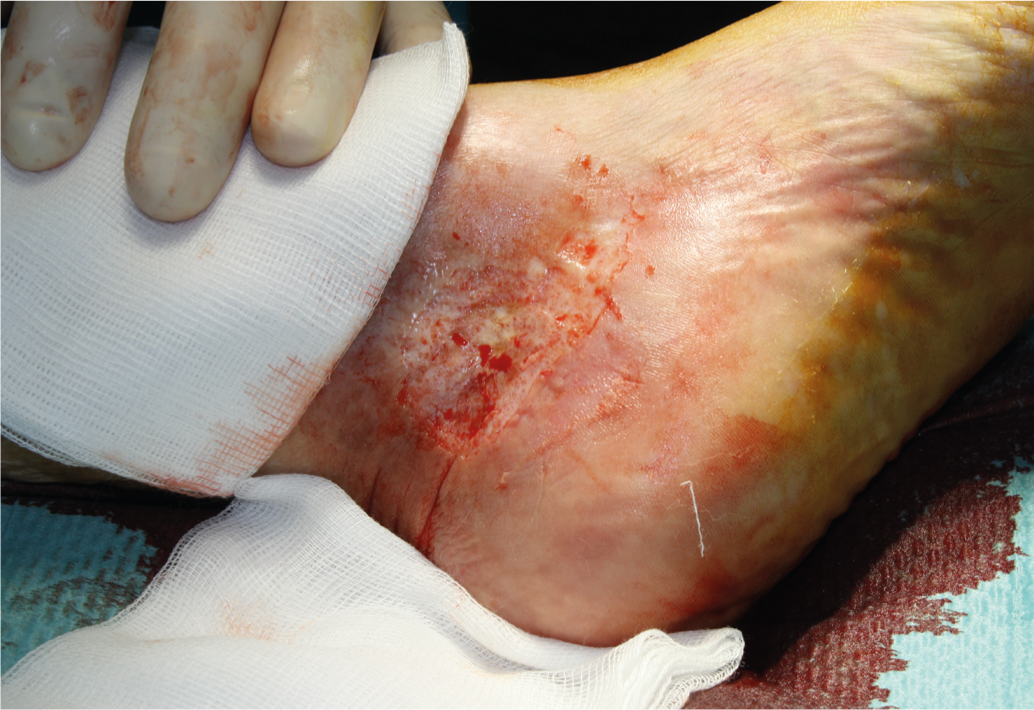
Fig. 2: Tangencial, desbridamiento quirúrgico con el dermatomo de mano
De este modo se trata la infección de “bajo grado” que ya suele existir y se mejoran las condiciones para la cicatrización de la herida. Después, están indicados los apósitos oclusivos, por ejemplo, apósitos hidrocoloides, hidrogeles o alginatos. Tienen un efecto autolítico, que ayuda a limpiar la herida y a mantener húmedo el entorno de la misma. Los apósitos para heridas con plata ionizada como ingrediente activo están destinados a contener la colonización bacteriana. En un ensayo aleatorizado (VULCAN Trial), no se pudo constatar ningún efecto positivo de los productos que contienen plata en cuanto a la tasa de cicatrización de las heridas y el tiempo transcurrido hasta la cicatrización, por lo que no se recomienda su uso rutinario [11].
Una herida con una reducción del área de al menos un 40% tras tres semanas de tratamiento adecuado de la herida tiene muchas probabilidades de cicatrizar completa y rápidamente sin ningún cambio en la terapia [14]. Para acelerar la cicatrización de la herida o para su cierre definitivo, el injerto cutáneo de grosor parcial (Fig. 3 y 4), que debe aplicarse con un sistema asistido por vacío, ya que aumenta significativamente la tasa de crecimiento [12]. Como alternativa a la cobertura cutánea dividida, existen métodos modernos de tratamiento de heridas (equivalentes cutáneos autólogos a partir de queratinocitos [Epidex®], cultivo de equivalentes cutáneos alogénicos de fibroblastos y queratinocitos [Apligraf®], superposiciones de matriz extracelular [Oasis®]fibrina enriquecida con plaquetas [Vivostat PRF®], factores de crecimiento, etc.). Estos métodos deben considerarse si la reducción de la superficie de la herida después de tres semanas es inferior al 40% [13, 14]. Se carece en gran medida de ensayos aleatorios que comparen estos productos con la cobertura de la piel dividida o las tasas de cicatrización espontánea.
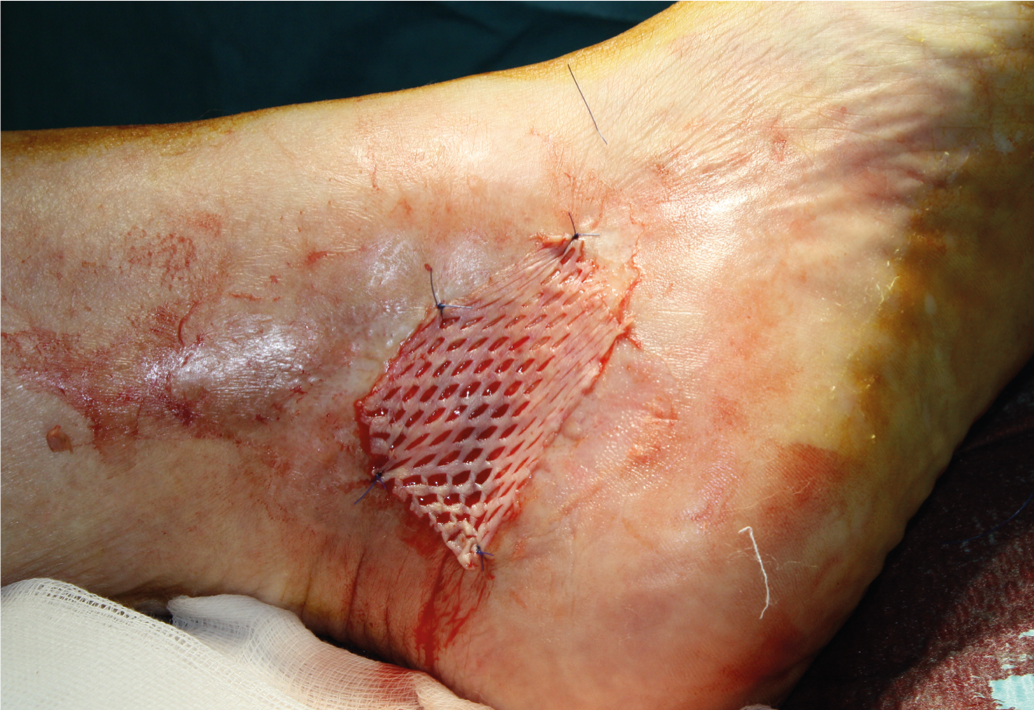
Fig. 3: Injerto de piel dividida
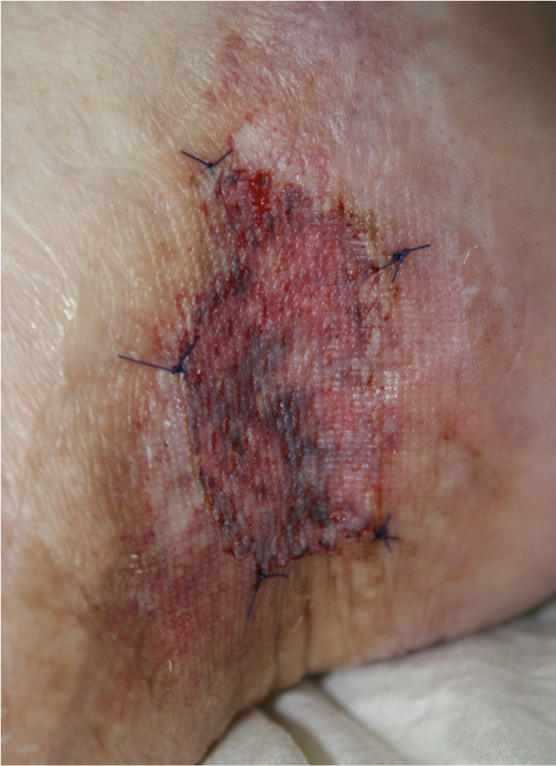
Fig. 4: Úlcera cicatrizada con piel hendida cicatrizada
Terapia de la IVC: La terapia de compresión ha demostrado su eficacia en el tratamiento de la IVC. Conlleva un aumento significativo de la tasa de cicatrización [15, 16]. En la primera fase, que dura unas tres semanas, el objetivo principal es la descongestión. Esto se hace con la ventaja de los vendajes de compresión. Después de esta fase, deben preferirse las medias de compresión a los vendajes compresivos, ya que con las medias se curan más úlceras en menos tiempo [15]. Las razones de ello no están claramente demostradas. La terapia de compresión debe tener una presión de 40 mmHg, ya que así se consigue una tasa de curación mayor que con 20 mmHg (corresponde a la clase de compresión 2 a 3) [2, 16].
En el tratamiento del síndrome postrombótico, la terapia endovascular de las venas pélvicas mediante un stent es útil en el mejor de los casos [23]. La reconstrucción del sistema venoso profundo mediante reconstrucción valvular o trasplante se reserva para situaciones especiales.
Prevención de recaídas: Debido a la alta tasa de recaídas (30% después de 1 año, 78% después de 2 años [17]), debe darse una alta prioridad a la prevención de recaídas. Dado que el tratamiento de un sistema venoso superficial insuficiente y de las venas perforantes insuficientes conlleva una reducción significativa de la tasa de recidiva [7, 18, 19], revisten una importancia capital.
Las venas troncales insuficientes deben tratarse con crossectomía y extirpación de la vena safena magna hasta aproximadamente el nivel de la articulación de la rodilla o ligadura y extirpación de la vena safena (nivel de evidencia 2B o 1B) [7]. Como alternativa, puede considerarse la ablación endovenosa mediante radiofrecuencia o láser [19]. La terapia endovenosa de las venas tronculares y también de las venas perforantes ha adquirido una importancia masiva en los últimos años y muestra muy buenos resultados [20]. En el futuro, competirá ferozmente con la cirugía tradicional de varices. La escleroterapia de las venas tronculares insuficientes parece ser inferior a la terapia quirúrgica y endovenosa [20].
Los datos sobre la terapia de las perforantes insuficientes son actualmente insuficientes, ya que no se dispone de estudios aleatorizados. En una revisión sistemática de las directrices, O’Donnell recomienda que el objetivo principal del tratamiento del reflujo sean las venas tronculares [21]. Las perforantes insuficientes de gran tamaño (>3,5 mm) con reflujo de gran volumen en la zona de la úlcera pueden tratarse. Son posibles los procedimientos quirúrgicos abiertos, la ligadura endoscópica de perforantes (“cirugía endoscópica subfascial de perforantes”, SEPS) y también las ablaciones endovenosas percutáneas (térmicas o químicas). No existen estudios aleatorizados sobre el valor de estos tres métodos. Las directrices de la Sociedad de Cirugía Vascular recomiendan tratar las perforantes insuficientes en la zona de una úlcera en estadio C5 y C6 [7] mediante ligadura quirúrgica, SEPS, escleroterapia guiada por ecografía o ablación térmica, especialmente si fracasa la terapia conservadora para la CVU. Lawrence et al. demostró que en las CVU que no cicatrizaban, la ablación endovenosa de al menos una vena perforante era capaz de curar el 90% de las úlceras [22].
Previsión
Incluso cuando una úlcera se ha curado, la tasa de recidiva es muy alta, de hasta el 78% [17]. En los pacientes que se han sometido a una reparación quirúrgica de las varices tras la cicatrización, además de la terapia conservadora con compresión, la tasa de recurrencia es significativamente menor que con la compresión sola (31 frente a 56%) [18]. Esto es cierto no sólo para los pacientes con insuficiencia venosa extrafascial, sino también para los pacientes con reflujo venoso combinado extrafascial y profundo [18].
Dr. Thomas Lattmann
Literatura:
- Callam MJ: Br J Surg 1994; 81(2): 167-173.
- O’Meara S, Cullum NA, Nelson EA: Compresión para las úlceras venosas de la pierna. Cochrane Database Syst Rev. 2009; (1): CD000265.
- McAree BJ, Berridge DC: Flebología 2010; 25(supl. 1): 20-27.
- Abbade LP, Lastória S: Int J Dermatol 2005; 44(6): 449-456.
- Gloviczki P: J Vasc Surg 2011; 53(5 Suppl): 1S.
- Coleridge-Smith P, et al: Eur J Vasc Endovasc Surg 2006; 31(1): 83-92.
- Gloviczki P, et al: J Vasc Surg 2011; 53(5 Suppl): 2S-48S.
- Yamamoto N, et al: J Vasc Surg 2002; 36(6): 1225-1230.
- Widmer LK, et al: Langenbecks Arch Chir 1978; 347: 203-207.
- Porter JM, Moneta GL: J Vasc Surg 1995; 21(4): 635-645.
- Michaels JA, et al: British Journal of Surgery 2009; 96(10): 1147-1156.
- Körber A, et al: Dermatología 2008; 216(3): 250-256.
- Gelfand JM, Hoffstad O, Margolis DJ: J Invest Dermatol 2002; 119(6): 1420-1425.
- Phillips TJ, et al: J Am Acad Dermatol 2000; 43(4): 627-630.
- Amsler F, Willenberg T, Blättler W: J Vasc Surg 2009; 50(3): 668-674.
- O’Meara S, et al: Compresión para las úlceras venosas de la pierna. Cochrane Database Syst Rev. 2012; 11: CD000265.
- Mayer W, Jochmann W, Partsch H: Wien Med Wochenschr 1994; 144(10-11): 250-252.
- Gohel MS, et al: BMJ 2007; 335(7610): 83.
- Harlander-Locke M, Let al: J Vasc Surg 2012; 55(2): 458-464.
- Rasmussen LH, et al: Br J Surg 2011; 98(8): 1079-1087.
- O’Donnell TF: Flebología 2010; 25(1): 3-10.
- Lawrence PF, et al: J Vasc Surg 2011; 54(3): 737-742.
- Rosales A, Sandbaek G, Jorgensen JJ: Eur J Vasc Endovasc Surg 2010; 40(2): 234-240.
CARDIOVASC 2013, nº 4: 14-17











