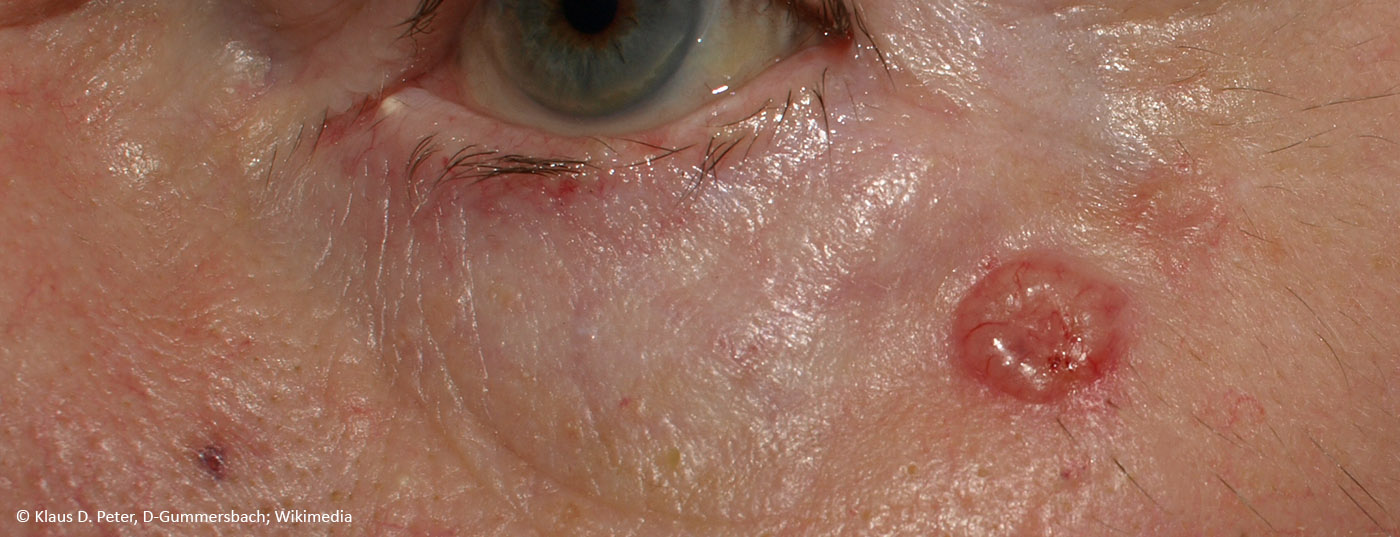
Se sabe que la exposición a la radiación UV es la causa principal del cáncer de piel no melanocítico al dañar el ADN e inhibir la inmunidad antitumoral. Una reducción de la concentración intracelular de ATP, la principal fuente de energía celular, desempeña un papel importante en ello. La nicotinamida es un cofactor para el suministro de ATP celular y favorece los mecanismos de reparación del ADN. La hipótesis de los efectos preventivos de la nicotinamida se ha confirmado especialmente para la prevención secundaria del cáncer de piel no melanocítico.
La incidencia de los tumores no melanocíticos (TNM) ha aumentado considerablemente en los últimos años. La protección frente a la radiación UV es la parte más importante de la prevención del cáncer de piel, pero también se están investigando otras estrategias de prevención. Recientemente, han aumentado los informes sobre un posible beneficio de las sustancias fitoquímicas protectoras de las células para la prevención del CPNM. En la Reunión Anual virtual de la EADV, celebrada en octubre de 2020, la Prof. Dra. med. Yolanda Gilaberte Calzada, del Hospital Universitario Miguel Servet de Zaragoza (España), habló sobre la prevención oral del cáncer de piel [1].
La nicotinamida favorece la reparación del ADN
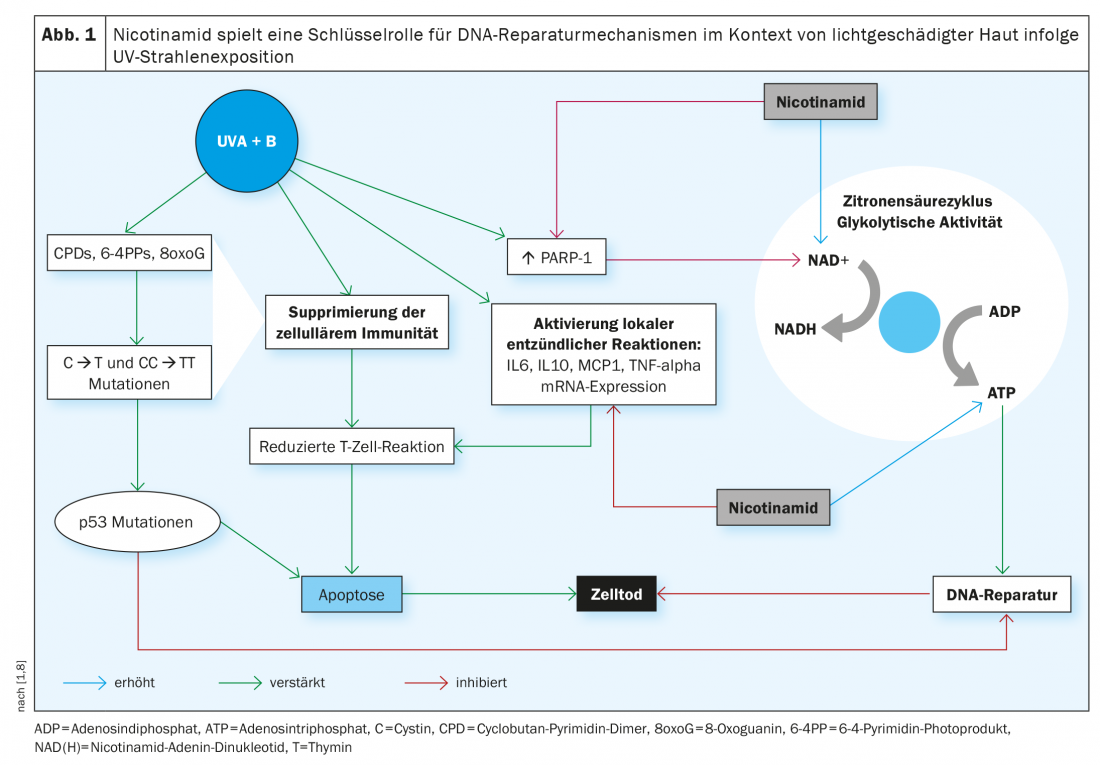
La actual directriz S2k Carcinoma de células basales de la piel (cBCC) recomienda el uso oral de nicotinamida en una dosis de 500 mg dos veces al día para la prevención secundaria y los estudios han demostrado que durante un periodo de tratamiento de 12 meses la tasa de incidencia del carcinoma de células escamosas (cSCC) se redujo en un 30% [2,15]. ¿En qué se basa el efecto preventivo postulado de esta sustancia fitoquímica? Se sabe que la exposición a la radiación UV es una de las principales causas del CPNM al provocar daños en el ADN y una reducción de la inmunidad antitumoral. Esto va acompañado de un agotamiento de la concentración intracelular de trifosfato de adenosina (ATP), la principal fuente de energía de la célula. La nicotinamida lo contrarresta bloqueando el efecto inhibidor de la radiación UV sobre la producción de ATP y minimizando la inmunosupresión inducida por la radiación UV (Fig. 1) [3,4]. Químicamente, la nicotinamida es la forma amida de la vitamina B3, una vitamina importante para muchos procesos metabólicos del organismo, que el cuerpo sólo produce en pequeñas cantidades y que, por tanto, debe ingerirse con los alimentos. Y es un precursor de la nicotinamida adenina dinucleótido (NAD) y de la nicotinamida adenina dinucleótido fosfato (NADP), ambas coenzimas implicadas en diversos procesos metabólicos. Entre otras cosas, el NADP es un factor esencial para la producción intracelular de ATP y, por tanto, desempeña un papel importante en los mecanismos de reparación del ADN. El NADPH es la forma reducida del NADP y un derivado del NADH (Fig. 1).
Reducción de la incidencia en los grupos de alto riesgo
La hipótesis de que el tratamiento oral con nicotinamida se asocia a una reducción de la incidencia de NMSC podría confirmarse empíricamente. En el estudio australiano de fase III ONTRAC (“Nicotinamida oral para reducir el cáncer actínico”), la ingesta regular de nicotinamida redujo el riesgo de desarrollar cáncer de piel no melanocítico en personas de riesgo [5]. En este ensayo aleatorio doble ciego, los pacientes de alto riesgo (n=386) recibieron 2× 500 mg diarios de nicotinamida o placebo durante 12 meses. “Alto riesgo” se definió como al menos dos tumores NMSC en los últimos 5 años. La edad media de los participantes en el estudio era de 66 años. Después de 12 meses, había un 23% menos de nuevos casos de NMSC en el grupo de nicotinamida que en el de placebo (p=0,02). El número de nuevas queratosis actínicas fue un 11% inferior a los 3 meses y un 13% inferior a los 12 meses. Sin embargo, seis meses después de interrumpir la nicotinamida no se apreciaron diferencias significativas entre los dos grupos, por lo que el efecto protector parece limitarse al periodo de tratamiento. Según los autores, para poder hacer afirmaciones más claras sobre los efectos preventivos, un estudio durante un periodo de tiempo más largo con dosis más altas podría ser informativo; la tolerabilidad del tratamiento con nicotinamida demostró ser buena en este estudio.
Basándose en los resultados del estudio ONTRAC, Chen et al. está llevando a cabo un estudio de fase II para evaluar los efectos de la nicotinamida en la incidencia de NMSC en receptores de trasplantes de órganos, una población de pacientes con una mayor incidencia de cáncer de piel y queratosis actínica en comparación con los individuos inmunocompetentes [6,8]. Tras un periodo de 6 meses, se produjo una reducción del 35% en la incidencia de NMSC en el grupo de nicotinamida en comparación con el placebo. El hecho de que no se alcanzara el nivel de significación se atribuye al pequeño tamaño de la muestra en una revisión publicada en 2019. Los autores citan como prueba adicional de eficacia en pacientes con trasplante de órganos un estudio de Drago et al 2017 (n=38), en el que se observó una reducción del tamaño de las queratosis actínicas en el 88% de los pacientes tratados con nicotinamida, una remisión completa en el 42%, y la tasa de incidencia fue nula [7].
Las pruebas de la eficacia de la nicotinamida en el campo dermatológico no se limitan a la prevención del cáncer de piel. Por ejemplo, una revisión publicada en 2017 halló un alivio sintomático del prurito, atribuido a efectos antiinflamatorios y a la mejora de la función de barrera epidérmica [9]. También hay indicios de efectos positivos en el penfigoide bulloso [10] y otras enfermedades dermatológicas. Sin embargo, actualmente se dispone de la mejor base de pruebas en el ámbito de la prevención del cáncer de piel.
¿Qué hay de otros fitoquímicos para la prevención del cáncer de piel?
En la directriz actual de la Academia Americana de Dermatología (AAD), la acitretina se recomienda para la prevención de la NMSC y para el tratamiento y la profilaxis de la queratosis actínica en pacientes con trasplante de órganos [11]. La dosis sugerida es de 10 mg/día con un aumento de 10 mg a intervalos de 2-4 semanas. La dosis objetivo es de 20-25 mg/día [1]. Según los estudios clínicos, la duración del tratamiento puede ser de hasta 1 año, por lo que los efectos preventivos medibles también se limitan al periodo de tratamiento según los conocimientos actuales [1]. Con respecto a la isotretinoína y los antiinflamatorios no esteroideos (AINE) como la aspirina o el ibuprofeno, las pruebas sobre los posibles efectos preventivos para la prevención primaria o secundaria del CPNM son inconsistentes y dependen de las características del paciente [1,12]. En resumen, en lo que respecta a la quimioprevención mediante sustitución oral, los hallazgos sobre la nicotinamida son actualmente los más prometedores, aunque su uso debe sopesarse individualmente en cada caso.
Fuente: Reunión anual de la EADV 2020
Literatura:
- Gilaberte Y: Prevención oral del cáncer de piel. Prof. Dra. Yolanda Gilaberte, Reunión anual de la EADV, 31.10.2020.
- AWMF: directriz s2k Carcinoma basocelular de la piel, 2018, www.awmf.org/uploads/tx_szleitlinien/032-021l_S2k_Basalzellkarzinom-der-Haut_2018-09_01.pdf
- AWMF: Directriz S3. Queratosis actínica y carcinoma de células escamosas de la piel, 2020, www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Aktinische_Keratosen_und_PEK/LL_Aktinische_Keratosen_PEK_Langversion_1.1.pdf
- Bayerl C: Envejecimiento de la piel: lo que puede hacer el antienvejecimiento, Pharmazeutische Zeitung (Online), 08.08.2017
- Chen AC, et al: N Engl J Med 2015; 373(17): 1618-1626.
- Chen AC, et al: Br J Dermatol 2016, 175(5), 1073-1075. doi: 10.1111/bjd.14662
- Drago F, et al : Eur J Dermatol 2017; 27: 382.
- Snaidr VA, Damian DL, Halliday GM: Dermatología Experimental 2019, https://onlinelibrary.wiley.com/doi/full/10.1111/exd.13819
- Forbat E, et al: Clin Exp. Dermatol 2017; 42(2): 137.
- Chen AC, et al: Australas. J. Dermatol 2014; 55(3): 169.
- Kim JYS, et al: Directrices de atención para el tratamiento del carcinoma cutáneo de células escamosas. JAAD 2018; 78(3): 560-578.
- Herold M, et al: Dermatol Surg 2019; 1442-1449.
- Wikimedia, https://doi.org/10.1155/2011/496910
- Wikimedia, DOI:10.1155/2011/210813
- Stratigos AJ, et al: European Journal of Cancer 2020; 128, https://doi.org/10.1016/j.ejca.2020.01.007
DERMATOLOGIE PRAXIS 2021; 31(1): 44-45 (publicado el 23.2.21, antes de impresión).