Los tumores neuroendocrinos (NET) no son tan raros. La prevalencia de estos tumores en el tracto gastrointestinal sólo es superada por el carcinoma de colon. A menudo, las NET sólo se descubren en las últimas fases debido a los síntomas sutiles y suelen encontrarse ya en una fase paliativa, inoperable. Por lo tanto, es importante reflexionar sobre estos tumores. En los últimos años se han introducido muchas opciones nuevas de terapia quirúrgica, local-intervencionista y sistémica. Debido al alto grado de complejidad en el diagnóstico y tratamiento de estos tumores, es deseable la cooperación en un equipo especializado de gastroenterólogos, cirujanos, patólogos, radiólogos, especialistas en medicina nuclear, endocrinólogos y oncólogos.
Los tumores neuroendocrinos (NET) tienen una incidencia relativamente baja pero creciente de 4-5 nuevos casos / 100.000 habitantes al año [1]. Sin embargo, la prevalencia, es decir, el número de pacientes que padecen tumores neuroendocrinos gastrointestinales (GEP-NET), es muy superior y sólo es superada en el tracto gastrointestinal por el carcinoma de colon. Además, la incidencia de todos los GEP-NET excepto los carcinoides apendiculares está aumentando [2]. En la práctica, las GEP-NET son más comunes de lo esperado. Esta breve visión general resume los hechos más importantes en el diagnóstico, las diferentes formas de diagnóstico de propagación, las medidas terapéuticas más importantes, así como en los cuidados posteriores. El resumen se basa en las directrices actuales de la Sociedad Europea de Tumores Neuroendocrinos(www.enets.org).
Clasificación de GEP-NET
Los tumores neuroendocrinos se clasifican principalmente en función de la localización del tumor primario y del número de mitosis (Ki67). La tasa mitótica es uno de los factores pronósticos más importantes y divide estos tumores en G1 (Ki67 ≤ 2%), G2 (Ki67 3-20%) y G3 (Ki67 >20%), correspondiendo el estadio G3 a un carcinoma neuroendocrino menos diferenciado y a menudo agresivo en comparación con los tumores neuroendocrinos mejor diferenciados [3,4].
Los tumores neuroendocrinos gastrointestinales pueden aparecer en cualquier parte del tubo digestivo. Dependiendo de la localización del tumor primario, las características y la forma de la metástasis son diferentes y requieren un esclarecimiento correspondientemente distinto. La incidencia de los NET gástricos (g-NET) no ha dejado de aumentar en los últimos años y representa aproximadamente el 8% de los GEP-NET [5]. Las razones de ello son sin duda la introducción generalizada de la gastroscopia y posiblemente el uso frecuente de inhibidores de la bomba de protones [6].
Los g-NET se dividen en tres subgrupos. El tipo I, el más común, puede ir acompañado de gastritis atrófica, suele estar bien diferenciado, rara vez hace metástasis y tiene un buen pronóstico. Los subtipos II y III son más raros, metastatizan con más frecuencia y tienen peor pronóstico (especialmente el subtipo III) [5]. El trabajo y el pronóstico de estos tumores gástricos deben adaptarse en función del tipo y el tamaño. Los NET duodenales (d-NET) son poco frecuentes (1- 2% de los GEP-NET), se producen sobre todo en los dos primeros tercios del duodeno, suelen ser relativamente pequeños, bastante bien diferenciados y, sin embargo, metastatizan localmente a los ganglios linfáticos en un 40-60% [7]. La incidencia del GEP-NET pancreático (p-NET) se sitúa entre 2 y 3/100 000 personas al año [8]. En el p-NET, los primeros signos de enfermedad maligna suelen estar ausentes. Estos pacientes acuden al médico con compresión local o signos de metástasis avanzada (especialmente en el hígado). Por este motivo, más del 50% de los pacientes con p-NET ya presentan metástasis a distancia.
Una enfermedad subyacente globalmente rara pero típica del p-NET (también del d-NET) es la Neoplasia Endocrina Múltiple Tipo I (MEN I).
Aproximadamente el 20% de los pacientes con MEN1 padecen p-NET, con una incidencia creciente con la edad [8]. Asimismo, los pacientes con la enfermedad de Von Hippel-Lindau, entre otras neoplasias malignas, tienen más probabilidades de desarrollar un p-NET.
Las NET yeyunales e ileales son las NET GEP más comunes, representando hasta el 30% de todos los casos [9]. Los NET del intestino delgado, al igual que los p-NET, tienen tendencia a estar ya metastatizados en el momento del diagnóstico. Generalmente, suelen verse afectados los ganglios linfáticos locales y, más adelante, también el hígado. Los NET de colon se dan en aproximadamente el 7% de todos los GEP-NET y suelen tener el peor pronóstico [10]. Al igual que los tumores ya descritos, los NET de colon suelen estar ya muy avanzados en el momento del diagnóstico y metastatizan a nivel local, peritoneal y hepático. Los NET rectales, en cambio, suelen detectarse relativamente pronto. Esto se debe a los primeros síntomas, como dolor o sangre ab ano. Por este motivo, entre otros, las metástasis en la NET rectal son bastante raras [10]. En general, la biología del GEP-NET difiere en función de la localización y la diferenciación. Por lo tanto, el diagnóstico, la terapia y el seguimiento deben adaptarse a la localización primaria.
Aclaración diagnóstica y diagnóstico por imagen
Dependiendo de la localización, la aclaración de la GEP-NET difiere. El diagnóstico se realiza mediante confirmación histológica [11]. Una aspiración con aguja fina para el estudio citológico suele ser insuficiente. Los marcadores obligatorios para el diagnóstico son la sinaptofisina y la cromogranina A. También debe determinarse el grado de diferenciación (G1-G3). Otros marcadores, por ejemplo los receptores individuales de somatostatina, no son obligatorios, pero son de interés, por ejemplo, para otros pasos terapéuticos.
Una vez realizado el diagnóstico, se lleva a cabo la estadificación [12]. La estadificación, junto con la gradación, es el marcador pronóstico más importante para el paciente. Los métodos utilizados incluyen la ecografía (incluida la ecografía endoscópica), a menudo la TC con contraste, la RM y métodos funcionales como la gammagrafía con octreotida y la PET/TC con galio-68 DOTATATO/DOTATOC y la PET/TC con fluorina-18 desoxiglucosa (FDG). El dominio de la ecografía es principalmente la visualización de las metástasis hepáticas con una sensibilidad y especificidad en torno al 90%. La ecografía endoscópica (EUS) se utiliza en particular para los tumores neuroendocrinos pancreáticos (por ejemplo, insulinomas pancreáticos o tumores pancreáticos no funcionales). La especificidad/sensibilidad es superior al 90%. Los tumores duodenales son más difíciles de visualizar mediante USE. La tasa de detección de estos tumores mediante USE sólo ronda el 60%. La TC con contraste es el método más utilizado para la estadificación del GEP-NET. Es importante realizar una fase arterial, especialmente en el caso de metástasis hepáticas. Esto aumenta la tasa de detección de metástasis hepáticas hasta aproximadamente el 80%. Sin embargo, la sensibilidad es algo menor (en torno al 70%), especialmente en el caso de los p-NET y las metástasis de tejidos blandos. Estos tumores son el dominio típico del examen por resonancia magnética. La IRM tiene una sensibilidad superior al 90% para detectar p-NET en el páncreas. Además, la resonancia magnética hepática con medio de contraste específico para el hígado es el examen de elección para encontrar metástasis hepáticas. Con una tasa de detección de hasta el 95%, la IRM hepática es el método más sensible para las metástasis hepáticas. Los métodos funcionales se utilizan normalmente para el diagnóstico de propagación y para medir la expresión de los receptores de somatostatina (especialmente SSTR2) [13].
La gammagrafía con octreotida utilizada hasta hace poco, que tiene una exposición a la radiación relativamente alta y protocolos de registro de varios días, está siendo sustituida por la PET/TC con galio-68 DOTATATO/DOTATOC. El examen PET muestra una radiación significativamente menor (aprox. 30%) y una resolución significativamente mejorada en comparación con el método centellográfico. En muchos centros de NET, la gammagrafía se ha sustituido completamente por la PET/TC con galio-68 DOTATATO/DOTATOC (Fig. 1) .
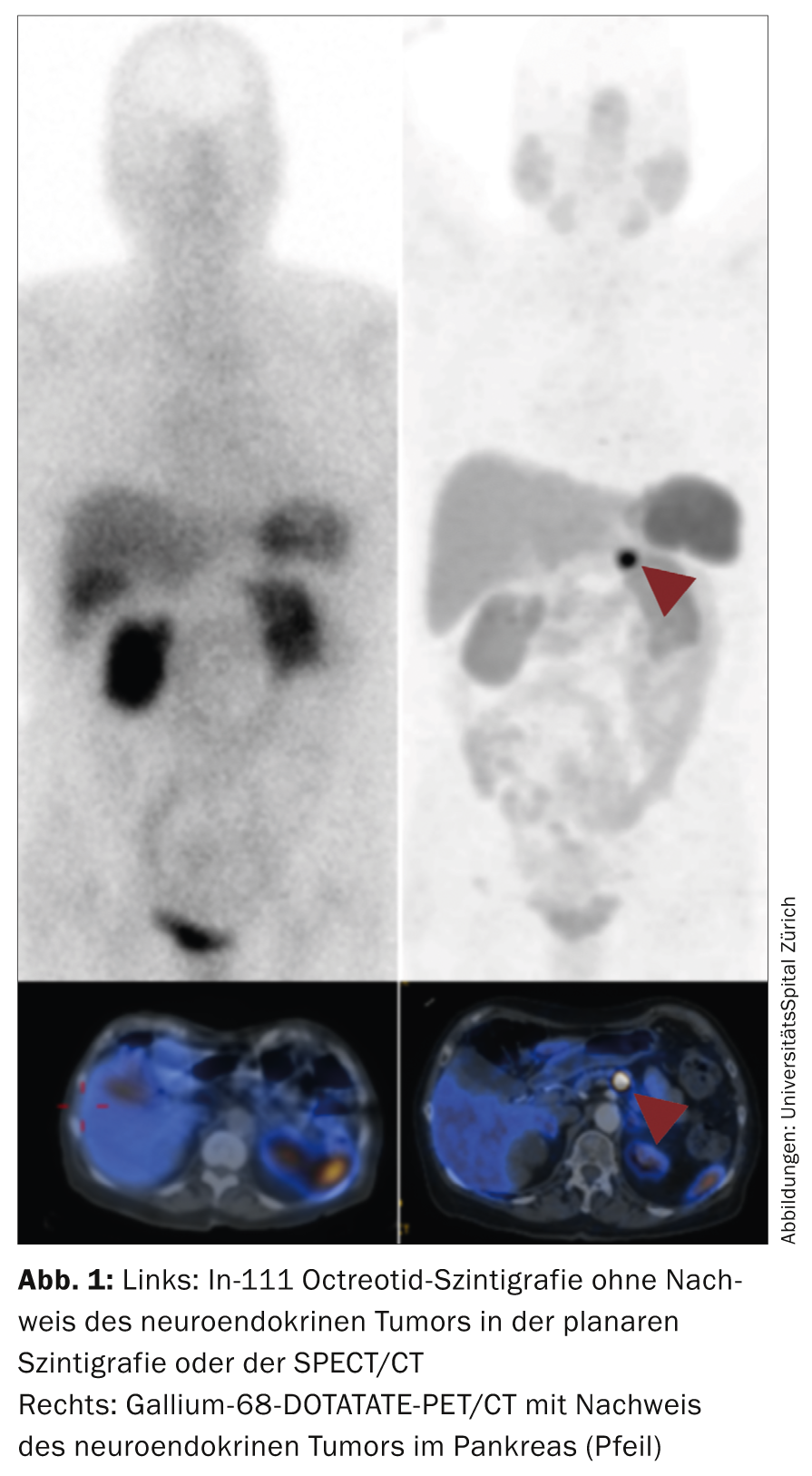
La FDG-PET/CT se utiliza para los carcinomas desdiferenciados (G3), aunque incluso los tumores G2 de grado superior pueden mostrarse mejor en la FDG-PET. Los pacientes con tumores funcionales con síntomas carcinoides deben someterse a una ecocardiografía al menos una vez para excluir la afectación cardiaca [14].
Marcadores bioquímicos
Los GEP-NET, especialmente los tumores del “intestino medio”, pueden producir y secretar péptidos funcionalmente activos. Sin embargo, la tasa de tumores clínicamente funcionales frente a los no funcionales es sólo de aproximadamente 1:10. Los denominados tumores de “intestino anterior” e “intestino posterior” son algo menos frecuentes. La medición de estos péptidos en orina o sangre puede utilizarse como indicador de progresión si los síntomas están presentes [15].
La prueba estándar es la medición en 24h del ácido 5-indoleacético (5-HIAA) en orina. En presencia de síntomas NET funcionales, los índices de sensibilidad y especificidad resp. al 70 y al 90%. El 5-HIAA también puede estar elevado por enfermedades intestinales inflamatorias crónicas y, por tanto, influir falsamente de forma positiva en el resultado de la medición. Los medicamentos, por ejemplo los fármacos quimioterapéuticos o las sustancias con actividad central, como los antidepresivos tricíclicos, también pueden influir en las lecturas de la recogida de orina de 24 horas y debe preguntarse por ellos.
Otras pruebas, como la prueba de ayuno para el insulinoma o la prueba de secretina para el gastrinoma, deben estar en manos de un especialista con experiencia (por ejemplo, en un servicio especializado de endocrinología). La cromogranina A (CgA) es otro marcador bioquímico plasmático importante de NET. La CgA se produce en los gránulos neurosecretores de las células tumorales y puede segregarse por igual en las NET funcionales y no funcionales. Debe tenerse en cuenta que la CgA puede elevarse falsamente, sobre todo si se toman al mismo tiempo inhibidores de la bomba de protones. Otros factores que pueden aumentar la CgA son: Insuficiencia renal, enfermedad de Parkinson, hipertensión no tratada, embarazo, glucocorticoides, gastritis crónica de tipo A y enfermedad inflamatoria intestinal. No obstante, se ha demostrado que la CgA es más precisa que la medición urinaria de 5-HIAA o la Enolasa Neurona Específica (NSE) que se realiza habitualmente [15].
Terapia del GEP-NET
La terapia de los tumores neuroendocrinos es compleja y debe discutirse y decidirse de forma multidisciplinar. Una junta tumoral con presencia de diferentes disciplinas diagnósticas, quirúrgicas y médicas debe decidir al menos una vez el diagnóstico, la terapia y el seguimiento de un paciente con NET.
La primera prioridad de cualquier terapia es aspirar a la cirugía (siempre que parezca razonable). El objetivo de la operación debe ser, siempre que sea posible, la extirpación completa del tumor. Además, los tumores localmente sintomáticos deben tratarse quirúrgicamente, por ejemplo en caso de íleo inminente o ab ano sanguíneo. La terapia citorreductora puede discutirse en determinados casos en un contexto paliativo con una carga tumoral elevada. Sin embargo, esto debe discutirse detalladamente con el paciente teniendo en cuenta el trasfondo paliativo, la morbilidad a veces elevada de la intervención y la enfermedad, a menudo de progresión lenta.
Los pacientes con síntomas funcionales pronunciados deben ser examinados perioperatoriamente con Sandostatin, posiblemente bloqueantes H1/H2 y cortisona [16]. También hay que tener en cuenta que la catecolamina puede provocar un aumento de la liberación de hormonas.
En pacientes con una carga tumoral elevada, los procedimientos intervencionistas (por ejemplo, la embolización) pueden provocar cambios rápidos en la presión arterial. Esto es especialmente importante en pacientes con afectación cardiaca del síndrome carcinoide. Si no es posible una intervención quirúrgica, en principio se utilizan terapias locales-intervencionales o sistémicas.
Los métodos de intervención local incluyen la embolización con partículas, la quimioembolización y la radioembolización. Sin embargo, hoy en día la embolización blanda clásica sólo se realiza en pequeñas cantidades para la NET. Esto se debe principalmente a la elevada tasa de efectos secundarios (por el efecto directo de la hipoxia local grave y la necrosis). Asimismo, la quimioembolización en NET suele provocar síntomas graves (principalmente el síndrome postembolización), sobre todo en tumores hepáticos avanzados y de gran tamaño. La radioembolización es una terapia elegante que suele tener pocos efectos secundarios en manos de especialistas experimentados. La infusión local de microesferas radiactivas, normalmente cargadas con itrio-90, un emisor β puro, deposita radiación local de hasta más de 500 grays en las metástasis hepáticas en una sola sesión. Esto se debe a las propiedades de radiación del itrio-90 y a la perfusión arterial selectiva típicamente alta de las metástasis NET en el hígado (Fig. 2).
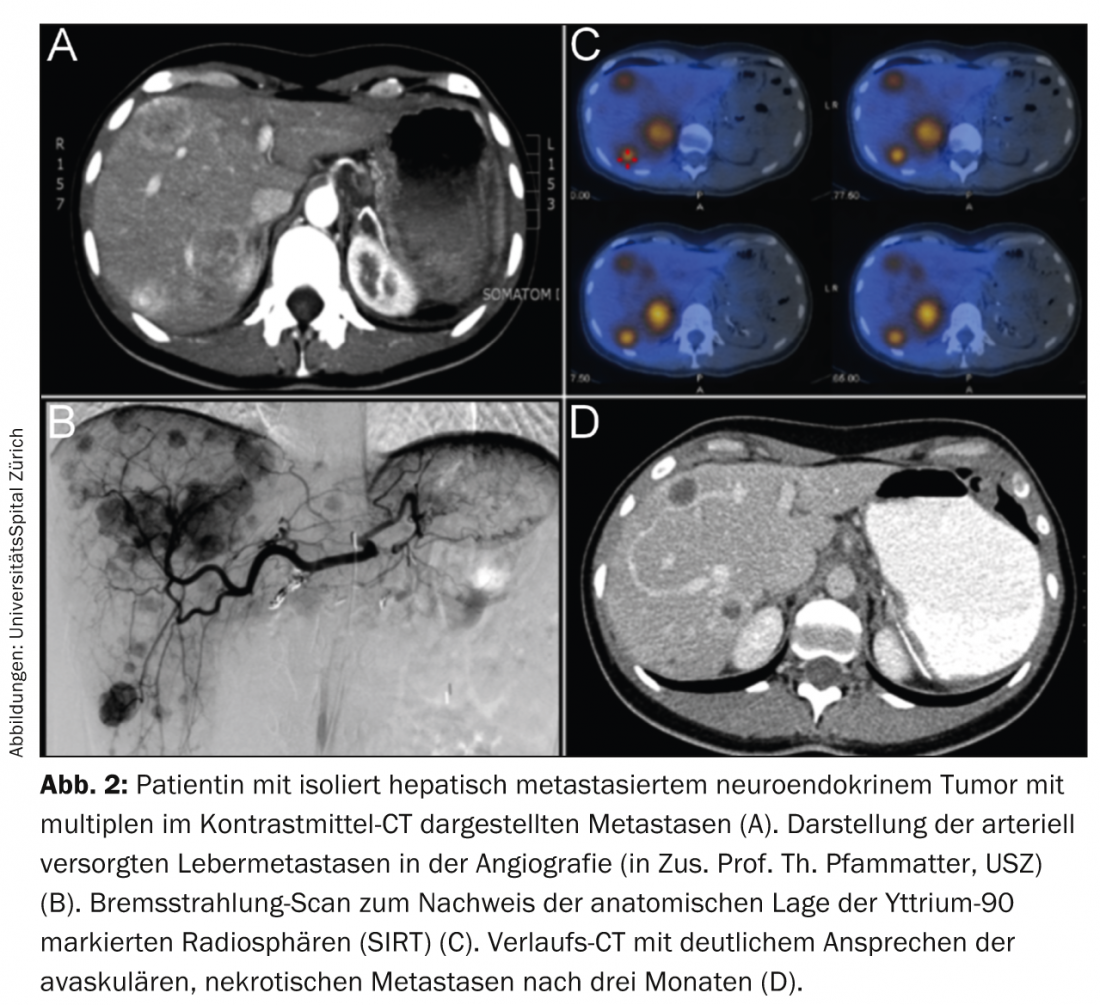
Debido a la baja tasa de efectos secundarios de la radioembolización ambulatoria realizada correctamente, la quimioembolización y especialmente la embolización han sido sustituidas casi por completo [17]. Sin embargo, esta terapia sólo se lleva a cabo con regularidad en unos pocos centros de Suiza, como el Centro de Excelencia ENETS del Hospital Universitario de Zúrich.
Si no se considera una terapia quirúrgica o local-sistémica, debe discutirse en la junta tumoral una terapia sistémica paliativa. Para los tumores no pancreáticos bien diferenciados del “intestino medio”, la terapia con análogos de la somatostatina es el estándar como primera línea de tratamiento. En principio, se dispone de dos terapias diferentes de acción prolongada. Octreotida-LAR demostró una supervivencia libre de progresión prolongada en NET funcionalmente activos e inactivos en un ensayo controlado con placebo (ensayo PROMID) en tumores bien diferenciados del “intestino medio” [18]. El análisis de los datos a largo plazo del estudio PROMID también mostró una tendencia positiva de la octreotida en la prolongación de la supervivencia global a pesar del éxito del paso al brazo de tratamiento (octreotida) tras el progreso [19].
Recientemente también se presentaron datos sobre la lanreotida, que también mostraron una mejora significativa de la supervivencia libre de progresión [20]. Estos preparados no se compararon directamente entre sí y queda por ver cuál de ellos puede utilizarse en cada indicación en la práctica clínica diaria. En el mejor de los casos, la lanreotida se utilizará en tumores más avanzados y con mayor carga tumoral debido al diseño del estudio Clarinet. En los tumores pancreáticos bien diferenciados (pocos de “grado intermedio”), el everolimus demostró una prolongación de la supervivencia libre de progresión y está aprobado como Afinitor® de primera línea en p-NET [21].
El everolimus en combinación con octreotida puede considerarse también para otros NET, por ejemplo de pulmón y colon, debido al impacto positivo en la supervivencia libre de progresión en el ensayo RADIANT-2, que apenas alcanzó la significación estadística [22]. Sutent® también muestra una prolongación de la supervivencia libre de progresión y de la supervivencia global en pacientes con NET bien diferenciados del páncreas [23]. Ambos fármacos son opciones en pacientes con p-NET bien diferenciado. Sin embargo, los efectos secundarios de estas terapias son a veces considerables y deben ser llevadas a cabo por un especialista con experiencia. Las terapias sistémicas mencionadas se utilizan principalmente para el GEP-NET bien diferenciado.
Para los tumores G2 más proliferativos, se utilizan clásicamente quimioterapias combinadas. En particular, las terapias a base de 5-fluorouracilo se utilizan en combinación con estreptozotocina o Temodal® [24,25]. Estas quimioterapias suelen ser relativamente tóxicas, pero pueden ser utilizadas con buen éxito por oncólogos experimentados, especialmente en pacientes con una carga tumoral elevada, síntomas y un crecimiento relativamente rápido. Los pacientes con carcinomas neuroendocrinos de células grandes o pequeñas altamente proliferativos y desdiferenciados suelen beneficiarse de la quimioterapia combinada con cisplatino y etopósido [26]. Los pacientes con una expresión elevada de receptores de somatostatina en la gammagrafía con octreotida o en la PET/TC con galio-68 DOTATATO/DOTATOC pueden ser evaluados para una terapia con radionucleidos basada en péptidos. Esta terapia de radionúclidos administrada sistémicamente irradia los tumores SSTR2-positivos mediante la unión y captación de análogos de la somatostatina radiomarcados. Esta terapia se está investigando actualmente en un ensayo de fase III frente al octreotide-LAR. En ensayos de fase II, esta terapia demostró ser muy eficaz con una tasa muy baja de efectos secundarios [27]. En particular, la frecuentemente mencionada insuficiencia renal se da en menos del 1% de los pacientes. Esta terapia la ofrecen algunos centros en Suiza, como el Centro de Excelencia ENETS del Hospital Universitario de Zúrich o los Hospitales Universitarios de Basilea y Berna. El Hospital Universitario de Basilea ha asumido aquí un papel pionero. Los nuevos enfoques terapéuticos están investigando nuevas combinaciones de la terapia anterior y explorando nuevas vías como la reducción de los síntomas carcinoides [28]. Los análogos de la somatostatina de segunda generación (pasireotida Signifor®) no mostraron un mejor control de los síntomas en un ensayo de fase III, pero sí una prolongación de la supervivencia libre de progresión de cinco meses en comparación con la octreotida-LAR [29].
En general, existe una gran variedad de terapias diferentes para el GEP-NET y éstas deben adaptarse a la localización del tumor primario y a su diferenciación. Esta es una de las razones por las que los pacientes con NET deben ser discutidos en una junta tumoral especializada.
Seguimiento de pacientes con NET
El seguimiento de los pacientes con NET varía en función del tumor primario y de la diferenciación del tumor. En general, los insulinomas benignos tras extirpación, los carcinoides rectales tras extirpación y los carcinoides apendiculares precoces no requieren seguimiento. Las NET gástricas de tipo I necesitan una endoscopia anual. En general, los tumores G1 necesitan un seguimiento por imagen y laboratorio cada doce meses, los tumores G2 cada seis meses y los carcinomas G3 cada tres meses. Se recomienda el exitoso método de puesta en escena [30].
Prof. Dr. med. Niklaus G. Schaefer
Literatura:
- Yao JC, et al: Cien años después del “carcinoide”: epidemiología y factores pronósticos de los tumores neuroendocrinos en 35.825 casos en Estados Unidos. J Clin Oncol 2008; 26(18): 3063-3072.
- Tsikitis VL, Wertheim BC, Guerrero MA: Tendencias de incidencia y supervivencia de los tumores neuroendocrinos gastrointestinales en Estados Unidos: un análisis de Seer. J Cancer 2012; 3: 292-302.
- Rindi G, et al: Estadificación TNM de los tumores (neuro)endocrinos del intestino anterior: una propuesta de consenso que incluye un sistema de gradación. Archivo Virchows 2006; 4; 395-401.
- Rindi G, et al: Estadificación TNM de los tumores endocrinos del intestino medio y posterior (neuro): una propuesta de consenso que incluye un sistema de gradación. Archivo Virchows 2007; 4; 757-762.
- Ruszniewski P, et al: Tumores/carcinomas gástricos bien diferenciados. Neuroendocrinología 2006; 84: 158-164.
- Lawrence B, et al: Una perspectiva clínica de la neoplasia neuroendocrina gástrica. Curr Gastroenterol Rep 2011 feb; 13(1): 101-109.
- Robert T, et al: Tumor/carcinoma duodenal bien diferenciado (excluidos los gastrinomas). Neuroendocrinología 2006; 84: 165-172.
- Falconi M, et al: Tumores/carcinoma pancreáticos no funcionantes bien diferenciados. Neuroendocrinología 2006; 84: 196-211.
- Eriksson B, et al: Directrices de consenso para el tratamiento de pacientes con tumores neuroendocrinos digestivos: tumor/carcinoma yeyuno-ileal bien diferenciado. Neuroendocrinología 2008; 87: 8-19.
- Ramage JK, et al: Directrices de consenso para el tratamiento de pacientes con tumores neuroendocrinos digestivos: tumor/carcinoma bien diferenciado de colon y recto. Neuroendocrinología 2008; 87: 31-39.
- Klöppel G, et al: Directrices de consenso de la ENETS para los estándares de atención en tumores neuroendocrinos: hacia un enfoque estandarizado del diagnóstico de los tumores neuroendocrinos gastroenteropancreáticos y su estratificación pronóstica. Neuroendocrinología 2009; 90: 162-166.
- Sundin A, et al: Directrices de consenso de la ENETS para los estándares de atención en tumores neuroendocrinos: exámenes radiológicos. Neuroendocrinología 2009; 90: 167-183.
- Dik J, et al: Directrices de consenso de la ENETS para los estándares de atención en tumores neuroendocrinos: obtención de imágenes de receptores de somatostatina con 111 in-pentetreotida. Neuroendocrinología 2009; 90: 184-189.
- Plöckinger U, et al: Directrices de consenso de la ENETS para los estándares de atención en tumores neuroendocrinos: ecocardiografía. Neuroendocrinología 2009; 90: 190-193.
- O’Toole D, et al: Directrices de consenso de la ENETS para las normas de atención en tumores neuroendocrinos: marcadores bioquímicos. Neuroendocrinología 2009; 90: 194-202.
- Akerström G, et al: Directrices de consenso de la ENETS para los estándares de atención en tumores neuroendocrinos: terapia pre y perioperatoria en pacientes con tumores neuroendocrinos. Neuroendocrinología 2009; 90: 203-208.
- Kennedy A, et al: Radioembolización para metástasis hepáticas neuroendocrinas irresecables mediante microesferas de resina 90Y: resultados iniciales en 148 pacientes. Am J Clin Oncol 2008; 31: 271-279.
- Rinke A, et al: Estudio controlado con placebo, doble ciego, prospectivo y aleatorizado sobre el efecto de octreotida LAR en el control del crecimiento tumoral en pacientes con tumores neuroendocrinos metastásicos del intestino medio: un informe del Grupo de Estudio PROMID. J Clin Oncol 2009 oct 1; 27(28): 4656-4663.
- Arnold R, et al: Estudio controlado con placebo, doble ciego, prospectivo y aleatorizado sobre el efecto del octreotide LAR en el control del crecimiento tumoral en pacientes con tumores neuroendocrinos metastásicos de intestino medio (PROMID): Resultados sobre la supervivencia a largo plazo. J Clin Oncol 2013; 31 (suppl; abstr 4030).
- www.esmo.org/Conferences/Past-Conferences/European-Cancer-Congress-2013/News/Phase-III-Trial-Results-Favour-Lanreotide-Therapy-in-Patients-with-Gastroenteropancreatic-Neuro-Endocrine-Tumours.
- Yao JC, et al: Everolimus para tumores neuroendocrinos pancreáticos avanzados. N Engl J Med 2011 Feb 10; 364(6): 514-523.
- Pavel ME, et al: Everolimus más octreotida de acción prolongada repetible para el tratamiento de tumores neuroendocrinos avanzados asociados a síndrome carcinoide (RADIANT-2): un estudio aleatorizado, controlado con placebo, de fase 3. Lancet 2011 dic 10; 378(9808): 2005-2012.
- Raymond E, et al: Malato de sunitinib para el tratamiento de los tumores neuroendocrinos pancreáticos. N Engl J Med 2011 Feb 10; 364(6): 501-513.
- Engstrom PF, et al: Tratamiento con estreptozocina más fluorouracilo frente a doxorrubicina para el tumor carcinoide metastásico. J Clin Oncol 1984 Nov; 2(11): 1255-1259.
- Strosberg JR, et al: Quimioterapia de primera línea con capecitabina y temozolomida en pacientes con carcinomas endocrinos pancreáticos metastásicos. Cáncer 2011 Ene 15; 117(2): 268-275.
- Fazio N, Spada F, Giovannini M: Quimioterapia en los carcinomas neuroendocrinos (CNE) gastroenteropancreáticos (GEP): una visión crítica. Cancer Treat Rev 2013 mayo; 39(3): 270-274.
- Kwekkeboom DJ, et al.: Tratamiento con el análogo de la somatostatina radiomarcado [177 Lu-DOTA 0,Tyr3]octreotate: toxicidad, eficacia y supervivencia. J Clin Oncol 2008 1 de mayo; 26(13): 2124-2130.
- http://telotristat-telestar.com/what-is-the-telestar-trial.php.
- Wolin EM, et al: Estudio multicéntrico, aleatorizado, ciego, de fase III de pasireotida LAR frente a octreotida LAR en pacientes con tumores neuroendocrinos (NET) metastásicos con síntomas relacionados con la enfermedad controlados inadecuadamente con análogos de la somatostatina. J Clin Oncol 2013; 31 (suppl; abstr 4031).
- Arnold R, et al: Directrices de consenso de la ENETS para las normas de atención en tumores neuroendocrinos: seguimiento y documentación. Neuroendocrinología 2009; 90: 227-233.
InFo Oncología y Hematología 2014; 2(5): 14-18