Los anteriores criterios de clasificación del lupus eritematoso sistémico (LES) se originaron en 1982 y sólo se modificaron ligeramente en 1997. Por lo tanto, ya es hora de abordar la cuestión e incorporar el estado actual de la investigación, así como los nuevos hallazgos. En el futuro, cabe esperar la aprobación de varias sustancias activas nuevas.
En 2019, la Liga Europea contra el Reumatismo (EULAR) y el Colegio Americano de Reumatología (ACR) desarrollaron y publicaron conjuntamente nuevos criterios de clasificación del LES [1]. Una diferencia importante con respecto a los criterios antiguos es que la detección de anticuerpos antinucleares (ANA) se considera ahora un mejor criterio de entrada que de clasificación debido a su alta sensibilidad pero su especificidad limitada. Además, los criterios individuales, como la indicación de úlceras en la mucosa oral frente a la nefritis lúpica confirmada histológicamente, deben ponderarse de forma diferente en función de su importancia.
Nuevos criterios, ámbitos y ponderaciones
“Se requiere la detección positiva de anticuerpos antinucleares (ANA) en células HEp2 como requisito previo para la aplicación de los nuevos criterios, pero sólo es necesario que se hayan detectado una vez con un nivel de título de 1:80”, explicó el Prof. Dr. Christof Specker, Director de la Clínica de Reumatología e Inmunología Clínica, Evangelisches Krankenhaus, Kliniken Essen-Mitte. Este valor del título se basa en un metaanálisis de 64 publicaciones. Esto demostró que para un título de 1:80, había una sensibilidad del 98% con una especificidad del 75%. A 1:160, la especificidad era claramente superior, del 86%, pero la sensibilidad era entonces sólo del 96%. Para no excluir a ningún paciente con LES en la medida de lo posible, se eligió el título con mayor sensibilidad. “Hay que tener en cuenta que prácticamente no hay LES sin ANA, pero con una especificidad del 75%, uno de cada cuatro no tiene lupus en absoluto”, afirma el experto. “Y nota bene: ¡Más del 12% de la población normal tiene ANA de hasta 1:320!” El valor de ANA es, por tanto, un criterio de entrada, pero ciertamente no suficiente por sí solo para derivar un diagnóstico.
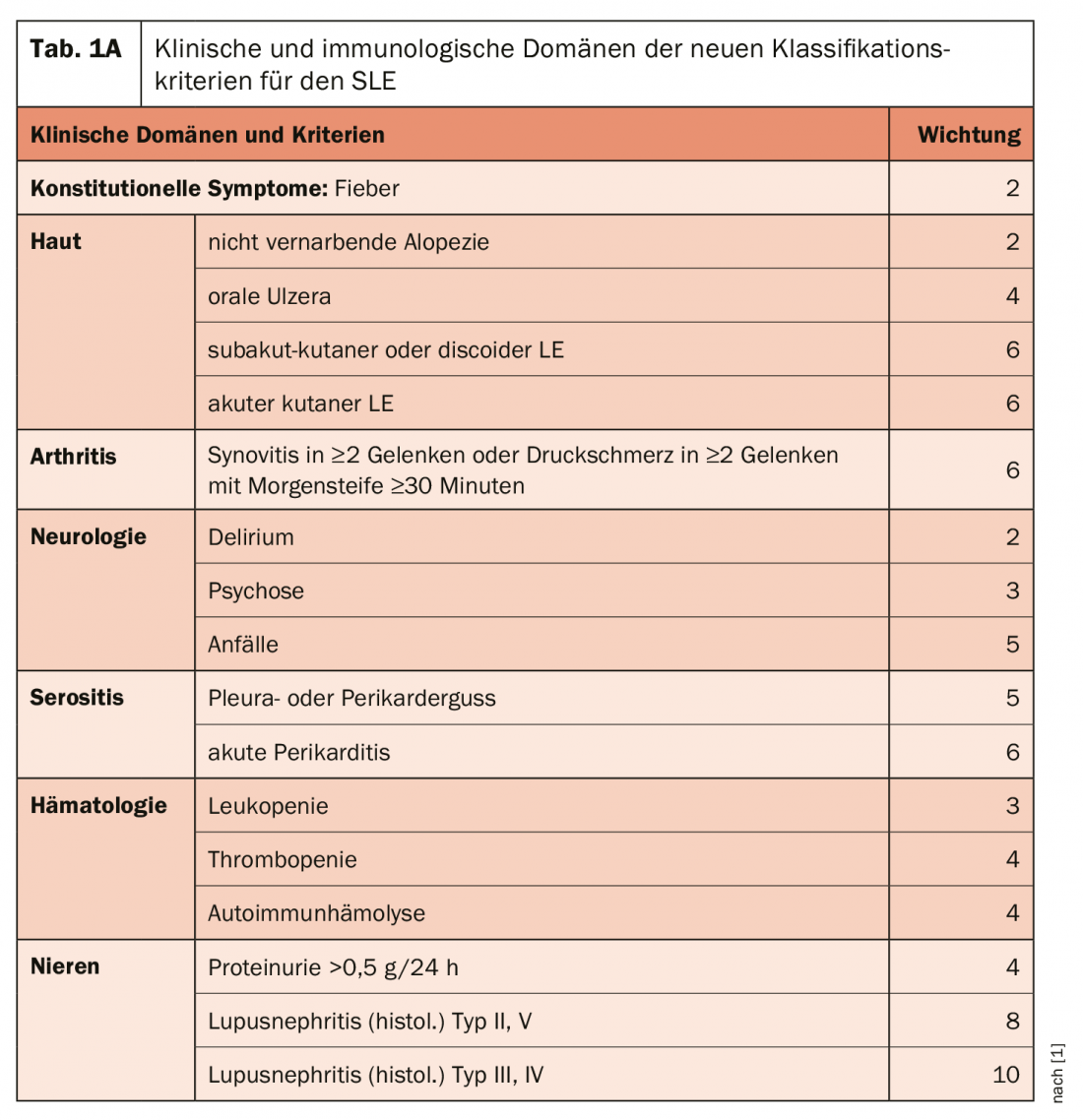
El ámbito de los síntomas constitucionales es nuevo: La fiebre sin otra causa aparece como un síntoma frecuente en el lupus y recibe una ponderación de 2 Puntos (Tab. 1a+b). Dentro de cada dominio, sólo el valor más alto se incluye en la puntuación total, lo que permite clasificar a un paciente como LES si obtiene 10 puntos o más. “Así que no es como en el pasado, cuando se podían “acumular” puntos con diferentes criterios dentro de, por ejemplo, el ámbito de la piel, y obtener 10 o más puntos. Uno de los factores más importantes es, por supuesto, la situación renal: la evidencia histológica de nefritis lúpica proliferativa (tipo III y IV) por sí sola ya da 10 puntos. puntos y, por tanto, sería suficiente por sí sola (junto con la detección de ANA) para clasificar el lupus. Por el lado del dominio inmunológico -se requiere un dominio clínico y otro inmunológico, pero el inmunológico ya se da con los ANA-, los autoanticuerpos altamente específicos también reciben la máxima calificación. Sin embargo, no debe juzgarse si otras razones (infecciones, medicación, otras enfermedades) pueden explicar también o mejor los síntomas.

Los nuevos criterios de clasificación del LES deberían -si se utilizan correctamente- ser mejores que los criterios anteriores del ACR y el SLICC, según el Prof. Specker. Las ventajas son la ponderación y la mejor integración de los parámetros inmunológicos, que también deberían captar mejor los casos precoces. Por otro lado, existen desventajas como una complejidad algo mayor y el título límite muy bajo para la detección de anticuerpos antinucleares como criterio de entrada. La elevada ponderación de la artritis (6 puntos) es motivo para prestar especial atención a que no esté provocada por otras causas, advirtió el reumatólogo.
Recomendaciones de gestión
En 2019 se ha publicado una actualización de las recomendaciones EULAR sobre el manejo del LES [2]. Los “principios generales” que precedieron a las recomendaciones incluyen la afirmación de que el tratamiento del LES con riesgo para los órganos o la vida consiste en una fase inicial de terapia inmunosupresora de alta intensidad para controlar la actividad de la enfermedad, seguida de una fase más larga de terapia menos intensiva para consolidar la respuesta y prevenir las recaídas.
El tratamiento debe tener como objetivo la remisión o una baja actividad de la enfermedad (nivel de evidencia 2b/fuerza de recomendación B) y la prevención de recaídas (2b/B) en todos los órganos, con la dosis más baja posible de glucocorticoides. Las recaídas del LES pueden tratarse ajustando la dosis de las terapias actuales (glucocorticoides, inmunomoduladores), cambiando o añadiendo nuevas terapias, en función de la gravedad de la afectación orgánica.
El fármaco antipalúdico hidroxicloroquina (HCQ) sigue siendo el tratamiento básico para los pacientes de lupus. Se recomienda HCQ para todos los pacientes con LES (a menos que esté contraindicado) a una dosis que no supere los 5 mg/kg de peso corporal. A menos que existan factores de riesgo de toxicidad retiniana , debe realizarse un examen oftalmológico (examen del campo visual y/o tomografía de coherencia óptica) al inicio de la terapia, después de 5 años y anualmente a partir de entonces.
Según el tipo y la gravedad de la afectación orgánica, los glucocorticoides (GC) pueden utilizarse en diferentes dosis y vías de administración. La terapia de pulso con metilprednisolona intravenosa (normalmente 250-1000 mg al día durante 1-3 días) proporciona un efecto terapéutico inmediato y permite dosis iniciales más bajas de GC oral. En la terapia de mantenimiento a largo plazo, el GC debe reducirse a menos de 7,5 mg/día (equivalente de prednisona) y, si es posible, suspenderse por completo.
Entre las terapias inmunosupresoras, el metotrexato ha pasado al frente porque ahora cuenta con las mejores pruebas. En los pacientes que no respondan a la HCQ (sola o en combinación con GC) o que no puedan reducir la GC por debajo de una dosis aceptable para una terapia a largo plazo, debe considerarse la adición de agentes inmunomoduladores/inmunosupresores como el metotrexato (1b/B), la azatioprina (2b/C) o el micofenolato (2a/B). En las enfermedades que ponen en peligro los órganos, los agentes inmunomoduladores/inmunosupresores pueden incluirse ya en la terapia inicial. La ciclofosfamida puede utilizarse para el LES grave, potencialmente mortal o que pone en peligro los órganos.
Entre los biológicos, el único disponible hasta ahora es el belimumab, que puede considerarse adicionalmente en pacientes con una respuesta insuficiente a la terapia estándar (combinaciones de HCQ y GC con o sin inmunosupresores). En cursos con peligro para los órganos, refractarios o cuando existen intolerancias/contraindicaciones a los inmunosupresores estándar, puede considerarse el rituximab (off label).
Nuevas opciones terapéuticas
El belimumab es la única terapia dirigida para el LES hasta la fecha. Sin embargo, hay relativamente muchas sustancias en fase de desarrollo clínico. La voclosporina (VCS), por ejemplo, es un nuevo inhibidor de la calcineurina que puede utilizarse para tratar la nefritis lúpica. El VCS es un inmunosupresor “diseñado” para su uso en trasplantes de órganos y enfermedades autoinmunes. Se dice que el análogo tiene niveles de acción más estables y no es tan nefrotóxico como el CSA en su uso a largo plazo. En estudios, se ha probado en las indicaciones de nefritis lúpica, psoriasis y trasplante renal. En un estudio de fase 2 de 265 pacientes con NL activa (III-IV), se administraron 23,7 o 39,5 mg de VCS frente a placebo dos veces al día, además de MMF (2 g/d) y GC. Después de un año con VCS 23,7, el 29,4% de los sujetos logró una remisión renal completa (VCS 39,5: 39,8%), en comparación con sólo el 23,9% en el brazo placebo. Por tanto, esto habla en favor de un efecto adicional del CNI en el tratamiento del LN con MMF, comentó el Prof. Specker. “Así que si el VCS sale al mercado, podría obtener una autorización de comercialización, y sería una buena alternativa al tacrolimus, que está fuera de etiqueta”.
Una nueva sustancia es el obinutuzumab (OBI). Al igual que el rituximab, también se trata de un anticuerpo anti-CD20. La administración también es similar, con 1000 mg dos veces a intervalos de 14 días y una repetición a los 6 meses. La OBI ya se utiliza de forma relativamente generalizada en hematooncología. De nuevo, hubo un criterio de valoración primario de remisión renal completa en un estudio. Como resultado, se produjo una mejora significativa de la serología frente al placebo, no aumentó la tasa de EA graves (14,3% frente a 21,0%) y no se produjeron infecciones graves (1,6% frente a 12,9%). Las reacciones relacionadas con la infusión fueron naturalmente más frecuentes con OBI (15,9% frente a 9,7%). Se está planeando un ensayo de fase 3 “y realmente no puedo imaginar, dados los resultados obtenidos hasta ahora, que esto no vaya a funcionar”, se mostró confiado el Prof. Specker.
El interferón-α (IFNα) se considera desde hace tiempo un objetivo prometedor para la terapia del LES. El anifrolumab (ANFR) es un anticuerpo monoclonal que no se dirige directamente contra el IFNα sino contra su receptor (IFNAR1), que antagoniza no sólo los efectos del IFNα sino también los de otros interferones. Con TULIP-1 y TULIP-2, se realizaron dos estudios de fase 3 sobre el efecto del ANFR en el LES, con resultados casi contradictorios. Los dos estudios apenas diferían entre sí: los criterios de inclusión y exclusión, el diseño del estudio e incluso el tamaño de los grupos eran prácticamente idénticos. Sin embargo, el criterio de valoración primario de una respuesta al SRI-4, definido inicialmente de la misma forma que en el TULIP-1, se cambió después en el TULIP-2 antes de desenmascarar y tras consultar con la FDA a la denominada respuesta BICLA en la semana 52 con SOC estable.
El ensayo TULIP-1 formó parte de una serie de ensayos fallidos sobre el LES, por lo que resultó decepcionante. Sin embargo, en TULIP-2, el anifrolumab fue superior al placebo en casi todos los criterios de valoración, incluida la actividad de la enfermedad, la afectación cutánea y la necesidad de GC. No hubo nuevas señales de seguridad en ninguno de los dos estudios. La tendencia a favorecer las infecciones por herpes zóster ya era conocida para las terapias anti-IFNα y también se confirmó para el ANFR en ambos estudios. El éxito del ensayo TULIP-2 -con un “procedimiento de aprobación acelerado” ya prometido por la FDA- conducirá muy probablemente a la aprobación de este nuevo principio terapéutico para el LES, predijo el Prof. Specker. Sin embargo, sigue sin estar claro cómo pudieron producirse las sorprendentes diferencias en los resultados de estos dos estudios casi idénticos. Según el experto, un cambio posterior del criterio de valoración primario no habría sido necesario en absoluto, el índice de respuesta SRI-4 también se alcanzó en el TULIP-2, y si se comparan los estudios en términos de diferencia entre la respuesta al placebo y la respuesta SRI-4, se llega a diferencias de más de 22 puntos porcentuales (Tab. 2). “No me pregunte cómo explicarlo, yo tampoco lo sé”, expresó su perplejidad el experto.

Belimumab con ventajas en LN
También hay noticias sobre el uso de belimumab para el mantenimiento de la remisión en la nefritis lúpica (NL). Hasta ahora, siempre se ha dicho que el Belimumab es inútil para la nefritis, “y para la terapia de inducción lo es”, explicó el Prof. Specker. Sin embargo, en el ensayo de fase 3 BLISS-LN, 448 pacientes con LES y nefritis lúpica activa fueron tratados inicialmente de forma convencional con dosis altas de glucocorticoides + ciclofosfamida i.v. (CYC) o glucocorticoides + micofenolato mofetil (MMF) y entraron en remisión. Tras esta terapia de inducción de dos meses, los pacientes fueron aleatorizados 1 a 1: Los que antes recibían CYC pasaron a ser tratados con azatioprina (AZA). Los que recibieron MMF antes siguieron recibiéndolo. Durante un periodo de 24 meses, los pacientes del tratamiento de mantenimiento de ambos brazos también se dividieron en un grupo cada uno que recibió belimumab adicional (10 mg/kg/mes) o placebo en infusión.
El criterio de valoración primario se definió como una TFGe ≥60 ml/min/1,73m2 o ningún descenso de la TFGe con respecto al valor basal previo a la NL de más del 20%, un cociente proteína creatinina en orina (uPCR) de ≤0,7 y ningún fracaso del tratamiento o recaída. El criterio de valoración secundario más estricto de remisión renal completa (RRC) se definió como una TFGe en el rango normal o no más de un 10% por debajo del valor basal y una uPCR <0,5.
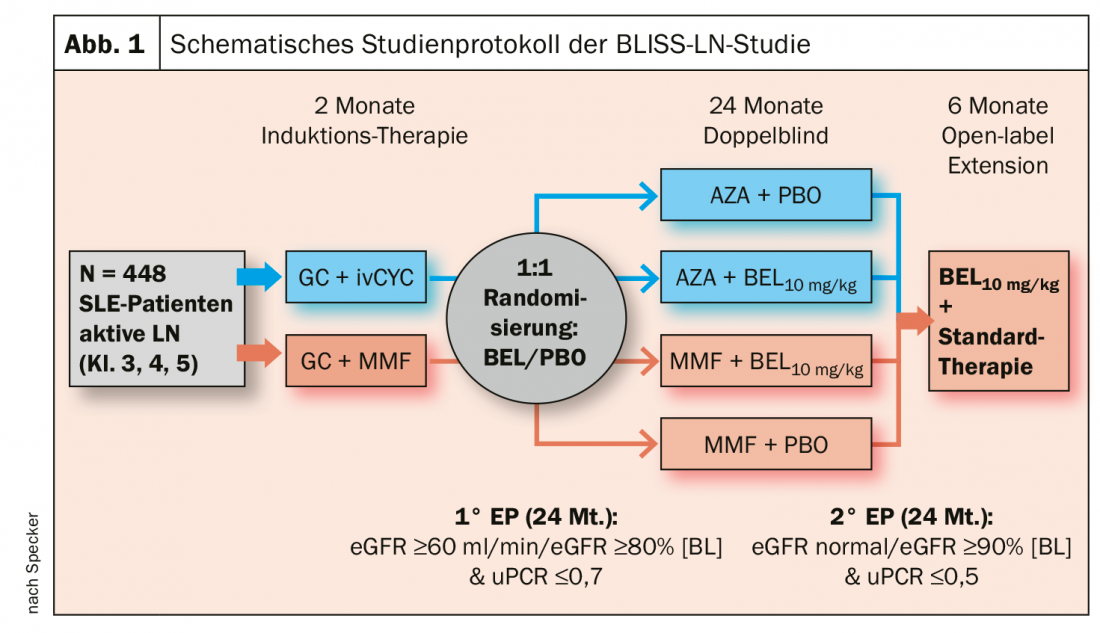
El criterio de valoración primario se alcanzó en la semana 104 en un 43% con BEL + tratamiento estándar (SOC) y en un 32% con placebo. El aumento del 11% fue estadísticamente significativo (OR 1,44; IC 95%: 1,04-2,32; p=0,03) (Fig. 1). También se demostró una ventaja estadísticamente significativa del belimumab sobre el placebo en los criterios de valoración secundarios más importantes, señaló el experto. Su conclusión: La administración adicional de BEL en la terapia de mantenimiento de la nefritis lúpica reduce el riesgo de recaída. Por lo tanto, el Prof. Specker también espera a medio plazo la aprobación del belimumab como terapia complementaria para estos casos de tratamiento. Según él, la única cuestión que podría quedar abierta es si esto se aplicará también a la terapia s.c., que ahora está disponible y es más fácil de manejar.
Fuente: Rheuma Update Wiesbaden (D)
Literatura:
- Aringer M, et al: Ann Rheum Dis 2019; 78(9): 1151-1159.
- Fanouriakis A, et al: Ann Rheum Dis 2019; 78(6): 736-745.
InFo DOLOR Y GERIATRIA