El carcinoma de células renales es una de las entidades tumorales más raras. Por lo tanto, las opciones de tratamiento fueron muy limitadas durante años y la terapia resultaba difícil. Mientras tanto, las opciones podrían ampliarse con los inhibidores de la tirosina quinasa. La terapia con inhibidores de los puntos de control también es concebible.
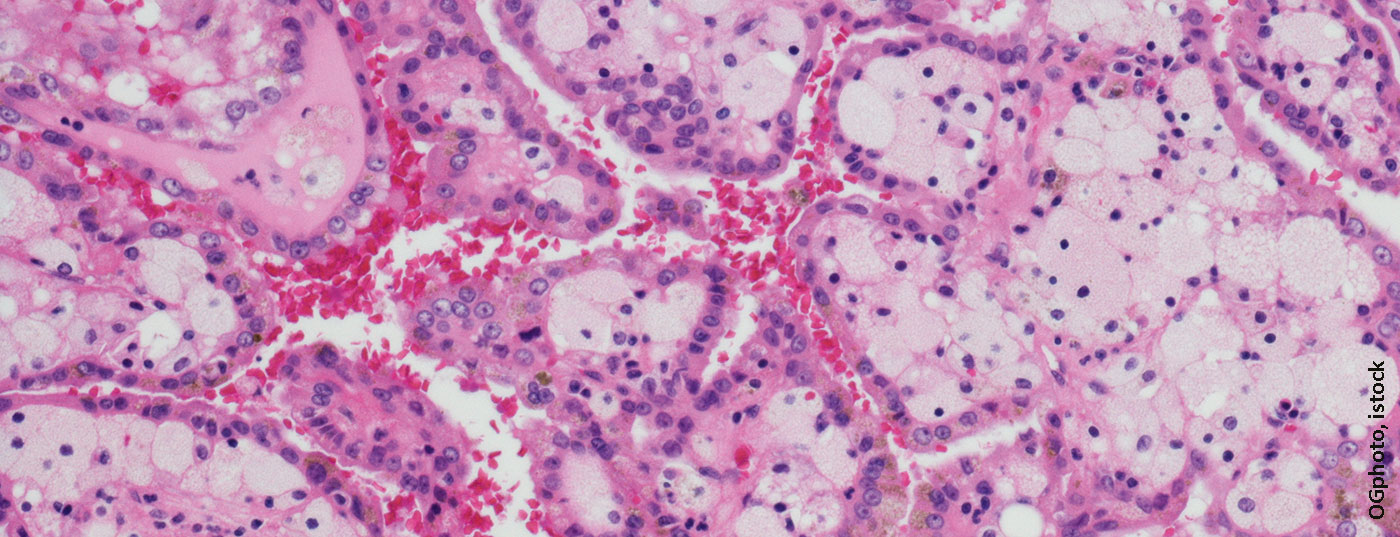
Con una cuota del 2,4% de los nuevos casos de cáncer al año en Suiza, el carcinoma de células renales es una de las entidades tumorales más raras [1]. El carcinoma de células renales de células claras es el subgrupo más numeroso de todos los carcinomas de células renales y representa aproximadamente el 75% [2]. Los factores de riesgo importantes para el desarrollo de tumores renales son el consumo de nicotina, la obesidad, la exposición laboral a disolventes, petrolatos y herbicidas [3,4]. Aproximadamente el 2% de todos los carcinomas de células renales están asociados a síndromes de predisposición tumoral, como la enfermedad de von Hippel-Lindau [5].
Aproximadamente el 12% de los nuevos diagnósticos son tumores metastásicos primarios debido a la presencia de metástasis a distancia [6]. Durante muchos años, las opciones de tratamiento para el carcinoma de células renales metastásico eran muy limitadas y el tratamiento resultaba difícil. En 2007, se demostró por primera vez que el sunitinib como tratamiento de primera línea en el contexto metastásico, una sustancia del grupo de los inhibidores de la tirosina cinasa (ITC), prolongaba la supervivencia libre de progresión (SLP) y aumentaba la tasa de respuesta en comparación con el interferón alfa [7]. Poco más de 10 años después, el ensayo de fase III CheckMate-214 demostró la superioridad del inhibidor del punto de control (IPC) nivolumab en combinación con el inhibidor de CTLA-4 ipilimumab sobre la terapia estándar sunitinib que se había utilizado hasta entonces [8]. A este estudio le siguieron otros, algunos con IPC solo o también terapias combinadas con IPC y TKI (Fig. 1 ). Este artículo del CME trata exclusivamente del tratamiento del carcinoma de células renales de células claras en situación metastásica.
Clasificación del riesgo
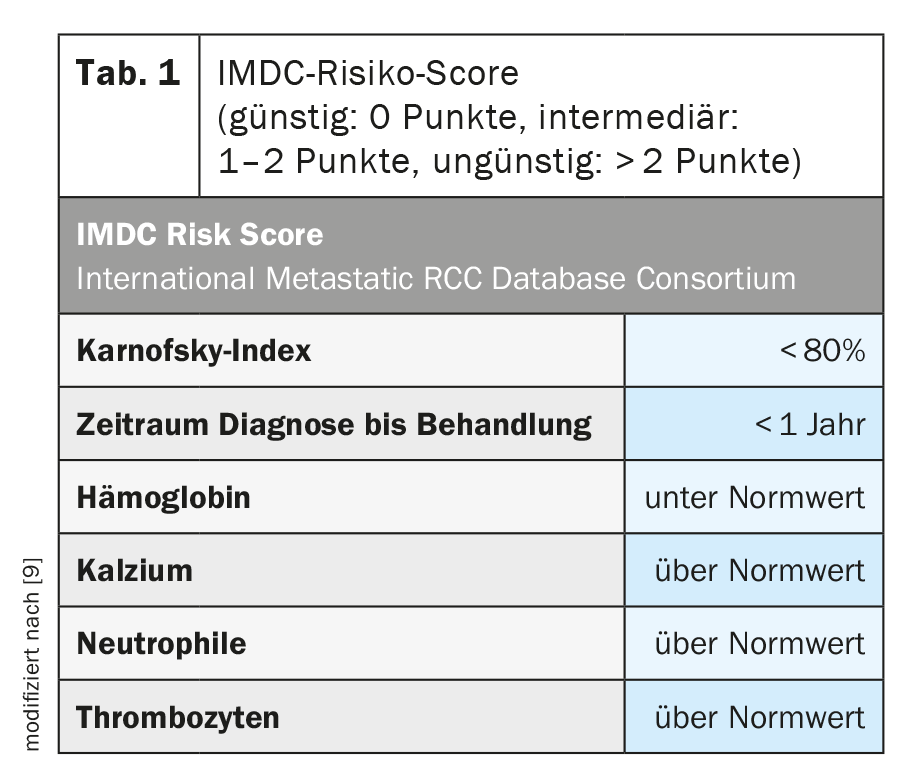
Para una mejor evaluación de la situación del tumor, así como de su pronóstico, se elaboró una clasificación de riesgo (Tab. 1) . En función de la puntuación obtenida en la puntuación de riesgo IMDC, la enfermedad puede clasificarse en los siguientes grupos de riesgo: favorable, intermedio o desfavorable. Esta clasificación no sólo es importante para estimar el pronóstico, sino que también se incluyó y se incluye en los estudios clínicos para la estratificación y ha demostrado ser predictiva para las intervenciones terapéuticas [10].
Terapia de primera línea
El tratamiento del carcinoma metastásico de células renales ha cambiado significativamente en los últimos años debido al uso de nuevos fármacos de grupos de sustancias conocidas (por ejemplo, los TKI), pero también a la aplicación de nuevas opciones terapéuticas, como la inmunoterapia. En 2018, el ensayo CheckMate-214 demostró una mejora de la tasa de respuesta objetiva y de la supervivencia global (SG) con ipilimumab en combinación con nivolumab en comparación con sunitinib. La SG fue de 47 meses en el brazo de ipilimumab/nivolumab frente a 26,6 meses en el brazo de sunitinib, con un cociente de riesgos instantáneos (CRI) de 0,66 (p<0,0001) [11]. Este efecto del tratamiento se limita en los análisis a los pacientes con un riesgo IMDC intermedio o desfavorable. En una constelación de riesgo favorable, el sunitinib muestra una mejor tasa de respuesta global y también una mejor SG en comparación con la inmunoterapia.
Siguieron otros estudios en la terapia de primera línea del carcinoma metastásico de células renales. El ensayo Keynote 426 comparó la combinación del inhibidor de PD-1 pembrolizumab y el TKI axitinib con el sunitinib solo. La combinación terapéutica mejoró significativamente tanto la SG como la SLP en comparación con el sunitinib (p<0,001) [12]. Estos resultados se observaron en los tres grupos de riesgo de IMDC: favorable, intermedio y desfavorable .
Tanto en el ensayo Checkmate-214 como en el Keynote-426, se observó una remisión completa (RC) en aproximadamente el 9% de los enfoques inmunoterapéuticos.
En el congreso de la ESMO de este año se presentaron los datos del ensayo CheckMate 9ER, que compara la terapia combinada de nivolumab y cabozantinib frente a sunitinib, también en terapia de primera línea [13]. En el proceso, Choueiri et al. demostró que esta terapia combinada lograba una mejora significativa de la SLP de 8,3 meses (monoterapia con sunitinib) a 16,6 meses (nivolumab + cabozantinib). También se encontró una SG prolongada con un HR de 0,60. La tasa de respuesta objetiva (ORR) fue particularmente impresionante, con un 55,7% en el brazo de combinación frente al 27,1% con sunitinib. El periodo de observación de 18 meses hasta la fecha sigue siendo relativamente corto, por lo que en la actualidad todavía no está claro hasta qué punto la respuesta terapéutica es a más largo plazo.
Las comparaciones entre estos tres estudios son difíciles porque se incluyeron diferentes grupos de pronóstico y la distribución de los pacientes en los mismos fue diferente. Los tiempos de observación también difieren considerablemente. Los regímenes combinados de IPC con TKI (Keynote-426 y CheckMate 9ER) ya mostraron una diferencia en la supervivencia global después de un mes, mientras que la combinación de ipilimumab y nivolumab sólo mostró una diferencia después de 6 meses. En consecuencia, la decisión terapéutica podría recaer en una terapia combinada de TKI en lugar de la inmunoterapia sola en caso de presión terapéutica elevada.
Para el tratamiento de primera línea del carcinoma metastásico de células renales, también existen datos de ensayos sobre el tratamiento con avelumab en combinación con axitinib (ensayo JAVELIN-Renal-101) [14]. Esto demostró una SLP prolongada en comparación con el sunitinib, pero no mostró este beneficio en los datos de SG. En Suiza no se solicita la aprobación de la combinación avelumab + axitinib.
La terapia con un inhibidor de la tirosina quinasa solo sigue siendo una opción en ausencia de disponibilidad o contraindicaciones para una de las nuevas terapias combinadas estándar, especialmente para pacientes con riesgo favorable y una dinámica de la enfermedad muy lenta.
La vigilancia activa también es posible en pacientes bien seleccionados, como muestra una publicación de Rini et al. La mediana del tiempo de observación de los pacientes hasta el inicio de la terapia sistémica fue de 14,9 meses [15].
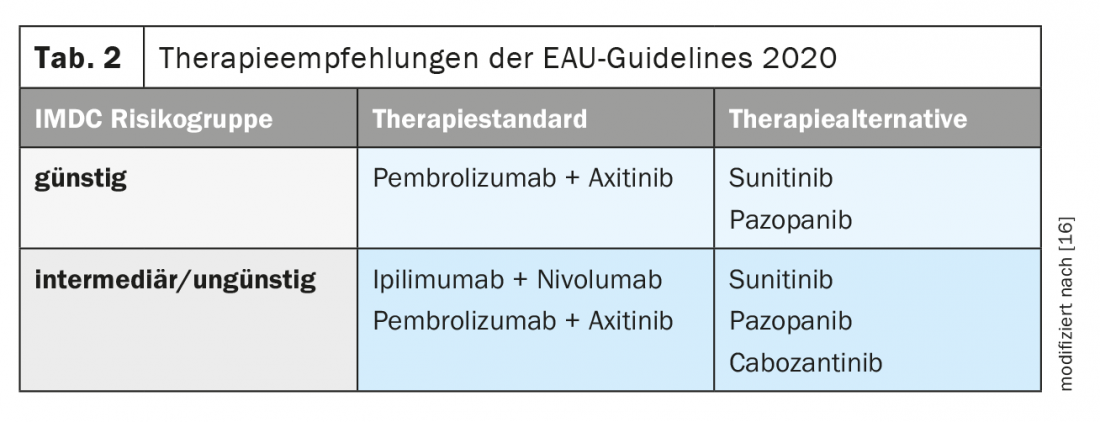
En la directriz actual sobre el carcinoma de células renales de la Asociación Europea de Urología (EAU), se registraron las recomendaciones de tratamiento (Tab. 2) [16].
Aún están pendientes los resultados del ensayo de fase III CLEAR, que está comparando la combinación de lenvatinib + everolimus o lenvatinib + pembrolizumab con sunitinib solo como tratamiento de primera línea en el carcinoma metastásico de células renales con un diseño de 3 brazos. El lenvatinib y el inhibidor de la PD-1 mostraron resultados prometedores en el cáncer de endometrio avanzado en un estudio publicado este año [17].
Terapia de segunda línea
La elección de la clase de sustancia para la terapia de dos líneas depende directamente de la terapia de primera línea ya administrada. En el estudio de fase III Checkmate-025, se comparó el nivolumab con el everolimus tras 1-2 terapias previas dirigidas contra el VEGF. La inmunoterapia mejoró tanto la SG como la calidad de vida. La toxicidad de grado 3/4 también fue menos frecuente con nivolumab en comparación con everolimus (19% frente a 37%). No se observó ninguna mejora en la SLP [18]. También se pudo demostrar una mejora comparable de la SG, es decir, de aproximadamente 5 meses, con cabozantinib en comparación con la terapia con everolimus (estudio Meteor) [19].
La influencia de la terapia de primera línea con inhibidores de los puntos de control sobre las terapias sistémicas posteriores no está clara, ya que hasta la fecha no se dispone de datos de ensayos aleatorizados. Sin embargo, actualmente se está reclutando en Suiza un ensayo de fase II (CaboPoint), en el que se investiga el cabozantinib como terapia de segunda línea – en la cohorte A tras una terapia de primera línea con ipiliumumab y nivolumab y en la cohorte B en caso de progresión a una terapia combinada IPC y terapia dirigida al VEGF.
Además, en un ensayo de fase III también disponible en Suiza, la molécula MK-6482 PN011 -un inhibidor de HIF-2α- se está comparando con el cabozantinib en combinación con lenvatinib como terapia de dos líneas. El HIF, como factor inducido por la hipoxia, está implicado en la expresión de los factores de crecimiento VEGF.
En ASCO 2020 se presentaron los datos de un ensayo de fase II de lenvatinib + pembrolizumb tras progresión en terapia con IPC PD-1/PD-L1. La ORR tras 24 semanas fue del 55% (irRECIST según la evaluación del investigador), la SLP de 11,7 meses. Así pues, este tratamiento parece prometedor incluso después de una inmunoterapia previa [20].
Perfil de efectos secundarios
Debido a los diferentes mecanismos de acción de las clases de sustancias utilizadas en el carcinoma metastásico de células renales, también existen diferentes perfiles de efectos secundarios. En el caso de las inmunoterapias, se trata de los llamados efectos secundarios inmunomediados, por los que son posibles reacciones en los órganos más diversos y los efectos secundarios a veces también pueden ser graves. Es crucial conocerlos, reconocerlos y tratarlos en una fase temprana. Hay que tener en cuenta los efectos secundarios especialmente raros, como la miocarditis y la neurotoxicidad [21,22]. Por lo tanto, la administración de inmunoterapias, así como la atención posterior al paciente, debe correr a cargo de un equipo de médicos experimentados, por lo que suele ser conveniente un enfoque interdisciplinar. El estudio CheckMate-214 demostró que la calidad de vida relacionada con la salud era mejor en los pacientes tratados con ipilimumab + nivolumab en comparación con el sunitinib solo [23]. En consecuencia, la incidencia de acontecimientos adversos de grado 3/4 fue mayor con el sunitinib. Los efectos secundarios más comunes de los TKI incluyen diarrea, toxicidad cutánea, fatiga y posibles alteraciones hematológicas y cardiacas.
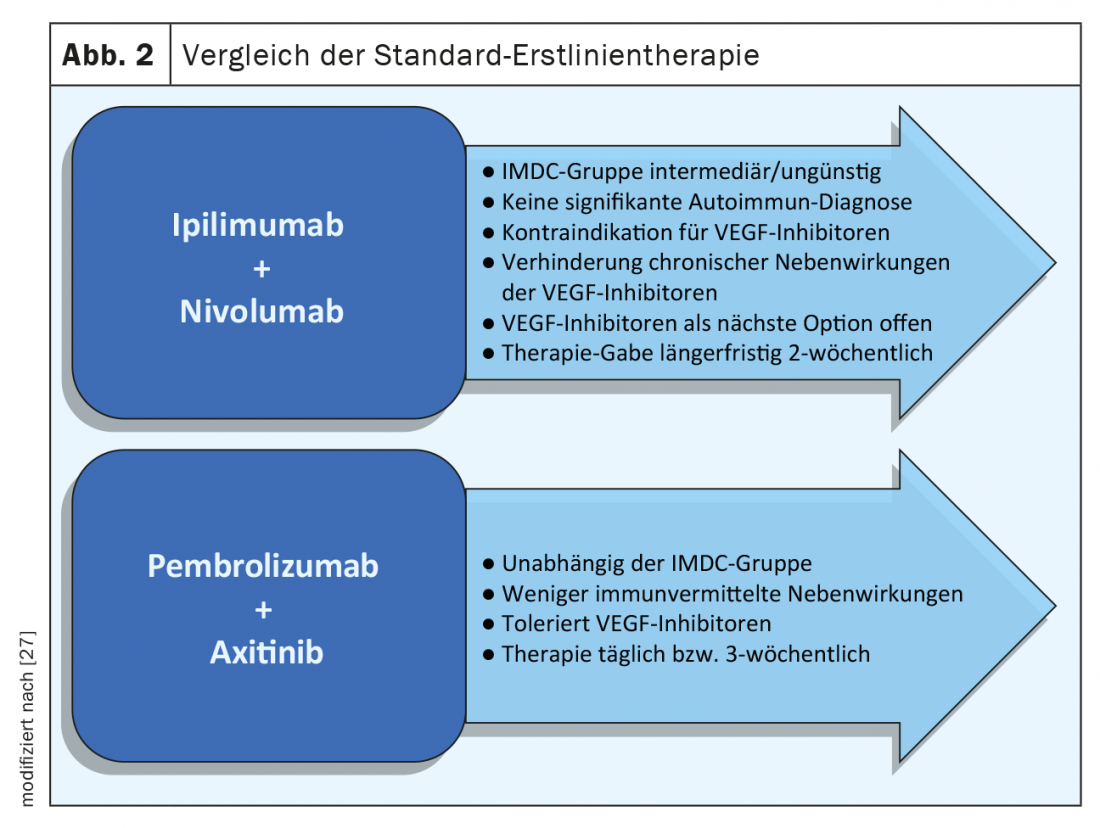
Además de las diferentes clases de sustancias, también existen diferencias en los intervalos de aplicación y terapia. Mientras que ipilimumab/nivolumab se cambia a nivolumab solo al cabo de tres meses, las terapias combinadas IPC y TKI implican la ingesta continua de comprimidos con terapia de infusión adicional, cuyas toxicidades a largo plazo deben tenerse en cuenta. La terapia con comprimidos es fácilmente controlable y los efectos secundarios suelen ser rápidamente reversibles tras su interrupción (Fig. 2) . Para apoyar a los pacientes y mejorar la adherencia y la seguridad, pueden utilizarse los folletos de la Sociedad Suiza de Oncología Médica (SGMO) y de Oncology Care Switzerland (OPS) [24].
Marcadores moleculares
Los marcadores moleculares podrían ayudar a elegir el mejor tratamiento entre las numerosas opciones terapéuticas. Sin embargo, aparte de la puntuación de riesgo IMDC, no existe ningún marcador predictivo reconocido que pueda utilizarse en la toma de decisiones.
Según los datos de Checkmate-214, la expresión de PD-L1 parece ser importante para la respuesta al tratamiento con ipilimumab/nivolumab (expresión de PD-L1 <1%: ORR 37%; expresión de PD-L1 ≥1%: ORR 54%) y para la SLP (expresión de PD-L1 <1%: SLP 11 meses; expresión de PD-L1 ≥1%: SLP 22,8 meses predictiva [10]. Sin embargo, no hubo diferencias en cuanto al sistema operativo. Así pues, la importancia de -PD-L1 sigue siendo controvertida. En el estudio Keynote-426, así como en el estudio CheckMate-9ER, no se ha observado hasta ahora ninguna correlación entre el nivel de expresión de PD-L1 y la respuesta a la terapia.
El ensayo IMmotion151 comparó atezolizumab/bevacizumab con sunitinib [25]. Además, se llevaron a cabo varios análisis de biomarcadores, en los que no se pudo demostrar ninguna correlación entre la SLP y la “carga mutacional tumoral” (CMT). Sin embargo, se ha demostrado que firmas específicas de expresión génica están asociadas a los efectos del tratamiento. Por ejemplo, la detección de una firma de angiogénesis se correlacionó con la respuesta al sunitinib. Por el contrario, una firma de efectores T mostró un beneficio de la inmunoterapia con atezolizumab [26]. En el estudio BIONIKK, un estudio prospectivo aleatorizado de fase II presentado en la ESMO de este año, se investigaron diferentes grupos moleculares con respecto a la respuesta terapéutica a las distintas sustancias terapéuticas. Esto demostró una mejor respuesta de los tumores “inmuno-altos” a la inmunoterapia con nivolumab y de los tumores “angio-altos” a la terapia con TKIs. Estas investigaciones moleculares parecen prometedoras y probablemente estarán disponibles en el futuro para ayudar en la elección de la terapia.
Además de estos marcadores moleculares del tumor, en la actualidad también se tienen en cuenta factores relacionados con el paciente, como la edad, las comorbilidades y las preferencias, a la hora de decidir el tratamiento.
Mensajes para llevarse a casa
- El tratamiento estándar actual en primera línea del carcinoma de células renales metastásico de células claras es pembrolizumab/auxinib para todos los grupos de riesgo e ipilimumab/nivolumab para los pacientes con riesgo intermedio o desfavorable (IMDC).
- Se puede realizar una vigilancia activa en pacientes seleccionados y considerar la monoterapia con un inhibidor de la tirosina quinasa si el riesgo es favorable.
- Existen nuevos datos sobre el nivolumab en combinación con cabozantinib, aunque todavía no se ha aprobado en Suiza.
- El perfil de efectos secundarios de los distintos fármacos difiere y puede ser decisivo para la elección de la terapia.
- Los estudios sobre las firmas de expresión genética muestran diferentes respuestas terapéuticas y son prometedores.
Literatura:
- Krebsliga Schweiz: El cáncer en Suiza: cifras importantes. Estado Marzo 2020. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Linehan WM, et al. Clin Cancer Res. 2007;13: 671s-679s.
- Gelfond J, et al: Modifiable risk factors to reduce renal cell carcinoma incidence: Insight from the PLCO trial. Urol Oncol, 2018. 36(7): 340.e1-340.e6.
- McLaughlin JK, Lipworth L: Aspectos epidemiológicos del cáncer de células renales. Semin Oncol, 2000. 27(2): 115-123.
- Shuch B, Zhang J: Predisposición genética al carcinoma de células renales: implicaciones para el asesoramiento, las pruebas, el cribado y el tratamiento. J Clin Oncol, 2018: Jco2018792523.
- Siegel RL, Miller KD, Jemal A: Estadísticas sobre el cáncer, 2020. CA Cancer J Clin, 2020. 70(1): 7-30.
- Motzer RJ, et al: Sunitinib frente a interferón alfa en el carcinoma metastásico de células renales. N Engl J Med, 2007. 356(2): 115-124.
- Motzer RJ, et al: Nivolumab más ipilimumab frente a sunitinib en el carcinoma avanzado de células renales. N Engl J Med, 2018. 378(14): 1277-1290.
- Heng DY, et al: Factores pronósticos de la supervivencia global en pacientes con carcinoma metastásico de células renales tratados con agentes dirigidos al factor de crecimiento endotelial vascular: resultados de un amplio estudio multicéntrico. J Clin Oncol, 2009. 27(34): 5794-5799.
- Méjean A, et al: Sunitinib solo o tras nefrectomía en el carcinoma de células renales metastásico. N Engl J Med, 2018. 379(5): 417-427.
- Motzer RJ, et al: Nivolumab más ipilimumab frente a sunitinib en el tratamiento de primera línea del carcinoma avanzado de células renales: seguimiento ampliado de los resultados de eficacia y seguridad de un ensayo aleatorizado, controlado, de fase 3. Lancet Oncol, 2019. 20(10): 1370-1385.
- Rini BI, et al: Pembrolizumab más axitinib frente a sunitinib para el carcinoma avanzado de células renales. N Engl J Med, 2019. 380(12): 1116-1127.
- Choueiri TK: 696O_PR- Nivolumab + cabozantinib frente a sunitinib en el tratamiento de primera línea del carcinoma avanzado de células renales: primeros resultados del ensayo aleatorizado de fase 3 CheckMate 9ER. 2020: ESMO.
- Motzer RJ, et al: Avelumab más axitinib frente a sunitinib para el carcinoma avanzado de células renales. N Engl J Med, 2019. 380(12): 1103-1115.
- Rini BI, et al: Vigilancia activa en el carcinoma renal metastásico: un ensayo prospectivo de fase 2. Lancet Oncol, 2016. 17(9): 1317-1324.
- Ljungberg, Directrices de la EAU sobre el carcinoma de células renales. 2020: https://uroweb.org/guideline/renal-cell-carcinoma.
- Makker V, et al: Lenvatinib más pembrolizumab en pacientes con cáncer de endometrio avanzado. J Clin Oncol, 2020. 38(26): 2981-2992.
- Motzer RJ, et al: Nivolumab frente a everolimus en el carcinoma avanzado de células renales. N Engl J Med, 2015. 373(19): 1803-1813.
- Choueiri TK, et al: Cabozantinib frente a everolimus en el carcinoma avanzado de células renales. N Engl J Med, 2015. 373(19): 1814-1823.
- Chung-Han L: Ensayo de fase II de lenvatinib (LEN) más pembrolizumab (PEMBRO) para la progresión de la enfermedad tras el inhibidor de punto de control inmunitario PD-1/PD-L1 (ICI) en el carcinoma metastásico de células renales claras (mccRCC). 2020: Revista de Oncología Clínica.
- Bonaca MP, et al: Miocarditis en el entorno de la terapéutica del cáncer: Definiciones de caso propuestas para los síndromes clínicos emergentes en cardiooncología. Circulation, 2019. 140(2): 80-91.
- Astaras C, et al: Efectos adversos neurológicos asociados a los inhibidores de los puntos de control inmunitario: diagnóstico y tratamiento. Curr Neurol Neurosci Rep, 2018. 18(1): 3.
- Cella D, et al: Resultados comunicados por los pacientes con carcinoma avanzado de células renales tratados con nivolumab más ipilimumab frente a sunitinib (CheckMate 214): un ensayo aleatorizado de fase 3. Lancet Oncol, 2019. 20(2): 297-310.
- https://oraletumortherapie.ch.
- Rini BI, et al: Atezolizumab más bevacizumab frente a sunitinib en pacientes con carcinoma metastásico de células renales no tratado previamente (IMmotion151): un ensayo multicéntrico, abierto, de fase 3, aleatorizado y controlado. Lancet, 2019. 393(10189): 2404-2415.
- McDermott DF, et al: Actividad clínica y correlatos moleculares de la respuesta al atezolizumab solo o en combinación con bevacizumab frente al sunitinib en el carcinoma de células renales. Nat Med, 2018. 24(6): 749-757.
- Heng DY: ASCO 2020.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2020; 8(6): 6-9