El tratamiento de la hidradenitis supurativa sigue siendo un reto clínico. A menudo se requiere una combinación de diferentes modalidades de tratamiento para lograr un grado suficiente de control de la enfermedad. Un estudio ha demostrado que el uso combinado de adalimumab en paralelo con la escisión quirúrgica es eficaz y seguro. Hasta ahora, el adalimumab es el único fármaco biológico aprobado en la HS, pero actualmente se están investigando varios otros candidatos a fármacos antiinflamatorios sistémicos en programas de ensayos clínicos.
La hidradenitis supurativa (HS) es una enfermedad crónica recidivante, progresiva e inmunomediada. Los nódulos, abscesos y fístulas se producen preferentemente axilares, inguinales y anogenitales y pueden ser muy dolorosos. Si el tratamiento no se administra lo suficientemente pronto, las inflamaciones pueden convertirse en daños irreversibles en los tejidos, explicó el Prof. Dr. med. Falk Bechara, médico jefe de Dermatología del Hospital Universitario de la Universidad del Ruhr de Bochum (D) [1]. La HS puede diagnosticarse utilizando los siguientes criterios [2–4]:
- morfología característica de las lesiones,
- distribución característica de las lesiones,
- Cronicidad y manifestaciones recurrentes
Si un paciente cumple estos tres criterios diagnósticos, se trata de una HS con una sensibilidad del 90% y una especificidad del 97% [2–4]. La gravedad de la HS suele evaluarse según la clasificación de Hurley [2–4] (leve=estadio I, moderada=estadio II, grave=estadio III). En cuanto a la fisiopatología, aún quedan muchas preguntas abiertas, dijo el ponente. Parece que muchos mediadores inflamatorios y otros parámetros están regulados al alza en los pacientes con HS.
Las opciones de tratamiento más importantes para la HS en la actualidad son: antibióticos sistémicos, cirugía, biológicos. El profesor Bechara añadió que normalmente se combinan varios de estos enfoques terapéuticos [1].
OP: Cambio de paradigma en cuanto al enfoque
La intervención quirúrgica suele ser necesaria en pacientes en los estadios II o III de Hurley [11]. El objetivo principal es eliminar los tractos fistulosos y prevenir la reaparición de lesiones individuales [12,13]. Una resección anatómica profiláctica completa para las fístulas iniciales, como se practicaba en el pasado, ya no se haría hoy en día, explicó el Prof. Bechara [1]. En su lugar, la atención se centra actualmente en identificar el daño tisular irreversible. Se trata de resecar las fases cicatriciales fistulizantes irreversibles y no simplemente todas las manifestaciones inflamatorias de la enfermedad. El conferenciante explicó que las lesiones planas también pueden operarse en plano y combinarse con medicación; no siempre es necesaria una intervención radical.
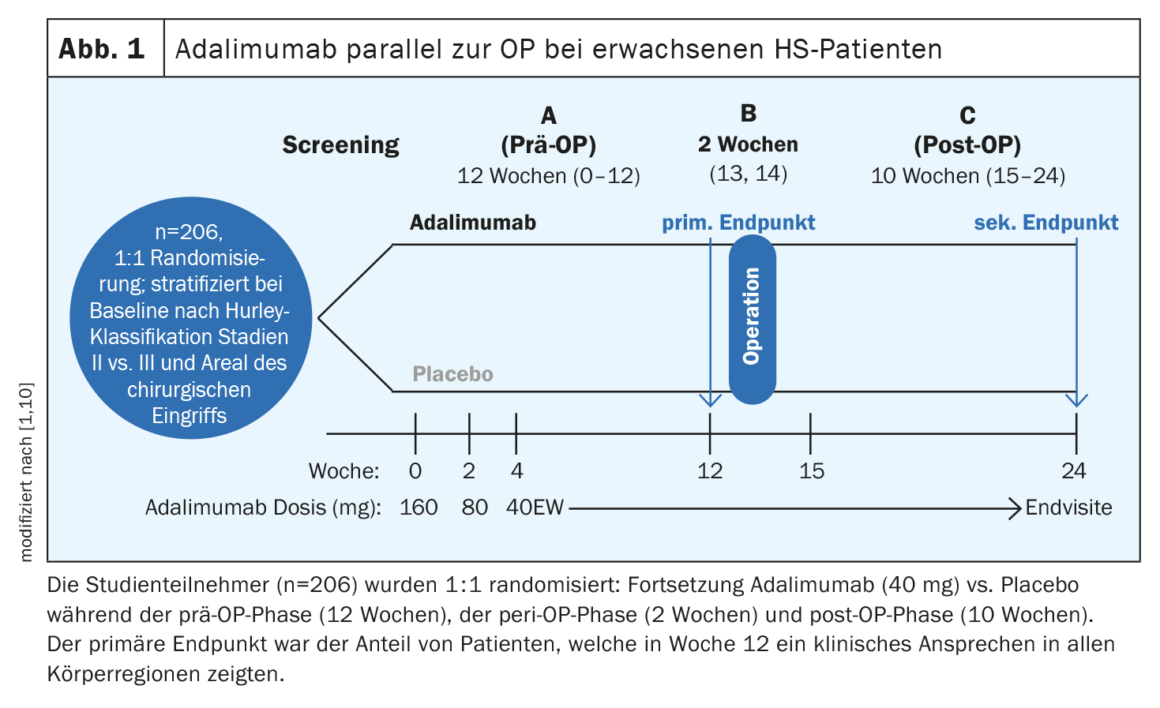
El adalimumab paralelo a la cirugía demostró ser eficaz y seguro
Aparte del adalimumab, ningún otro biológico ha superado hasta ahora los obstáculos para su aprobación. “Tenemos una preparación que funciona y también estamos trabajando con ella, pero hay mucho margen de mejora”, resumió el ponente [1]. En los ensayos PIONEER I y II, el adalimumab logró unas tasas de respuesta HiSCR50 del 42% y el 59%, respectivamente, frente al 26% y el 28% del placebo [5]. Antes de una intervención quirúrgica, a menudo se plantea la cuestión de si se debe o no suspender el biológico. En un estudio publicado en 2021, se demostró que el adalimumab era eficaz en combinación con cirugía mayor seguida de cicatrización secundaria, sin necesidad de interrumpir el tratamiento antes de la cirugía [10]. El estudio SHARPS (Safety and Efficacy of Adalimumab for Hidradenitis Suppurativa Peri-Surgically ) fue un estudio de fase IV aleatorizado, doble ciego y controlado con placebo de adalimumab en combinación con cirugía (Fig. 1) . Un total de 103 pacientes fueron asignados aleatoriamente a adalimumab y 103 a placebo. La edad media (DE) era de 37,6 (11,3) años, el 51% de los participantes eran mujeres. Se logró una respuesta clínica a la HS en todas las regiones corporales en la semana 12 en el 48% de los participantes del estudio que tomaban adalimumab y en el 34% que tomaban placebo (p=0,049). Se notificaron acontecimientos adversos relacionados con el tratamiento en un 72% en el brazo de adalimumab y en un 69% en el brazo de placebo. No se observó un mayor riesgo de infecciones postoperatorias de la herida, complicaciones o hemorragias con adalimumab en comparación con el placebo.
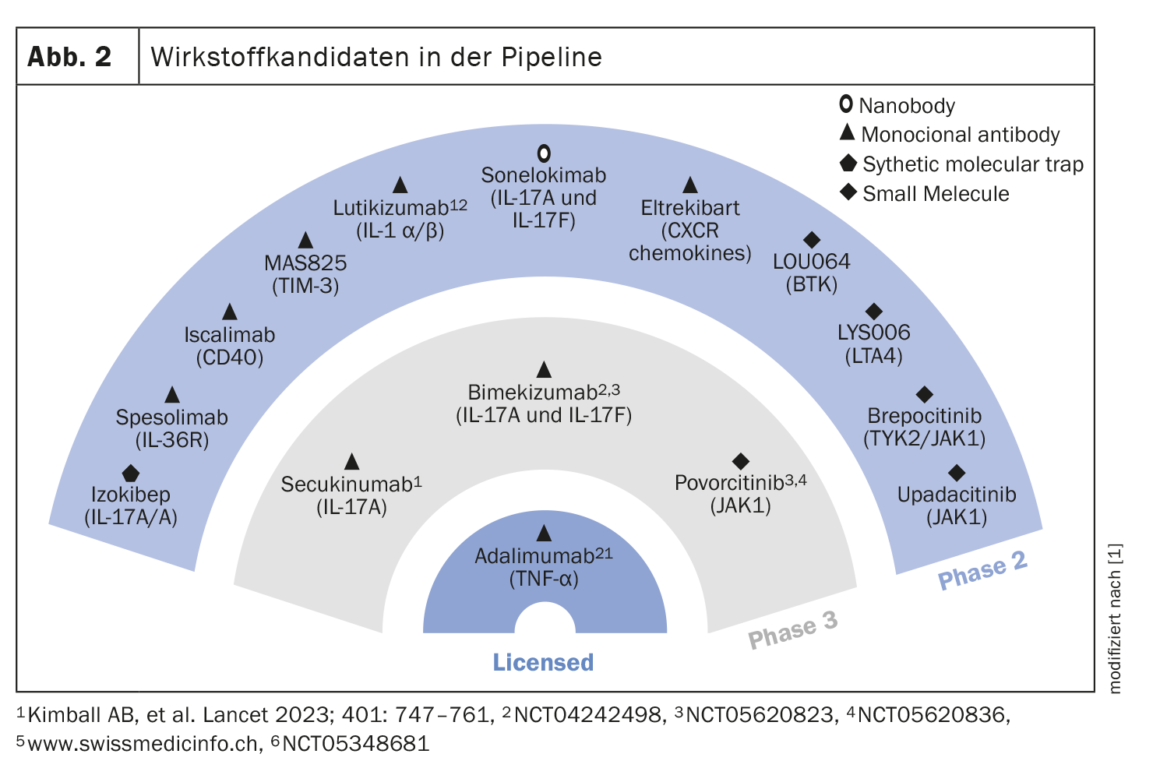
Otros fármacos candidatos en fase de desarrollo
En la figura 2 se muestran los fármacos candidatos que se están investigando actualmente en fase II y III. En dos ensayos clínicos, el inhibidor de la IL17A secukinumab a dos dosis (300 mg cada 2 semanas o cada 4 semanas) mostró tasas de respuesta estables hasta la semana 52 con un 54,8% y un 55,3% en SUNSHINE y un 63,4% y un 58,6% en SUNRISE [6]. El inhibidor dual de IL17A/F bimekizumab (320 mg q2w) alcanzó el criterio de valoración primario de HiSCR50 en el ensayo BE HEARD I en comparación con placebo, y también alcanzó el nivel de significación en BE HEARD II. Un anticuerpo monoclonal con IL36R como diana es el espesolimab [7]. En un estudio de prueba de concepto, el espesolimab demostró ser muy eficaz en la semana 12, sobre todo en lo que respecta a las fístulas drenantes. La dosis de carga fue de 1200 mg (i.v.) en las semanas 0,1 y 2. En la terapia de mantenimiento, se administró la misma dosis en las semanas 4,6,8 y 10. Otro fármaco candidato que se está investigando para su uso en la HS es el Izokibep. Su diana es el homodímero IL17A. El pequeño tamaño de la molécula permite una mejor penetración en los tejidos. En un estudio abierto no controlado con placebo de 30 pacientes, una proporción del 71% logró una respuesta HiSCR50 en la semana 12 con Izokibep 160 mg [8]. Un inhibidor selectivo de JAK1 del que se dispone de datos de fase II para el área de indicación de la HS es el povorcitinib. Con la dosis más alta (90 mg), más del 80% de 9 pacientes alcanzaron la HiSCR50 en la semana 8 [9].
Congreso: Conferencia anual del DDG
Literatura:
- «Acne inversa: Medikamente, Messer, Mischung», Prof. Dr. med. Falk Bechara, DDG-Jahrestagung, 26.–29.04.2023.
- Johnston LA, et al.: Practical Guidelines for Managing Patients With Hidradenitis Suppurativa: An Update. J Cutan Med Surg 2022; 26(2_suppl): 2S–24S.
- Daxhelet M, et al.: Proposed definitions of typical lesions in hidradenitis suppurativa. Dermatology 2020; 236(5): 431–438.
- Revuz JE, Jemec GBE: Diagnosing hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 1–5.
- Kimball AB, et al.: Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. NEJM 2016; 375: 422–434.
- Kimball AB, et al.: Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023; 401(10378): 747–761.
- Alavi et al. Spesolimab for Hidradenitis Suppurativa: a proof-of-concept study in patients with Hidradenitis suppurativa. AAD 2023; Poster 43019
- Papp K, et al.: Izokibep, a novel IL17A-inhibitor demnstrates HiSCR100 Responses in moderate-to-severe Hidradenitis suppurativa: week 12 results of open-label par A of a Phase 2b/3-study. AAD 2023; Late-breaking oral.
- Alavi A, et al.: Janus kinase 1 inhibitor INCB054707 for patients with moderate-to-severe hidradenitis suppurativa: results from two phase II studies. Br J Dermatol 2022; 186(5): 803–813.
- Bechara FG, et al.: Efficacy and Safety of Adalimumab in Conjunction With Surgery in Moderate to Severe Hidradenitis Suppurativa: The SHARPS Randomized Clinical Trial. JAMA Surg 2021; 156(11): 1001–1009.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Akt Dermatol 2019; 45: 277–287.
- Melendez Gonzalez MDM, Sayed CJ. Surgery is an essential aspect of managing patients with hidradenitis suppurativa. J Am Acad Dermatol 2020; 83(3): 979–980.
- Janse I, et al.: Surgical procedures in hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 97109.
DERMATOLOGIE PRAXIS 2023; 33(3): 28–29