Las heridas colonizadas por biopelículas constituyen uno de los mayores retos en el cuidado de heridas crónicas. Se calcula que el 2% de la población de Europa Central sufre heridas crónicas, y el riesgo aumenta con la edad. Diagnosticar y tratar la enfermedad subyacente, por lo general la enfermedad arterial oclusiva periférica (EAC), la insuficiencia venosa (IVC), la diabetes mellitus tipo I o II o una enfermedad inmunológica, es siempre el primer paso hacia el éxito del tratamiento. Las infecciones recurrentes (locales) y la biopelícula persistente de la herida prolongan el proceso de cicatrización.
Las heridas colonizadas por biopelículas constituyen uno de los mayores retos en el cuidado de heridas crónicas. Se calcula que el 2% de la población de Europa Central sufre heridas crónicas, y el riesgo aumenta con la edad. Diagnosticar y tratar la enfermedad subyacente, por lo general la enfermedad arterial oclusiva periférica (EAC), la insuficiencia venosa (IVC), la diabetes mellitus tipo I o II o una enfermedad inmunológica, es siempre el primer paso hacia el éxito del tratamiento. Las infecciones recurrentes (locales) y la biopelícula persistente de la herida prolongan el proceso de cicatrización.
Las heridas colonizadas por biopelículas constituyen uno de los mayores retos en el cuidado de heridas crónicas [1,2]. Se calcula que el 2% de la población de Europa Central sufre heridas crónicas, y el riesgo aumenta con la edad [3]. Diagnosticar y tratar la enfermedad subyacente, normalmente la enfermedad arterial periférica (EAP), la insuficiencia venosa (IVC), la diabetes mellitus tipo I o II o una enfermedad inmunológica, es siempre el primer paso hacia el éxito del tratamiento [4]. Las infecciones recurrentes (locales) y la biopelícula persistente de la herida prolongan el proceso de cicatrización. Esto suele llevar meses y también requiere un tratamiento intersectorial (hospital, ambulatorio, médico general o especialista, enfermería) [5]. Además, una vez cerrada una herida, no hay garantía de que permanezca cerrada. En consecuencia, el término “remisión de la herida” es más apropiado que “cicatrización de la herida” para los pacientes con trastornos crónicos de cicatrización de heridas.
Biopelícula de la herida – definición y patogénesis
Según un metaanálisis, alrededor del 78% de todas las heridas crónicas están colonizadas por microorganismos patógenos en forma de biopelículas [6]. Éstas son responsables de la cronicidad de una herida, dada la mejor terapia posible para la enfermedad subyacente [2]. La biopelícula de la herida se define de la siguiente manera:
“La biopelícula es una comunidad estructurada de microbios con diversidad genética y expresión génica variable (fenotipo) que crea comportamientos y mecanismos de defensa que conducen a la producción de infecciones únicas (crónicas) con una tolerancia significativa a los antibióticos y antimicrobianos, al tiempo que están protegidos de la inmunidad del huésped.” [Proceso Delphi de Consenso, IWII 05/2016].
Cualquier herida, incluso una herida aguda, se coloniza en pocas horas con microorganismos del microbioma cutáneo, que también puede contener especies patógenas. El lecho de la herida es un buen caldo de cultivo para ellos. En esta fase, se habla de “contaminación de la herida”. A medida que pasa el tiempo, las bacterias se multiplican dentro y sobre la herida; se forman colonias bacterianas. La limpieza externa (antiséptica) de la herida puede reducir la colonización bacteriana y el sistema inmunitario también actúa contra la propagación de bacterias en la herida. Si estos procesos no tienen lugar o si las células inmunitarias locales no son lo suficientemente eficaces, cada vez más bacterias colonizan la herida. Se habla de “colonizado”, o “críticamente colonizado” si la carga bacteriana aumenta con una reacción local acompañante.
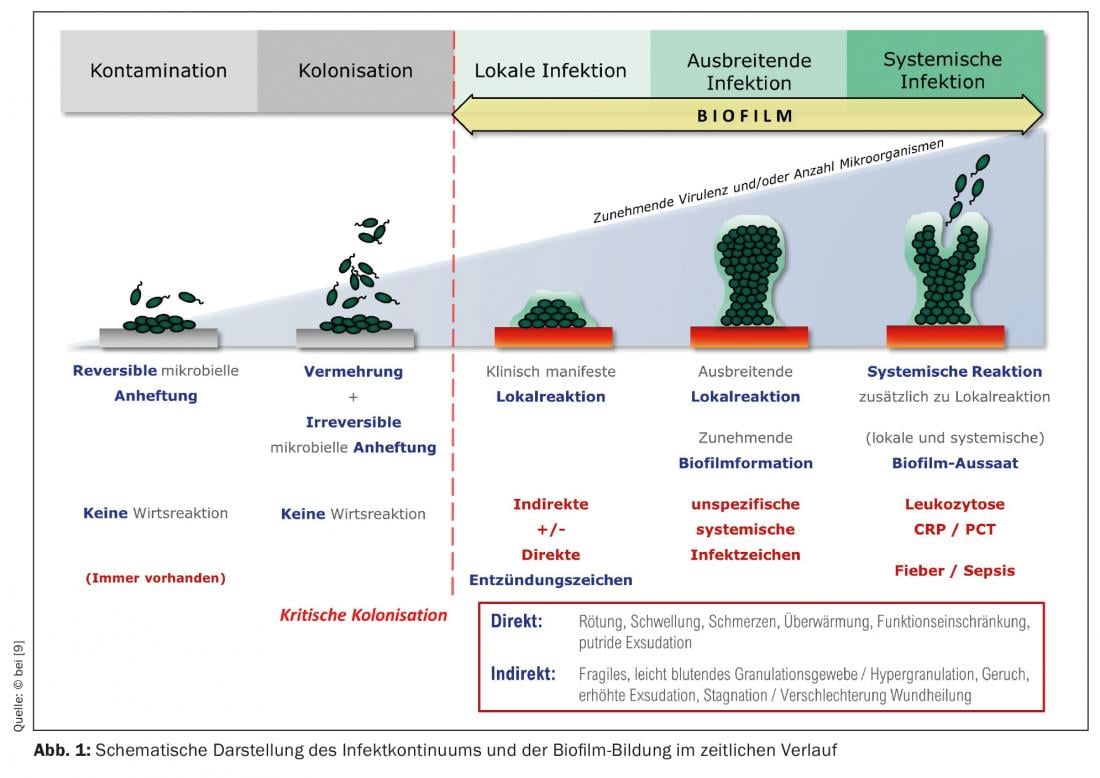
Las denominadas biopelículas inmaduras pueden formarse a partir de estas colonias bacterianas en tan sólo 24 horas (Fig. 1). En la mayoría de los casos, estas biopelículas no están formadas por una sola especie bacteriana (como ocurre con las biopelículas de implantes en cirugía ortopédica), sino que contienen muchas especies bacterianas diferentes, es decir, una biopelícula multiespecie. Las principales especies bacterianas en las biopelículas de heridas, utilizando aquí el ejemplo de las úlceras de pierna, son Staphylococcus aureus (47,6%), su variante resistente a la meticilina (SARM) (8,6%), Pseudomonas aeruginosa (31,1%) y enterobacterias (28,6%) [7]. Estos microorganismos -más raramente también intervienen hongos- comienzan a rodearse de la llamada sustancia extrapolimérica (EPS), casi “amurallándose”. El EPS está formado principalmente por polisacáridos (por ejemplo, alginato, celulosa, dextrano) y una variedad de proteínas, lípidos, glicoproteínas, glicolípidos [8], es decir, azúcares y proteínas, lo que hace que se adhiera firmemente al lecho de la herida. Después de 2-4 días, se habla de “biopelícula madura”. Puede llegar a tener un grosor de hasta 2 mm, es decir, plástico y visible (Fig. 2A/B). En esta fase, la biopelícula es capaz de liberar bacterias planctónicas (suspendidas en líquido) con el exudado de la herida, que se produce en abundancia debido a la inflamación. (Fig. 1), que pueden colonizar el entorno de la herida u otras heridas [9]. Aquí comienza de nuevo el ciclo de formación de biopelículas.
Reconocer la biopelícula de la herida
El primer paso y el más importante es el diagnóstico clínico, es decir, considerar siquiera la posibilidad de una colonización por biofilm de la herida (crónica) como factor que interfiere en la cicatrización. La biopelícula madura puede identificarse fácilmente y verificarse clínicamente mediante la exploración de la herida (borde) con pinzas o curetas (Fig. 2A/B) . La propia biopelícula de la herida proporciona una respuesta inmunitaria duradera, más o menos pronunciada, o una inflamación a nivel local. Puede ser la base de una infección de la herida, pero también puede persistir durante semanas y meses sin inducirla.
En las heridas con persistencia de biopelícula desnuda, no suele haber daños (tisulares) pronunciados, aparte de la falta de cicatrización, porque las diversas especies microbianas de la biopelícula existen simbióticamente con un metabolismo reducido y una proliferación reducida y se alimentan del exudado (humano) de la herida. Por otro lado, también existen biopelículas de heridas muy agresivas, por ejemplo, las dominadas por P. aeruginosa , que provocan una exudación grave y dermatitis ambiental, lo que, en consecuencia, causa el agrandamiento de la herida. Es frecuente que la herida desprenda un fuerte olor.
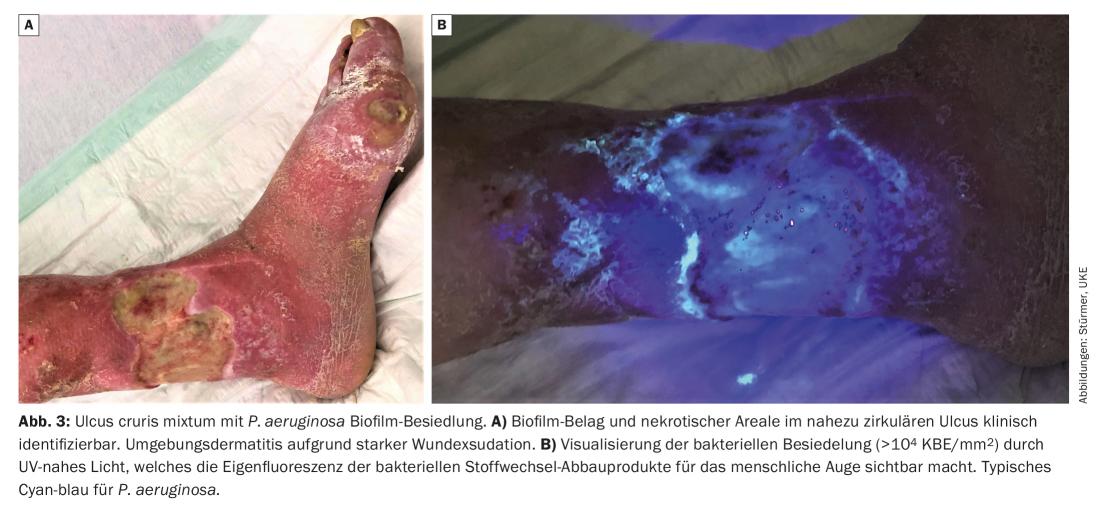
Una biopelícula de la herida o una fuerte colonización bacteriana de la herida (>104 UFC/mm2) pueden hacerse visibles al ojo humano utilizando luz ultravioleta cercana (por ejemplo, MolecuLight®, MolecuLight Corp., Toronto, Canadá) (Fig. 3) : Utilizando luz de longitud de onda 450 nm, las zonas de gran actividad metabólica bacteriana pueden visualizarse por la fluorescencia roja de los productos metabólicos bacterianos depositados, como las porfirinas (de, por ejemplo. Staphylococcus Spp. y Enterobacteriaceae) o por la fluorescencia azul cian de la pioverdina secretada por Pseudomonas Spp. [10]. También se pudo detectar en muchas heridas que P. aeruginosa coloniza e infiltra predominantemente el margen de la herida, mientras que S. aureus es más probable que se encuentre en la base de la herida.
La terapia de la biopelícula de la herida
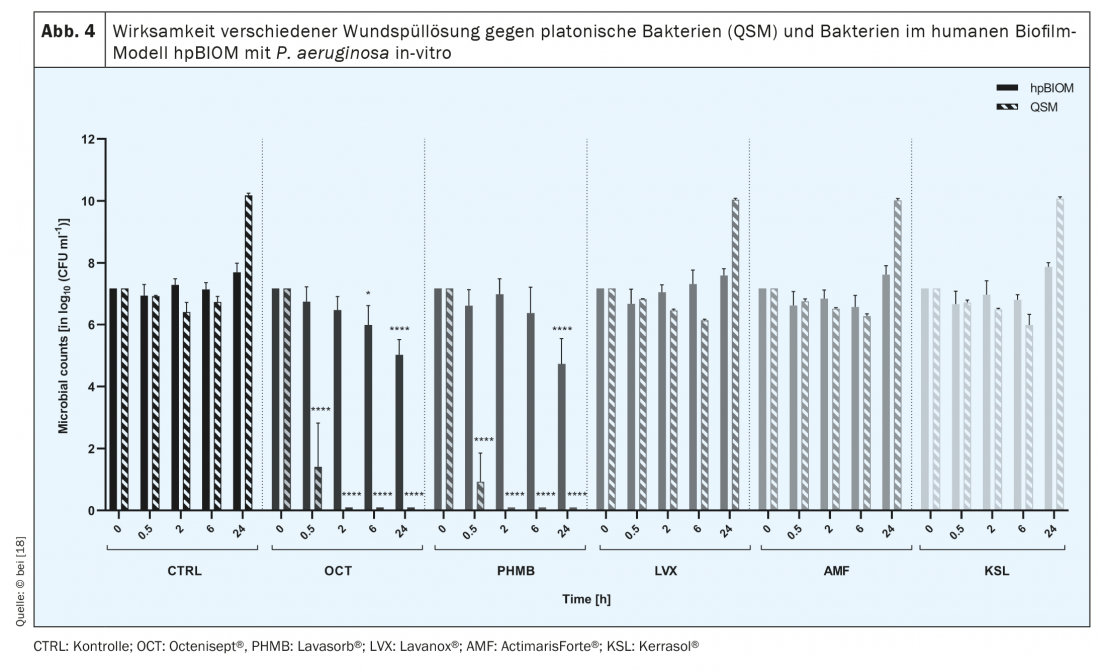
La comunidad simbiótica e interespecífica de microorganismos de la que se forman las biopelículas produce una sustancia protectora, denominada extrapolimérica (EPS), que funciona como barrera bioquímica contra el sistema inmunitario del huésped y, en particular, contra los agentes antimicrobianos [11,12]. Por ello, estos últimos suelen fracasar en la erradicación de biopelículas [13–15] (Fig. 4) . A través de moléculas de señalización, los microorganismos también pueden comunicarse entre sí, por ejemplo, para cambiar su actividad metabólica [13,15]. Una menor actividad metabólica de determinadas bacterias, las denominadas células persister en la profundidad de la biopelícula, así como la interacción de diferentes microorganismos, por ejemplo mediante la transferencia lateral de genes de resistencia, son otros aspectos que contribuyen a la elevada resistencia de las biopelículas [17]. Su “tolerancia” a las sustancias, soluciones y apósitos antimicrobianos es alta, ya que éstos conducen a la inducción de la muerte celular de bacterias y hongos, pero no a la destrucción del EPS. De este modo, los agentes antimicrobianos no pueden desplegar su eficacia contra los microorganismos, ya que -debido al “escudo protector” del EPS- ni siquiera penetran hasta ellos [15]. Lo mismo ocurre con los antibióticos aplicados sistémicamente, que, debido al EPS, no pueden penetrar con la suficiente profundidad en la biopelícula de la herida desde el interior, es decir, desde el lecho de la herida, para eliminar por completo los gérmenes patógenos. No sólo por este motivo, sino en general, la prescripción de antibióticos en la terapia de las heridas crónicas debe considerarse de forma crítica para evitar el desarrollo de resistencias en el largo proceso de cicatrización de las heridas crónicas.
Biopelícula de heridas y soluciones (antimicrobianas) de irrigación de heridas
Existen varios enfoques para eliminar la colonización por biofilm de las heridas [17]. Por ejemplo, se recomiendan soluciones antimicrobianas disponibles en el mercado que hayan demostrado su eficacia en análisis in vitro. Sin embargo, la observación clínica contradice a veces el rendimiento antimicrobiano declarado [18] (Fig. 4).
Existen diferentes tipos de solución para la irrigación de heridas: con algunos, como la solución salina fisiológica o NaCl, lo importante es el efecto limpiador y diluyente; con los otros grupos, la eficacia antimicrobiana más o menos pronunciada. Se sabe que algunas soluciones de irrigación de heridas pierden su potencial antimicrobiano cuando entran en contacto con entornos ricos en proteínas, como los del exudado de las heridas [19]. En consecuencia, la eficacia de las distintas soluciones de irrigación de heridas contra las biopelículas bacterianas también varía, ya que el EPS también actúa como “escudo protector”. Las soluciones antimicrobianas para la irrigación de heridas abordan y destruyen las paredes bacterianas, las membranas y las proteínas de transporte bacterianas o inhiben su función. Si no consiguen atravesar el EPS, formado principalmente por polisacáridos y proteínas, no pueden actuar eficazmente.
No existen estudios clínicos comparativos con soluciones (antimicrobianas) de irrigación de heridas, que podrían servir de base para recomendaciones terapéuticas diferenciadas. Sin embargo, las pruebas traslacionales sistemáticas realizadas con el modelo de biopelícula humana hpBIOM demuestran que Octenisept® es capaz de escindir las biopelículas y eliminar las bacterias que contienen en un plazo de 72 h (!). [15,18] (Fig. 5). La PHMB tiene un éxito limitado en el mismo periodo, pero no se consigue una erradicación completa ni siquiera después de 72 horas. Las soluciones hipoclorosas de irrigación de heridas y la clorhexidina no consiguen eliminar eficazmente las bacterias en biopelícula [18].
Biopelícula en heridas y apósitos antimicrobianos
Las heridas colonizadas por biofilm pueden dividirse básicamente en dos tipos: Heridas con biofilm residente, menos agresivo. Se caracterizan por un entorno tranquilo de la herida con una exudación de ligera a moderada (Fig. 2) . El otro tipo de biopelícula de la herida muestra una fuerte exudación que requiere cambios diarios de apósito. La inflamación acompañante, el enrojecimiento, una gran sensibilidad de toda la región de la herida y a menudo incluso una dermatitis circundante son obligatorios (Fig. 3). Por lo tanto, en estos pacientes debe prestarse especial atención a la piel circundante de la herida y también debe tratarse (por ejemplo, con pomadas de urea, zinc o dosis bajas de cortisona).
Los estudios clínicos comparativos con apósitos (antimicrobianos) para heridas son escasos [20]. Resulta difícil derivar de ello recomendaciones terapéuticas diferenciadas, ya que no sólo varían las sustancias activas (iones de plata, plata nanocristalina, PHMB, derivados del yodo, etc.) y sus concentraciones, sino también la base respectiva de los apósitos (espuma de PU, alginatos, fibras, etc.). Múltiples pruebas in vitro con un modelo de biopelícula humana demostraron que un producto combinado de yodo y almidón (yodo cardexómero) era capaz de erradicar por completo las bacterias de la biopelícula en 6 (!) días (Fig. 5). Otros apósitos para heridas que contenían PHMB o plata (MP clase 2B) sólo redujeron la carga bacteriana [21]. Sin embargo, los apósitos antimicrobianos se analizaron durante 6 días sin cambios; todos los apósitos probados deberían lograr una mayor eficacia con cambios de apósito diarios o de 2 días.
Biopelícula de la herida y desbridamiento (brusco)
El desbridamiento cortante o quirúrgico constante es actualmente la única terapia eficaz y sostenible para la biopelícula de la herida recomendada por consenso de expertos [6]; sin embargo, no siempre es una opción viable en el entorno de la atención domiciliaria (por ejemplo, higiene limitada, pacientes anticoagulados tratados con fármacos). La aplicación de esta terapia local comparativamente agresiva incluso en heridas “tranquilas” con colonización de biopelículas (Fig. 2 ) requiere a veces cierto esfuerzo por parte del facultativo: Una vez retirado el apósito, debe inspeccionarse la herida para detectar una posible colonización de biofilm visualmente o con la ayuda de la luz ultravioleta antes mencionada, con el fin de retirarlo con una cureta y/o un bisturí si es necesario. Sólo después de su eliminación, las sustancias antimicrobianas de las soluciones y los apósitos para heridas pueden actuar eficazmente contra los microorganismos patógenos restantes.
El desbridamiento quirúrgico suele estar indicado cuando es necesario eliminar tejido necrótico además de la biopelícula de la herida [22]. Se realiza bajo anestesia de conducción o intubación. En comparación con el desbridamiento cortante, es más invasivo y también elimina partes del margen y del lecho de la herida utilizando un bisturí y una rasuradora. El tamaño de la herida aumenta en consecuencia al principio. Otra opción para eliminar el biofilm de la herida es el desbridamiento químico (por ejemplo, Debrichem®), que elimina eficazmente las bacterias pero también infiltra el lecho y el margen de la herida. Aquí se eliminan las bacterias profundamente arraigadas, pero también intervienen las células humanas, por lo que también en este caso el efecto primario es el agrandamiento de la herida [23,24].
Conclusión
La biopelícula (bacteriana) de la herida requiere una terapia compleja a nivel local porque consta de varios “componentes”. Es importante saber que se encuentra en más del 75% de todas las heridas crónicas y que, por lo tanto, puede eliminarse. La limpieza de la herida mediante una solución de irrigación y una compresa por sí sola no es suficiente. La persistencia de la colonización por biopelículas provoca el estancamiento de la cicatrización de las heridas. Sin embargo, independientemente de la terapia local, siempre debe tratarse la enfermedad subyacente que ha provocado la cronificación de la herida. En consecuencia, una herida muy exudativa y poblada de biopelículas no es una contraindicación para una terapia de compresión médicamente indicada (por ejemplo, en IVC, linfoedema o lipoedema).
Mensajes para llevarse a casa
- Diagnosticar y tratar la afección subyacente es siempre esencial en los pacientes con heridas crónicas.
- Alrededor del 78% de todas las heridas crónicas están colonizadas por microorganismos patógenos en forma de biopelículas.
- Las principales especies bacterianas en las biopelículas de heridas son S. aureus y P. aeruginosa.
- Las soluciones antimicrobianas para la irrigación de heridas y los apósitos tratan y eliminan las bacterias. Sin embargo, a menudo no penetran en el EPS de la biopelícula, que consiste principalmente en polisacáridos y proteínas, por lo que no pueden actuar eficazmente.
- El desbridamiento cortante o quirúrgico constante es actualmente el único tratamiento eficaz y sostenible del biofilm de heridas recomendado por consenso de expertos.
Literatura:
- Noskin GA, Rubin RJ, Schentag JJ, et al: Tendencias nacionales en las tasas de infección por Staphylococcus aureus: impacto sobre la carga económica y la mortalidad en un periodo de 6 años (1998-2003). Clin Infect Dis 2007; 45(9): 1132-1140.
- James GA, Swogger E, Wolcott R, et al: Biopelículas en heridas crónicas. Reparación de heridas Regen 2008; 16(1): 3-44.
- Heyer K, Herberger K, Protz K, et al: Epidemiología de las heridas crónicas en Alemania: Análisis de los datos del seguro médico obligatorio. Reparación de heridas Regen 2016; 24(2): 434-442.
- Hachenberg T, Senturk M, Jannasch O, Lippert H: [Infecciones postoperatorias de heridas. Fisiopatología, factores de riesgo y conceptos preventivos]. Anaesthesist 2010; 59(9): 851-866; quiz 867-858.
- Augustin M SrE, Dissemond J, Gerber V, et al.: Recomendaciones para mejorar la estructura de la atención a las personas con heridas crónicas en Alemania. Tratamiento de heridas 2020; 14: 357-365.
- Malone M, Bjarnsholt T, McBain AJ, et al: La prevalencia de las biopelículas en las heridas crónicas: una revisión sistemática y metaanálisis de los datos publicados. J Wound Care 2017; 26(1): 20-25.
- Jockenhofer F, Gollnick H, Herberger K, et al.: Espectro bacteriológico patógeno de las úlceras crónicas de las piernas: Resultados de un ensayo multicéntrico en centros dermatológicos de atención a heridas diferenciados por regiones. J Dtsch Dermatol Ges 2013; 11(11): 1057-1063.
- Flemming HC, Wingender J.: La matriz de la biopelícula. Nat Rev Microbiol 2010; 8(9): 623-633.
- Rembe JD, Stuermer EK: Antisepsia moderna de heridas: indicaciones y limitaciones, entre el conocimiento, el deseo y la incertidumbre. Cirugía vascular 2020; 25: 272-276.
- Stuermer EK, Besser M, Debus ES, et al: Infiltración bacteriana en heridas colonizadas por biopelículas: Análisis en el modelo de herida ex vivo hpBIOM y posible impacto en el hisopado y el desbridamiento. Int Wound J 2022 (en revisión).
- Thurlow LR, Hanke ML, Fritz T, et al: Las biopelículas de Staphylococcus aureus impiden la fagocitosis de los macrófagos y atenúan la inflamación in vivo. J Immunol 2011; 186(11): 6585-6596.
- Cowan T: Las biopelículas y su gestión: del concepto a la realidad clínica. J Wound Care 2011; 20(5): 220, 222-226.
- Larsen T, Fiehn NE.: Resistencia de las biopelículas de Streptococcus sanguis a los agentes antimicrobianos. APMIS 1996; 104(4): 280-284.
- Percival SL, Salisbury AM, Chen R: Plata, biopelículas y heridas: la resistencia revisitada. Crit Rev Microbiol 2019; 45(2): 223-237.
- Besser M, Dietrich M, Weber L, et al.: Eficacia de los antisépticos en un novedoso modelo tridimensional de biopelícula plasmática humana (hpBIOM). Sci Rep 2020; 10(1): 4792.
- Williams P, Winzer K, Chan WC, Camara M: Mira quién habla: comunicación y detección de quórum en el mundo bacteriano. Philos Trans R Soc Lond B Biol Sci 2007; 362(1483): 1119-1134.
- Johani K, Malone M, Jensen SO, et al: Evaluación de los tiempos de exposición cortos de las soluciones antimicrobianas para heridas contra las biopelículas microbianas: de in vitro a in vivo. J Antimicrob Chemother 2018; 73(2): 494-502.
- Rembe JD, Huelsboemer L, Plattfaut I, et al: Las soluciones antimicrobianas hipocloradas para la irrigación de heridas demuestran una menor eficacia antibiofilm contra la biopelícula bacteriana en un modelo in vitro complejo de biopelícula de plasma humano (hpBIOM) que los antimicrobianos comunes para heridas. Front Microbiol 2020; 11: 564513.
- Rembe JD, Fromm-Dornieden C, Stuermer EK: La influencia del fluido humano para heridas agudas (AWF) en la eficacia antibacteriana de diferentes apósitos antisépticos de espuma de poliuretano: un análisis in vitro. Reparación de heridas Regen 2018; 26: 27-35.
- Schwarzer S, James GA, Goeres D, et al: La eficacia de los agentes tópicos utilizados en heridas para el tratamiento de las infecciones crónicas por biopelículas: una revisión sistemática. J Infect 2020; 80(3): 261-270.
- Stuermer EK, Plattfaut I, Dietrich M, et al: Actividad in vitro de los apósitos antimicrobianos sobre la biopelícula de heridas de P. aeruginosa. Front Microbiol 2021; 12: 664030.
- Dissemond J, Bültemann A, Gerber V, et al.: Documento de posición de la Initiative Chronische Wunde (ICW) e.V. sobre la nomenclatura del desbridamiento de heridas crónicas. Hautarzt 2022; 24 [Online ahead of print].
- Schwarzer S, Radzieta M, Jensen SO, Malone M: Eficacia de un agente tópico para heridas ácido metano-sulfónico y dimetilsulfóxido sobre las biopelículas in vitro. Int J Mol Sci 2021; 22: 9471.
- Cogo A, Quint BJ, Bignozzi CA: Reanudación del proceso de cicatrización de heridas crónicas mediante un novedoso desecante: una serie prospectiva de casos. Heridas 2021; 33: 1-8.
PRÁCTICA GP 2022, 17(7): 12-17













