El ictus es una de las principales causas de discapacidad. El deterioro cognitivo que se produce tras un ictus se ha descuidado bastante durante muchos años. La revisión se centra en la incidencia y prevalencia del deterioro cognitivo tras un ictus, en los principales factores predisponentes, en los factores de imagen y en los posibles biomarcadores candidatos.
El ictus es una de las principales causas de discapacidad [1]. Mientras que la mayoría de las investigaciones e intervenciones se centraron en las discapacidades físicas [2], el deterioro cognitivo que se produce tras un ictus ha sido bastante descuidado durante muchos años [3,4]. Actualmente se sabe que incluso los ictus leves pueden afectar al funcionamiento diario y a la cognición y, en consecuencia, influirán en la calidad de vida [5]. El ictus isquémico puede facilitar la aparición de la demencia vascular, así como agravar el deterioro cognitivo preexistente. El inicio del deterioro cognitivo puede manifestarse inmediatamente después de la aparición de un ictus isquémico, pero a menudo se produce un retraso en el desarrollo del deterioro cognitivo tras un ictus [6]. Tanto los mecanismos neurodegenerativos como los vasculares se activan y probablemente dan lugar a procesos superpuestos dentro de la unidad neurovascular [7]. En la presente revisión, nos centraremos en la incidencia y prevalencia del deterioro cognitivo tras un ictus, en los principales factores predisponentes, en los factores de imagen y en los posibles biomarcadores candidatos.
Epidemiología
Los supervivientes de un ictus corren un mayor riesgo de desarrollar un deterioro cognitivo. Las estimaciones comunicadas sobre la prevalencia de la demencia son coherentes en diversos estudios: El 10% de los pacientes presenta demencia antes del primer ictus, el 10% desarrolla una nueva demencia después del primer ictus y más de un tercio tiene demencia después de un ictus recurrente [8,9].
La fuerte asociación de la demencia posterior al ictus con múltiples ictus pone de relieve el papel causal central del ictus y, por tanto, el efecto probable de una atención óptima del ictus agudo y de la prevención secundaria en la reducción de la carga de demencia [8]. La prevalencia del deterioro cognitivo en los supervivientes de un ictus varía en función del entorno, la población, los criterios de exclusión (demencia previa al ictus, ictus recurrente, afasia), los criterios utilizados para el diagnóstico del deterioro cognitivo y el intervalo de tiempo transcurrido desde el ictus [10]. La prevalencia de la demencia posterior al ictus en el primer año tras el ictus oscila entre el 7% en los estudios basados en la población del primer ictus excluyendo la demencia previa al ictus y el 41% en los estudios basados en hospitales incluyendo el ictus recurrente y la demencia previa al ictus [8]. Se descubrió que el riesgo de demencia posterior al ictus era mayor en los primeros meses tras el ictus, lo que podría deberse en parte a un deterioro cognitivo no reconocido antes del ictus [10]. Tras la incidencia inicial de demencia tras el ictus, la incidencia acumulativa aumenta linealmente a un ritmo del 3% y el 1,7% anual en estudios hospitalarios y poblacionales, respectivamente [11]. Pocos estudios utilizaron resultados a largo plazo: el periodo de observación más largo fue de 25 años en un estudio basado en la población que halló una incidencia acumulada de demencia tras un ictus del 48% en el año 25 [12].
El deterioro cognitivo también puede producirse tras un AIT. En una reciente revisión sistemática que incluía a 1167 pacientes, la prevalencia del deterioro cognitivo leve tras el TTIA oscilaba entre el 29 y el 68%. Se encontró un deterioro cognitivo grave en el 8-22% de los pacientes. Los estudios que utilizaron un instrumento de cribado cognitivo y los realizados poco después del AIT o varios años después, informaron de las frecuencias más altas de deterioro [13].
Definiciones
La demencia vascular es la segunda causa más común de deterioro cognitivo después de la enfermedad de Alzheimer e incluye la demencia posterior a un ictus. Por lo tanto, los términos PSD y demencia vascular no son sinónimos. La demencia vascular representa un concepto que incluye no sólo los infartos múltiples corticales y/o subcorticales, sino también los infartos únicos estratégicos, las lesiones de la sustancia blanca no infartadas, las hemorragias y la hipoperfusión como posibles causas de demencia. Además, hay que destacar que no todos los casos de demencia tras un ictus son de origen vascular. En consecuencia, se utiliza el término de demencia post-ictus (DPS) para cualquier demencia que se desarrolle tras un acontecimiento cerebrovascular clínico. De este modo, el término PSD no sugiere un proceso neuropatológico concreto. Además, reconocer el estado cognitivo previo al ictus es esencial para permitir una clasificación adecuada. Un paciente con deterioro cognitivo preexistente que presente un ictus leve no debe ser etiquetado como PSD. Además, la evaluación temporal del deterioro cognitivo es otro factor diagnóstico relevante. A menudo se observan deficiencias agudas en las puntuaciones de las pruebas cognitivas tras un ictus y la repetición de las pruebas al cabo de varias semanas suele revelar mejoras [10]. Por lo tanto, se recomienda retrasar el diagnóstico definitivo de PSD hasta al menos seis meses después del suceso.
Debe tenerse en cuenta, además, que el término “post-ictus” incluye no sólo los accidentes cerebrovasculares y los accidentes cerebrovasculares leves, sino también los ataques isquémicos transitorios (AIT), ya que las pruebas emergentes sugieren que los AIT también pueden estar asociados a un pronóstico cognitivo adverso [13].
Pruebas de detección
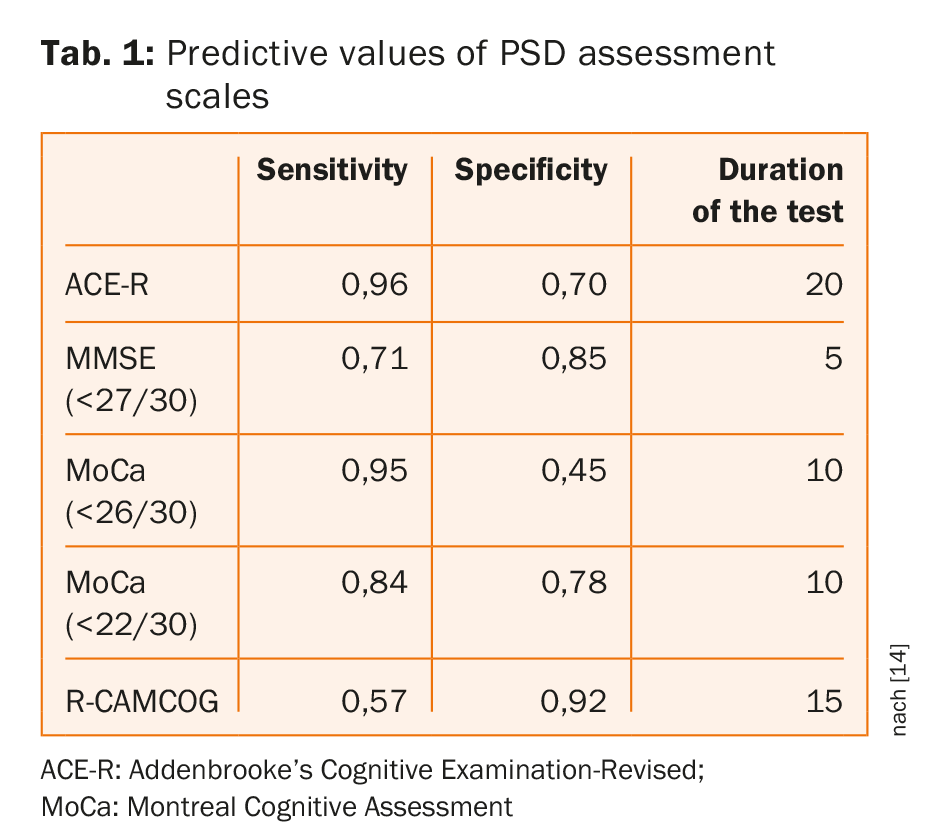
Las herramientas de cribado cognitivo de uso común tienen una precisión similar para la detección de la demencia/deterioro multidominio, sin que exista ninguna prueba claramente superior ni pruebas de que las herramientas de cribado con tiempos de administración más largos funcionen mejor [14]. Como se muestra en la tabla 1, el MoCA en el umbral habitual ofrece un tiempo de evaluación corto con una alta sensibilidad pero a costa de la especificidad; los umbrales adaptados mejoraron la especificidad sin sacrificar la sensibilidad [14].
Factores de riesgo de la demencia post-ictus
En la tabla 2 se enumeran los principales factores de riesgo de la demencia post-ictus . De hecho, estos parámetros actúan a distintos niveles, algunos más bien sobre el estado previo a la apoplejía, mientras que otros lo hacen sobre el estado posterior a la apoplejía. En una revisión sistemática y un metaanálisis que incluyó a 7.511 pacientes, Pendlebury y sus colegas demostraron que la atrofia del lóbulo temporal medial, el sexo femenino y los antecedentes familiares de demencia estaban fuertemente asociados a la demencia previa al ictus, mientras que las características y complicaciones del ictus y la presencia de lesiones múltiples en tiempo y lugar estaban más fuertemente asociadas a la demencia posterior al ictus [8].
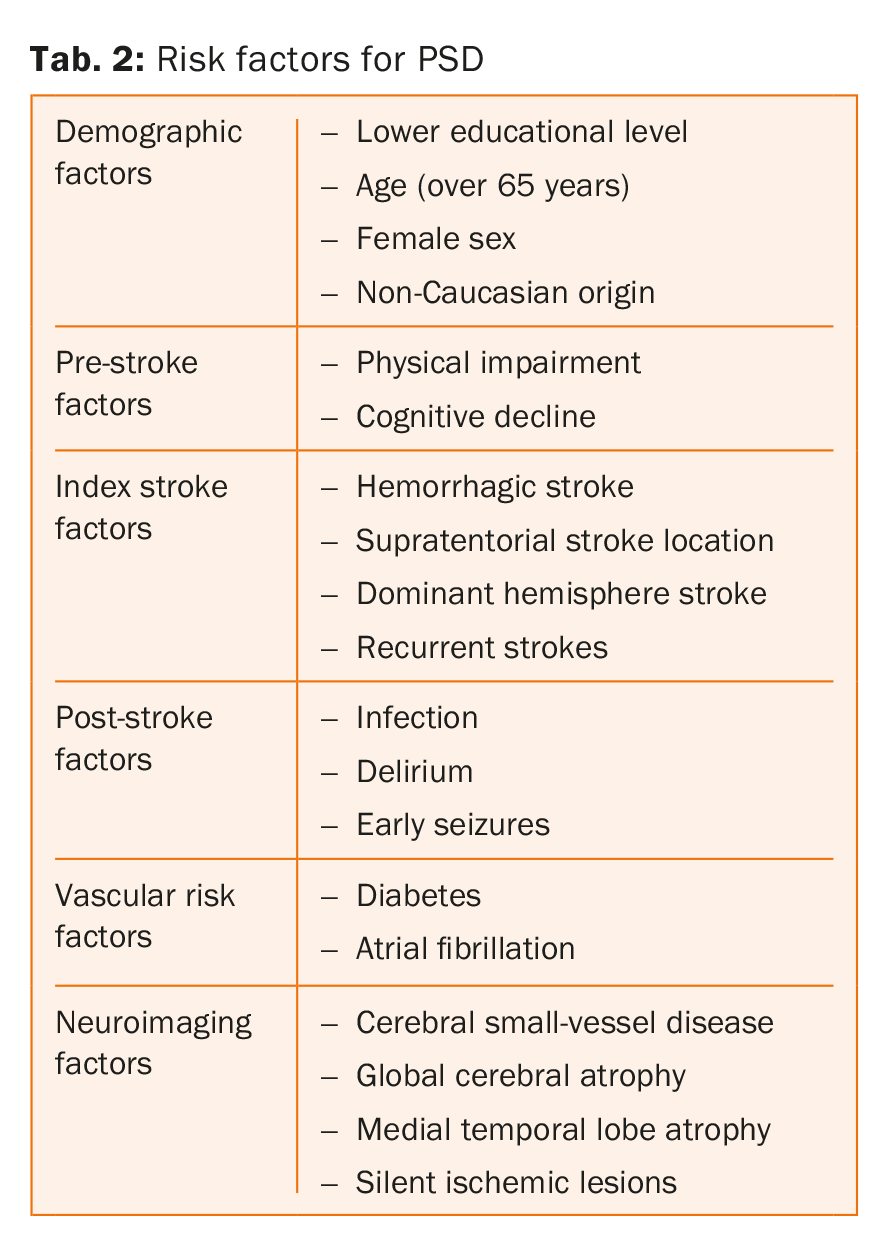
Cabe destacar también el hecho de que los factores de riesgo vascular, como la diabetes y la fibrilación auricular, se asocian a un mayor riesgo de demencia tras el ictus, independientemente del deterioro cognitivo previo al ictus, mientras que esto no se observó en el caso de otros dos factores de riesgo bien establecidos, la hipertensión y el tabaquismo [8,15-18]. Sin embargo, este hallazgo está en contradicción con los resultados de otros estudios que muestran que la hipertensión arterial es un determinante importante del deterioro cognitivo [19,20]. Por último, faltan pruebas de si los factores de riesgo vascular relacionados con el estilo de vida, como la inactividad física y una dieta poco saludable, son también factores de riesgo independientes para la DSP [21].
Subtipos de ictus
Por lo general, se piensa que los ictus lacunares tienen menos probabilidades de afectar a la cognición que los ictus corticales más graves y de mayor tamaño; sin embargo, los ictus lacunares suelen estar asociados a la enfermedad cerebral de pequeños vasos, una causa común de deterioro cognitivo y demencia, especialmente en las personas mayores [22]. En un metaanálisis reciente, Makin y colaboradores, compararon la incidencia del deterioro cognitivo en función de los diferentes subtipos de ictus [23]. Los autores demostraron entre 7575 pacientes, incluidos 2860 con ictus lacunar, que el 24% presentaba deterioro cognitivo leve (DCL) o DSP. La prevalencia de demencia tras un ictus lacunar (seis estudios, n=1421) fue del 20% (IC del 95%: 9 a 33) y la incidencia de DCL o demencia (cuatro estudios, n=275) fue del 37% (IC del 95%: 23 a 53). Los autores concluyeron que el deterioro cognitivo parecía ser común tras los ictus lacunares a pesar de su pequeño tamaño, lo que sugiere que la ECV asociada puede aumentar su impacto. No se observaron diferencias significativas en cuanto a la prevalencia de PSD entre los ictus lacunares y no lacunares.
Neuroimagen
La neuroimagen es una herramienta diagnóstica importante en la PSD. La resonancia magnética (RM) es la modalidad de neuroimagen clave que ofrece una alta sensibilidad y especificidad para detectar cambios patológicos, incluida la enfermedad de pequeños vasos. Para el diagnóstico de la enfermedad de los vasos pequeños y el deterioro cognitivo posterior a la apoplejía debe utilizarse la IRM con varias secuencias. Se recomiendan normas para la neuroimagen con una terminología ampliamente aceptada que permita comparar los hallazgos [26].
La tomografía por emisión de positrones (PET) permite obtener imágenes de las alteraciones metabólicas localizadas y/o difusas responsables del deterioro cognitivo y la demencia, y es eficaz para diferenciar la demencia vascular de la degenerativa, como la enfermedad de Alzheimer (disminución del metabolismo en la corteza temporo-mesial, temporo-parietal y el cíngulo posterior, metabolismo preservado en la corteza frontal y visual, en la región central y los ganglios basales). También puede detectar cambios inflamatorios y su interacción con los depósitos amiloides para el desarrollo de demencias mixtas tras un ictus [27].
Predictores de imagen
Algunas características de las imágenes de resonancia magnética tienen un valor predictivo respecto a la aparición de la PSD. En un estudio reciente, 294 pacientes con ECV fueron evaluados entre tres y cinco años después de la presentación inicial de un ictus subcortical de tipo lacunar [28]. Durante el seguimiento, se detectó deterioro cognitivo vascular (DCV) de cualquier tipo en 188 (63,9%) de los pacientes con EVS, y 65 (22,1%) cumplían criterios de demencia vascular. El análisis de regresión logística multivariante ajustado por edad y sexo identificó la gravedad global de las hiperintensidades de la sustancia blanca (HR tARWMC 1,42, IC 95% 1,01-2,00; p0,043) y el número total de infartos lacunares (HR 3,06, IC 95% 1,71-5,50; p < 0,001) como predictores independientes del deterioro cognitivo. Otro estudio comparó el valor pronóstico de la atrofia del lóbulo temporal medial y las características de la SVD en una cohorte de 234 pacientes con ictus o AIT [29]. Se exploró la relación entre las características radiológicas sugestivas de la enfermedad de Alzheimer y la EVS y se investigó la asociación de cada una de estas características con el estado cognitivo al año. Las características de la SVD se asociaron de forma independiente con la MTA (p<0,001). Tras ajustar por edad, sexo, discapacidad tras el ictus, hipertensión y diabetes mellitus, la atrofia temporal medial fue la única característica radiológica asociada de forma independiente con el deterioro cognitivo, definido mediante umbrales de mini estado mental (MMSE) ≤26 (odds ratio 1,94; IC 95%1,28-2,94) y MMSE ≤23 (odds ratio 2,31; IC 95%1,48-3,62).
Biomarcadores
Los biomarcadores de la PSD pueden incluir mediadores metabólicos, genéticos e inflamatorios. El alelo e4 de la apolipoproteína E (APOE4) es un conocido factor de riesgo de la enfermedad de Alzheimer [30,31]. La APOE4 también está asociada a las enfermedades cardiovasculares y a los infartos cerebrales [31]. Existen datos contradictorios sobre la asociación del polimorfismo APOE4 con la demencia vascular y la DSP [32–35]. Se ha informado de que el sistema renina-angiotensina, a través de efectos tanto metabólicos como vasculares, está implicado en la patogénesis de la demencia [36,37]. La enzima convertidora de angiotensina (ECA) es una de las enzimas del sistema renina-angiotensina. Los pacientes con genotipo ECA tienen niveles elevados de ECA en el plasma y presentan un mayor riesgo de comorbilidad cardiovascular [38–40]. Estudios anteriores mostraron una asociación entre el alelo ACE y el deterioro cognitivo. Este efecto puede ser mayor en presencia de APOE4 [41,42]. Sin embargo, los estudios que investigaron la ECA como factor predictivo del deterioro cognitivo tras una apoplejía terminaron con datos contradictorios [42,43]. Se ha sugerido que otros biomarcadores como la enzima secretasa B (BACE1) y los niveles del receptor para el producto final de la glicación avanzada (sRAGE) se correlacionan con el deterioro cognitivo inmediatamente después del ictus (evaluado dos semanas después del ictus) [39]. Los niveles de homocisteína, vitamina B12 y ácido fólico se relacionaron con el deterioro cognitivo y el ictus, y podrían desempeñar un papel en la PSD. Sin embargo, en el ensayo VITATOPS la suplementación con vitaminas del grupo B no tuvo ningún efecto sobre la incidencia del deterioro cognitivo o el declive cognitivo [44]. Un entorno inflamatorio excesivo en el cerebro podría agravar el daño post isquémico. Por lo tanto, los individuos con una respuesta inflamatoria elevada al insulto isquémico pueden ser más vulnerables a un mayor daño tisular y a desarrollar PSD.
Se sabe que la inflamación sistémica y los marcadores inflamatorios están asociados con el deterioro cognitivo [45], en particular con la demencia degenerativa como la enfermedad de Alzheimer [46–48]. Los estudios longitudinales mostraron una correlación entre una mayor concentración basal de interleucina 6 (IL-6) [48] y proteína C reactiva (PCR) [49] y el deterioro cognitivo. Sin embargo, aún no se ha establecido la asociación entre inflamación y PSD. Varios estudios recientes han investigado la relación entre los marcadores inflamatorios y la PSD. La velocidad de eritrosedimentación (VSG) [50], la PCR y la IL-6 [51] se sugirieron como predictores de la PSD.
Tratamiento farmacológico y prevención
Existen varias intervenciones farmacológicas para la prevención del deterioro cognitivo tras un ictus. La reducción de la presión arterial a largo plazo tras una apoplejía con perindopril se asoció con un menor deterioro cognitivo y una tendencia a una menor demencia en el ensayo PROGRESS [52].
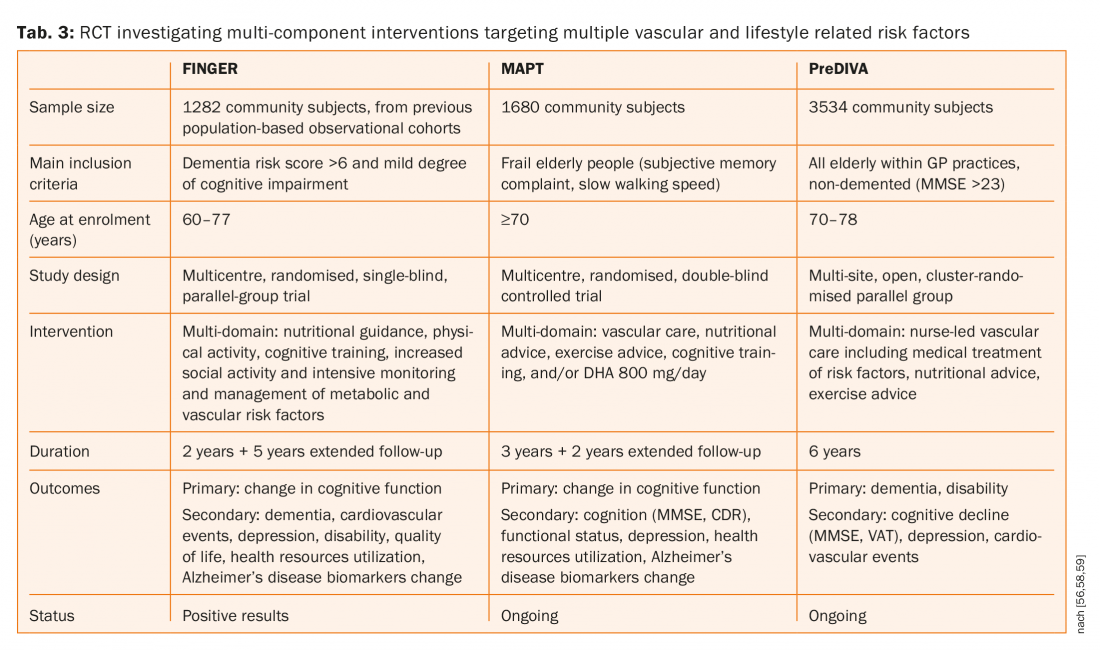
Además, se ha demostrado que las estatinas reducen tanto el primer ictus como los recurrentes, pero ni la simvastatina ni la pravastatina influyeron en la cognición [53,54]. Tres grandes ensayos controlados aleatorizados (FINGER, MAPT y preDIVA, ficha. 3) investigando intervenciones multicomponente dirigidas a múltiples factores de riesgo vasculares y relacionados con el estilo de vida frente a consejos generales de salud (grupo de control) para prevenir el deterioro cognitivo y la demencia [55–58]. Uno de estos tres estudios (FINGER) publicó sus resultados y sugirió que una intervención multidominio podría mejorar o mantener el funcionamiento cognitivo en ancianos en situación de riesgo [55,56]. Hubo 1260 pacientes asignados aleatoriamente al grupo de intervención (n=631) o al grupo de control (n=629). 591 (94%) participantes del grupo de intervención y 599 (95%) del grupo de control tuvieron al menos una evaluación posterior a la línea de base y se incluyeron en el análisis modificado por intención de tratar. El cambio medio estimado en la puntuación de la batería de pruebas neuropsicológicas a los dos años fue de 0,20 en el grupo de intervención y de 0-16 en el grupo de control. La diferencia entre grupos en el cambio de la puntuación total de la batería de pruebas neuropsicológicas por año fue de 0,022 (IC del 95%: 0,002-0,042; p=0,030).
Conclusión
Una proporción importante de pacientes sufrirá demencia o formas más leves de deterioro cognitivo tras un ictus o incluso un AIT. Cierto número de parámetros clínicos y radiológicos pueden predecir la aparición de la PSD. Aunque se ha informado de que el riesgo es mayor en el periodo inmediatamente posterior a la apoplejía, seguirá siendo alto incluso después de varios años. La presencia de este retraso entre el momento del ictus y la aparición de la demencia permite además utilizar una ventana temporal terapéutica para la intervención. Los estudios farmacológicos demostraron que la disminución de la presión arterial a largo plazo tras una apoplejía se asociaba a una reducción del deterioro cognitivo. Recientemente, un gran ensayo controlado aleatorizado demostró que una intervención multidominio podía mejorar o mantener el funcionamiento cognitivo en ancianos en situación de riesgo. Estos resultados sugieren además la influencia positiva de las intervenciones multicomponente dirigidas a múltiples factores de riesgo vasculares y relacionados con el estilo de vida en la aparición de demencia tras un ictus.
Mensajes para llevar a casa
- Los supervivientes de un ictus corren un mayor riesgo de desarrollar un deterioro cognitivo.
- La demencia posterior a un ictus (DSP) se asocia a varios factores que indican, por un lado, una reserva cognitiva reducida que incluye el deterioro cognitivo previo al ictus, la discapacidad premórbida, la enfermedad de la sustancia blanca y la atrofia cerebral y, por otro, aspectos específicos del ictus.
- La resonancia magnética (RM) es la modalidad clave de neuroimagen.
- Aunque se ha propuesto un gran número de biomarcadores para la PSD, todavía no se ha demostrado que ningún parámetro específico pueda predecir de forma sólida la PSD.
- Los estudios farmacológicos demostraron que la disminución de la presión arterial a largo plazo tras una apoplejía se asociaba a una reducción del deterioro cognitivo.
- Un gran ensayo controlado aleatorio sugirió recientemente que una intervención multidominio podría mejorar o mantener el funcionamiento cognitivo en ancianos en situación de riesgo.
Referencias:
- Strong K, Mathers C, et al: Prevención del ictus: salvar vidas en todo el mundo. Lancet Neurol. 2007; 6: 182-187.
- Lees R, Fearon P, Harrison JK, et al.: Evaluación cognitiva y del estado de ánimo en la investigación del ictus: revisión centrada de estudios contemporáneos. Accidente cerebrovascular. 2012; 43: 1678-1680.
- McKevitt C, Fudge N, et al.: Necesidades a largo plazo autoinformadas tras un ictus. Accidente cerebrovascular. 2011; 42: 1398-1393.
- Pollock A, St George B, et al: Las diez principales prioridades de investigación relacionadas con la vida después del ictus. Lancet Neurol. 2012; 11: 209.
- Fride Y, Adamit T, et al.: ¿Cuáles son los correlatos de la cognición y la participación para volver al trabajo tras un primer ictus leve? Rehabilitación de la apoplejía superior. 2015;22(5): 317-325.
- Ballard C, Rowan E, et al.: Estudio prospectivo de seguimiento entre 3 y 15 meses después del ictus: mejoras y declive de la función cognitiva entre los supervivientes de ictus sin demencia >75 años de edad. Ictus 2003; 34: 2440-2444.
- Kalaria RN: Enfermedad cerebrovascular y mecanismos de deterioro cognitivo: pruebas de estudios clinicopatológicos en humanos.Stroke 2012; 43: 2526-2534.
- Pendlebury ST, Rothwell PM: Prevalencia, incidencia y factores asociados a la demencia previa y posterior a la apoplejía: revisión sistemática y metaanálisis. Lancet Neurol. 2009; 8: 1006-1018.
- Pendlebury ST, Chen PJ, et al: Estudio vascular de Oxford. Factores metodológicos en la determinación del riesgo de demencia tras un accidente isquémico transitorio y un ictus: (I) impacto del sesgo de selección de la línea de base. Apoplejía. 2015; 46: 641-646.
- Henon H, Pasquier F, Leys D: La demencia posterior al ictus. Cerebrovasc Dis 2006; 22: 61-70.
- Mijajlović MD, Pavlović A, et al.: Demencia post-ictus: una revisión exhaustiva. BMC Med. 2017 Jan 18; 15(1):11.
- Kokmen E, Whisnant JP, et al.: Demencia tras un ictus isquémico: un estudio poblacional en Rochester, Minnesota (1960-1984). Neurología 1996; 46: 154-159.
- Van Rooij FG, Kessels RP, et al.: Deterioro cognitivo en pacientes con ataque isquémico transitorio: una revisión sistemática. Cerebrovasc Dis. 2016; 42(1-2): 1-9.
- Lees R, Selvarajah J et al.:Precisión de las pruebas de cribado cognitivo para el diagnóstico de la demencia y el deterioro cognitivo multidominio en el ictus. Accidente cerebrovascular. 2014 Oct; 45(10): 3008-3018.
- Gottesman RF, Hillis AE: Predictores y evaluación de la disfunción cognitiva derivada del ictus isquémico. Lancet Neurol 2010; 9: 895-905.
- Pasquier F, Hénon H, Leys D: Factores de riesgo y mecanismos de la demencia post-ictus. Rev Neurol. 1999; 155(9): 749-753.
- Chaudhari TS, Verma R, et al.: Predictores clínico-radiológicos del deterioro cognitivo vascular (DCV) en pacientes con ictus: un estudio observacional prospectivo. J Neurol Sci. 2014 Mayo 15; 340(1-2): 150-158.
- Arba F, Quinn T, et al: Colaboración VISTA. Determinantes del deterioro cognitivo tras un ictus: análisis de VISTA. Acta Neurol Scand. 2017 Jun; 135(6): 603-607.
- Iulita MF, Girouard H: Tratar la hipertensión para prevenir el deterioro cognitivo y la demencia: Reabriendo el debate. Adv Exp Med Biol. 2017; 956: 447-473.
- Kalaria RN: Factores de riesgo y mecanismos neurodegenerativos en la demencia relacionada con el ictus. Panminerva Med. 2012 Sep; 54(3):139-148.
- Teuschl Y, Matz K, Brainin M: Prevención del deterioro cognitivo tras un ictus: una revisión centrada en las intervenciones sobre el estilo de vida. Eur J Neurol. 2013 Ene; 20(1): 35-49.
- Wardlaw JM, Smith EE, et al.: Normas de neuroimagen para la investigación de la enfermedad de pequeños vasos y su contribución al envejecimiento y la neurodegeneración. Lancet Neurol 2013; 12: 822-838.
- Makin SD, Turpin S, et al.: Deterioro cognitivo tras un ictus lacunar: revisión sistemática y metaanálisis de la incidencia, prevalencia y comparación con otros subtipos de ictus. J Neurol Neurosurg Psychiatry. 2013 Ago; 84(8): 893-900.
- Schmidt R, Ropele S, et al.: Imágenes ponderadas por difusión y cognición en el estudio de leucoariosis y discapacidad en ancianos. Ictus 2010; 41: e402-e408.
- Blair GW, Hernández MV, et al.: Neuroimagen avanzada de la enfermedad de pequeños vasos cerebrales. Curr Treat Options Cardiovasc Med. 2017 Jul; 19(7): 56.
- Wardlaw JM, Smith EE, et al.: Normas de neuroimagen para la investigación de la enfermedad de pequeños vasos y su contribución al envejecimiento y la neurodegeneración. Lancet Neurol. 2013; 12: 822-838.
- Heiss W-D, Zimmermann-Meinzingen S: Imágenes PET en el diagnóstico diferencial de la demencia vascular. J Neurol Sci 2012; 322: 268-273.
- Pavlovic AM, Pekmezovic T, et al.: Predictores basales del deterioro cognitivo en pacientes con enfermedad cerebral de pequeños vasos. J Alzheimers Dis. 2014; 42 Suppl 3: 37-43.
- Arba F, Quinn T, et al.: VISTA. Colaboración.Enfermedad de pequeños vasos cerebrales, atrofia del lóbulo temporal medial y estado cognitivo en pacientes con ictus isquémico y accidente isquémico transitorio. Eur J Neurol. 2017 Feb; 24(2): 276-282.
- Bu G: La apolipoproteína E y sus receptores en la enfermedad de Alzheimer: vías, patogénesis y terapia. Nat Rev Neurosci 2009; 10: 333-344.
- Davidson Y, Gibbons L et al.: Frecuencia alélica de la apolipoproteína E épsilon4 en la demencia vascular. Dement Geriatr Cogn Disord 2006; 22: 15-19.
- Hsiung G-YR, Sadovnick AD, Feldman H: El genotipo de la apolipoproteína E épsilon4 como factor de riesgo de deterioro cognitivo y demencia: datos del Estudio canadiense sobre salud y envejecimiento. CMAJ 2004; 171: 863-867.
- Mortimer JA, Snowdon DA, Markesbery WR: El efecto de APOE-epsilon4 sobre la demencia está mediado por la neuropatología del Alzheimer. Alzheimer Dis Assoc Disord 2009; 23: 152-157.
- Rippon GA, Tang MX, et al.: Enfermedad de Alzheimer familiar en latinos: interacción entre APOE, accidente cerebrovascular y sustitución de estrógenos. Neurología 2006; 66: 35-40.
- Jin YP, Østbye T, et al.: Efecto conjunto del ictus y APOE 4 sobre el riesgo de demencia: el Estudio Canadiense de Salud y Envejecimiento. Neurología 2008; 70: 9-16.
- Qian L, Ding L, et al.: Biomarcadores tempranos del deterioro cognitivo posterior al ictus. J Neurol 2012; 259: 2111-2118.
- Kolsch H, Jessen F, et al.: El polimorfismo I/D de la ECA es un factor de riesgo de la enfermedad de Alzheimer pero no de la demencia vascular. Neurosci Lett 2005; 377: 37-39.
- Hassan A, Lansbury A, et al.: El genotipo de inserción/deleción de la enzima convertidora de angiotensina se asocia a la leucoaraiosis en los síndromes lacunares. J Neurol Neurosurg Psychiatry 2002; 72: 343-346.
- Szolnoki Z, Maasz A, et al.: La coexistencia del polimorfismo A1166C del receptor tipo 1 de la angiotensina II y el polimorfismo D/D de la enzima convertidora de la angiotensina sugiere una susceptibilidad al ictus isquémico asociado a vasos pequeños. Neuromolecular Med 2006; 8: 353-360.
- Bartres-Faz D, Junque C, et al.: Polimorfismo de la enzima convertidora de angiotensina II en humanos con deterioro de la memoria asociado a la edad: relación con el rendimiento cognitivo. Neurosci Lett 2000; 290: 177-180.
- Richard F, Berr C, et al.: Efecto del polimorfismo I/D de la enzima convertidora de angiotensina I sobre el deterioro cognitivo. El Grupo de Estudio EVA. Neurobiol Aging 2000; 21: 75-80.
- Bour AMJ, Rasquin SMC, et al.: El efecto del alelo APOE-epsilon4 y del polimorfismo ACE-I/D sobre la cognición durante un seguimiento de dos años en pacientes que han sufrido un ictus por primera vez. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Bour AMJJ, Rasquin SMC, et al.: El efecto del alelo APOE-epsilon4 y del polimorfismo ACE-I/D sobre la cognición durante un seguimiento de dos años en pacientes que han sufrido un ictus por primera vez. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Baum L, Chen X, et al.: Polimorfismos y deterioro cognitivo vascular tras un ictus isquémico. J Geriatr Psychiatry Neurol 2007; 20: 93-99.
- Hankey GJ, Ford AH y otros: Efecto de las vitaminas B y de la reducción de la homocisteína sobre el deterioro cognitivo en pacientes con ictus previo o accidente isquémico transitorio: análisis secundario preespecificado de un ensayo aleatorizado controlado con placebo y metaanálisis. Ictus 2013; 44: 2232-2239.
- Karlsson H, Ahlborg B, et al.: Asociación entre la velocidad de sedimentación globular y el cociente intelectual en varones suecos de 18 a 20 años. Brain Behav Immun 2010; 24: 868-873.
- Craft S: El papel de los trastornos metabólicos en la enfermedad de Alzheimer y la demencia vascular: dos caminos convergentes. Arch Neurol 2009; 66: 300-305.
- Eikelenboom P, van Exel E, et al.: Neuroinflamación: un acontecimiento temprano tanto en la historia como en la patogénesis de la enfermedad de Alzheimer. Neurodegener Dis 2010; 7: 38-41.
- Schram MT, Euser SM et al.: Marcadores sistémicos de inflamación y deterioro cognitivo en la vejez. J Am Geriatr Soc 2007; 55: 708-716.
- Hoth KF, Haley AP, et al.: La proteína C reactiva elevada está relacionada con el deterioro cognitivo en adultos mayores con enfermedades cardiovasculares. J Am Geriatr Soc 2008; 56: 1898-1903.
- Kliper E, Bashat DB et al.: Declive cognitivo tras un ictus: relación con los biomarcadores inflamatorios y el volumen del hipocampo. Ictus 2013; 44: 1433-1435.
- Rothenburg LS, Herrmann N, et al.: La relación entre los marcadores inflamatorios y el deterioro cognitivo posterior al ictus. J Geriatr Psychiatry Neurol 2010; 23: 199-205.
- Tzourio C, Anderson C, et al.: Efectos de la reducción de la presión arterial con el tratamiento con perindopril e indapamida sobre la demencia y el deterioro cognitivo en pacientes con enfermedad cerebrovascular. Arch Intern Med 2003; 163: 1069-1075.
- Collins R, Armitage J: Grupo de colaboración del estudio de protección cardiaca. Efectos de la reducción del colesterol con simvastatina sobre el ictus y otros eventos vasculares mayores en 20536 personas con enfermedad cerebrovascular u otras afecciones de alto riesgo. Lancet 2004; 363: 757-767.
- Shepherd J, Blauw GJ, et al.: Pravastatina en ancianos con riesgo de enfermedad vascular (PROSPER): un ensayo controlado aleatorizado. Lancet 2002; 360: 1623-1630.
- Kivipelto M, Solomon A, et al: The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): study design and progress. Alzheimers Dement 2013; 9: 657-665.
- Ngandu T, Lehtisalo J, et al.: A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet. 2015 Jun 6; 385(9984): 2255-2263.
- Carrie I, van Kan GA, et al.: Estrategias de reclutamiento para ensayos preventivos. El estudio MAPT (Ensayo Preventivo Multidominio del Alzheimer). J Nutr Health Aging 2012; 16: 355-359.
- Richard E, Van den Heuvel E, et al.: Prevención de la demencia mediante cuidados vasculares intensivos (PreDIVA): un ensayo aleatorizado por grupos en curso. Alzheimer Dis Assoc Disord 2009; 23: 198-204.
InFo NEUROLOGIE & PSYCHIATRIE 2018; 16(1): 31-37