Con las pruebas genéticas más modernas, hoy se pueden realizar diagnósticos que de otro modo no serían posibles. El esclarecimiento genético también es importante para el asesoramiento familiar y el tratamiento farmacológico. Pero tenga cuidado: no todas las pruebas genéticas son iguales.
El progreso constante de la genética humana, comparable al desarrollo exponencial de la tecnología informática, está conduciendo a la identificación de la causa de cada vez más enfermedades genéticas. Hoy en día, cada vez más se puede hacer un diagnóstico, confirmarlo o descartarlo mediante pruebas genéticas del material genético (ADN). Estas pruebas genéticas con fines médicos (diagnósticos genéticos), en las que se centra este artículo, no deben confundirse con las pruebas genéticas (de estilo de vida) con fines no médicos de Internet o la farmacia (Fig. 1).
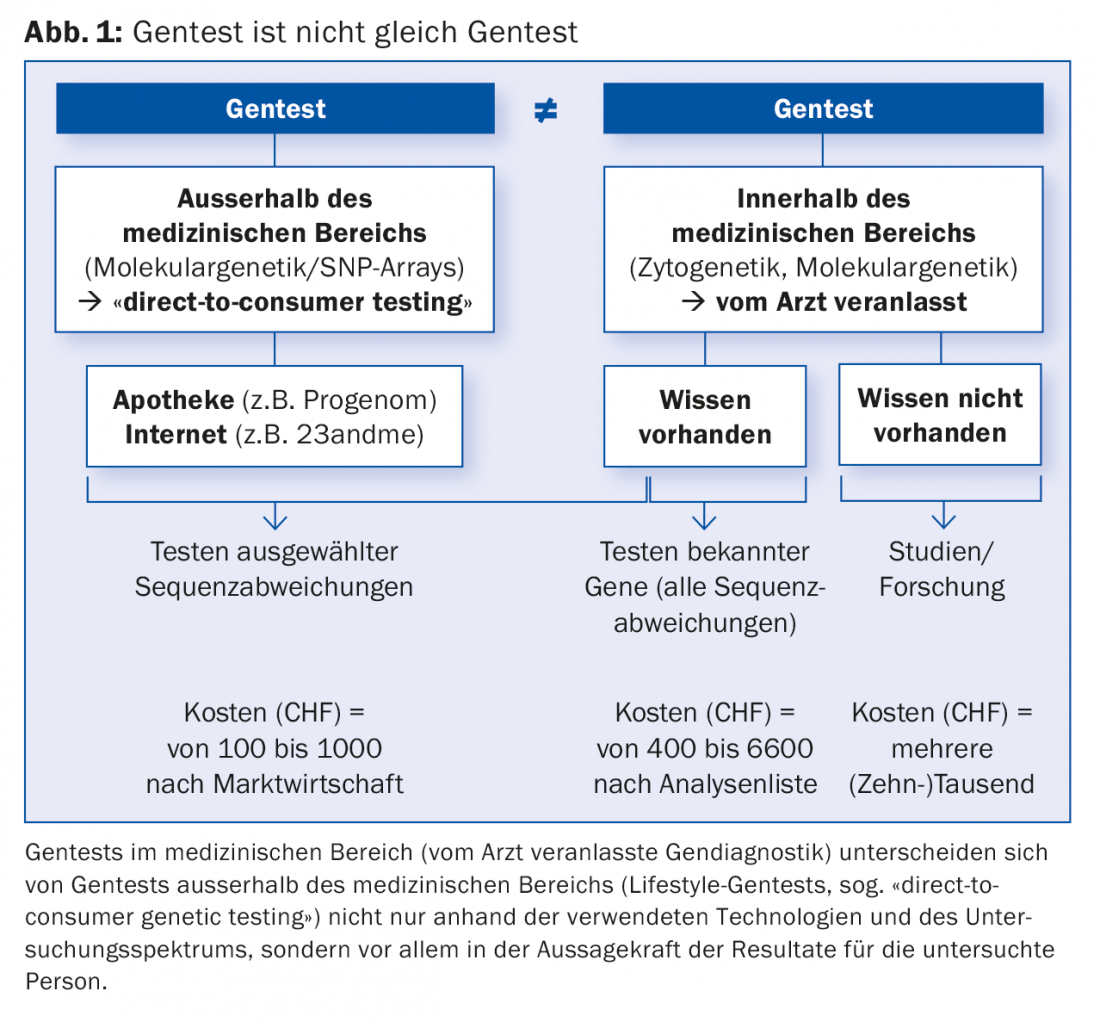
Creciente importancia del diagnóstico genético
Las enfermedades monogénicas están causadas por la mutación de un único gen, mientras que en las enfermedades multifactoriales comunes las influencias (genéticas) suelen ser múltiples y sólo fuertes en suma. El diagnóstico genético puede realizarse antes o después del nacimiento examinando los cromosomas (citogenética) y/o los genes (genética molecular) y se utiliza principalmente en situaciones en las que los exámenes clínicos no permiten un diagnóstico concluyente. Esto es especialmente importante en las primeras fases de una enfermedad y en niños y adolescentes. Si se conoce la mutación causante de la enfermedad, también puede aclararse de forma presintomática en los parientes consanguíneos si existe o no una predisposición genética a la enfermedad familiar. Cabe señalar que el esclarecimiento genético de una enfermedad de manifestación tardía y el estado de portador de una enfermedad recesiva están reservados a los adultos.
El diagnóstico del defecto genético subyacente permite un tratamiento específico de la enfermedad y, en algunos casos, las estrategias terapéuticas pueden adaptarse a la mutación causante individual. La investigación busca constantemente nuevos medicamentos a medida que tengan en cuenta las características genéticas individuales de los pacientes (“medicina personalizada/de precisión”). La importancia de la farmacogenética, que permite la selección y dosificación de un fármaco adecuado, también aumenta constantemente, ya que puede ayudar a evitar efectos secundarios, pérdidas de tiempo innecesarias en la instauración de la medicación y los costes asociados.
Diagnóstico genético de alto rendimiento
El método más importante para la investigación selectiva de genes es la secuenciación del ADN, que puede determinar la secuencia de las bases nucleotídicas del material genético (A, T, G, C) y detectar así con precisión las mutaciones genéticas. Estos análisis de genes se llevan a cabo con una eficacia sin precedentes mediante la secuenciación de alto rendimiento (“secuenciación de próxima generación”, NGS). La NGS es más eficaz que el análisis clásico de un solo gen mediante la secuenciación de Sanger y tiene especial éxito en la detección de las causas de las enfermedades, así como en el análisis del ADN libre de células que circula en la sangre y en el examen unicelular de las muestras biológicas más pequeñas.
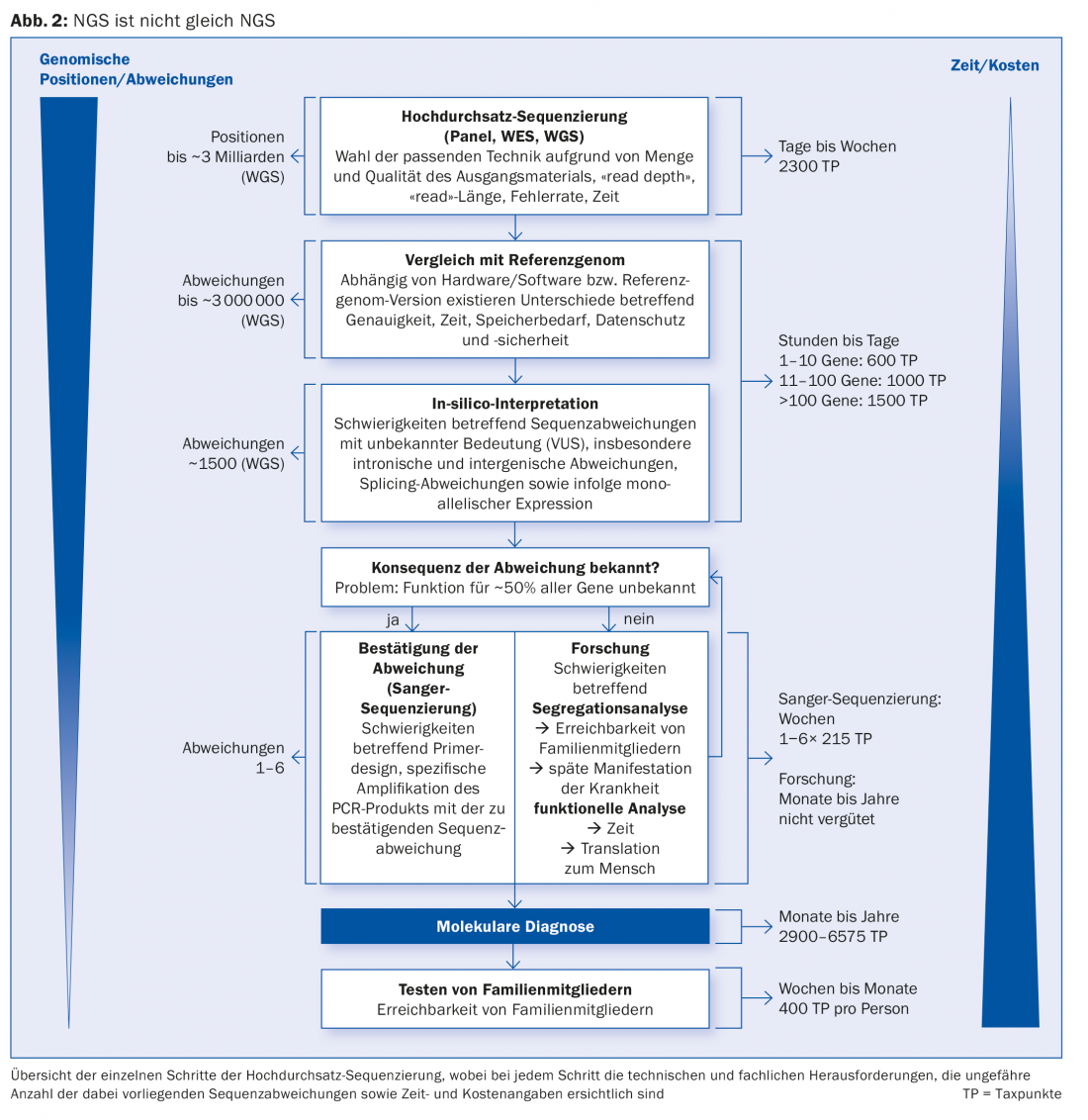
En la NGS, se examina una combinación seleccionada (denominada panel) de genes (“secuenciación dirigida”, TS), el genoma completo (“secuenciación del genoma completo”, WGS; ~3 mil millones de bases de nucleótidos) o su región codificante (“secuenciación del exoma completo”, WES; ~20 000 genes). Sólo por esta razón, no toda la NGS es igual (Fig. 2) . Además, existe la diferencia de rendimiento y calidad entre los métodos NGS, que es relevante para el diagnóstico genético.
La ST puede analizar determinadas regiones genéticas de forma especialmente intensiva registrando la secuencia de más de 1.000 copias de ADN (“lecturas”) y detectando así pequeñas cantidades (<1:100) de alelos no de referencia, que están presentes en forma del llamado mosaico. Esto es especialmente necesario en la investigación genética de los cánceres somáticos. La ST también se considera barata y, por lo tanto, se utiliza a menudo para el primer paso en el cribado de mutaciones. Sin embargo, si la mutación causante de la enfermedad no se encuentra con la ET, la enfermedad permanece sin diagnosticar y el examen debe repetirse con WES o, aún mejor, con WGS. Precaución: Un hallazgo negativo en los genes asociados a la enfermedad investigada en el momento de la aclaración no significa que la enfermedad no pueda ser genética.
Retos de la secuenciación de alto rendimiento
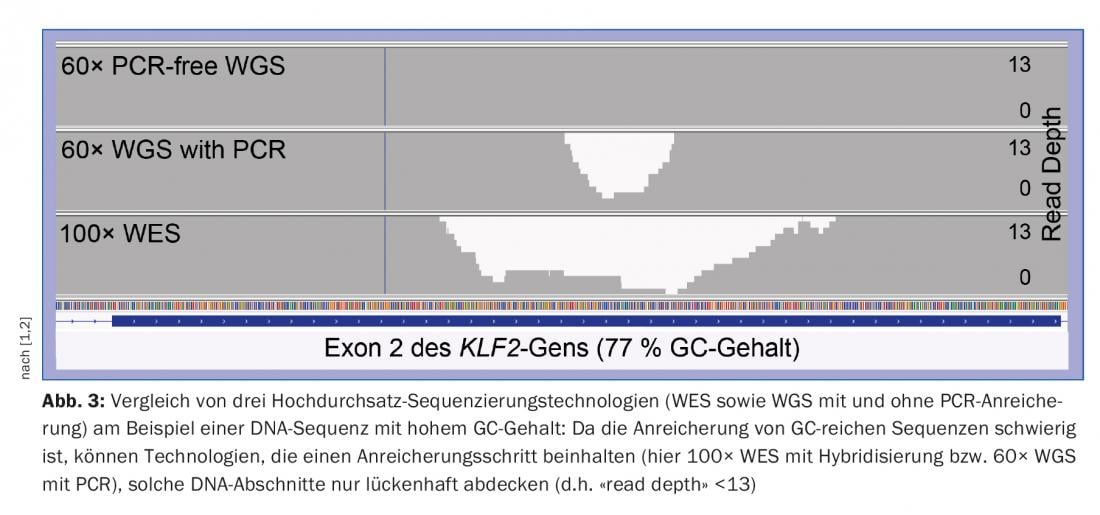
La NGS presenta importantes limitaciones en términos de diagnóstico genético. En primer lugar, la longitud de lectura de la secuencia de la tecnología NGS de Illumina, líder del mercado, es demasiado corta (~150 bases de nucleótidos) para asignar regiones génicas repetitivas/homólogas más largas al genoma de referencia con una posición única. Las últimas tecnologías de secuenciación (“secuenciación de tercera generación”), por ejemplo de Pacific Biosciences u Oxford Nanopore Technologies, que pueden leer fragmentos de ADN significativamente más largos, de varios miles de bases de nucleótidos, prometen un remedio. Por otro lado, la NGS de regiones de ADN ricas en GC es más difícil porque el par de bases de nucleótidos G y C tiene una unión más fuerte que el par A y T. Especialmente en TS y WES, las regiones genéticas ricas en GC, como ocurre en muchos casos al principio de un gen, no se cubren suficientemente (es decir, no se cubren suficientemente con “lecturas de secuenciación”), por lo que a menudo no se cumplen suficientemente las exigencias de calidad de los diagnósticos genéticos [1]. Con la WGS, este problema se da mucho menos, por lo que la WGS no sólo tiene la ventaja de cubrir la región no codificante del genoma, sino que también cubre mejor que la WES las regiones codificantes de especial importancia clínica (exones), sobre todo en las regiones ricas en GC. (Fig.3). Así pues, la WGS es superior a la WES y permite actualmente el mejor diagnóstico genético posible de las enfermedades congénitas cuyas causas se desconocen o que se basan en mutaciones en genes grandes y complejos [2].
La gran cantidad de datos (big data) generados en el contexto de una WGS puede reducirse al nivel de TS y WES con paneles de genes virtuales (in silico) y centrarse en la cuestión clínica. Además, el control de calidad y la interpretación de la cantidad de datos generados por la NGS es un reto elaborado, tanto económico como intelectual, que aún no se refleja adecuadamente en la lista de análisis (AL) en vigor desde 2015 con la nueva posición para la NGS. Especialmente la recopilación e interpretación de aquellos datos de NGS que son importantes para el diagnóstico requieren muchos conocimientos de genética humana y pueden llevar mucho tiempo. Esto se aplica, por ejemplo, cuando se encuentran desviaciones de secuencia potencialmente patógenas en genes cuya función aún no se conoce (completamente), lo que sigue siendo el caso de aproximadamente la mitad (~10 000) de todos los genes humanos actuales.
Aunque los programas informáticos de interpretación actuales tienen en cuenta muchos parámetros diferentes y proporcionan bases importantes para la evaluación, la interpretación de tales desviaciones de secuencia (las denominadas “variantes de significado desconocido”, VUS) con certeza diagnóstica requiere al menos un análisis de segregación elaborado en la familia (si es posible) y/o ensayos/estudios funcionales (por ejemplo, utilizando un modelo animal correspondiente).
Hallazgos incidentales clínicamente relevantes
Antes de un examen genético, también debe discutirse con la persona a examinar si cualquier hallazgo incidental con importancia clínica pero sin referencia a la pregunta de la investigación (los llamados “hallazgos incidentales”) sólo deben comunicarse si se conocen las medidas preventivas o de tratamiento [3]. Esto demuestra por sí solo que los resultados de un examen genético no son comparables a los de otras pruebas médicas de laboratorio y que su evaluación debe estar en manos expertas de especialistas en genética médica FAMH/FMH. Por ello, la actual lista de análisis estipula que la NGS de más de diez genes sólo puede ser prescrita por médicos con un título federal de postgrado en “genética médica”. El asesoramiento genético que exige la ley antes y después de un examen genético también debe ser proporcionado por médicos genetistas (GUMG Art. 14). El asesoramiento sólo debe tener en cuenta la situación individual y familiar de la persona afectada y no los intereses sociales generales. Debe tener en cuenta los posibles efectos psicológicos y sociales del resultado del examen sobre la persona afectada y su familia.
Reembolso por el seguro básico
El diagnóstico genético es una actividad especialmente responsable. Por regla general, los hallazgos genéticos no sólo afectan a la persona examinada durante toda su vida (“valor de por vida”), sino que pueden influir en toda la familia a lo largo de generaciones. Un diagnóstico incorrecto o la ausencia del mismo pueden conducir a un tratamiento incorrecto con graves consecuencias, a estrés psicológico y restricciones innecesarias o al nacimiento de más niños gravemente afectados. Más allá de la carga o la enfermedad de los pacientes individuales y sus familias, esto también puede dar lugar a costes económicos considerables. Por el contrario, la parte de todos los análisis de diagnóstico genético y de laboratorio representa en conjunto tan sólo un 3% de los costes anuales totales de nuestro sistema sanitario.
La lista de análisis (www.bag.admin.ch) regula la remuneración de la NGS, que sólo puede cobrarse si los costes del análisis clásico de un solo gen mediante secuenciación Sanger fueran superiores a 2795 puntos fiscales (TP), lo que se aplica a los genes con más de 13 secuencias diana (exones). La tarifa para la NGS consiste en la secuenciación de alto rendimiento propiamente dicha (2300 TP) y el análisis bioinformático para 1-10 genes (600 TP), para 11-100 genes (1000 TP) o para más de 100 genes (1500 TP). Junto con la investigación confirmatoria de los resultados NGS positivos, la lista de análisis prevé una remuneración de 2900 TP a 6575 TP, que, sin embargo, no cubre los costes de la aclaración genética de los casos clínicamente complejos (raros) hasta el punto final de diagnóstico. Es difícil creer que esta brecha en el sistema sanitario suizo tenga que cerrarse con el compromiso de la población y las organizaciones privadas (cf. stiftung-seltene-krankheiten.ch). Además, los exámenes genéticos que figuran explícitamente en la lista de análisis son rechazados arbitrariamente por varias compañías de seguros médicos, por lo que también en este caso es urgente actuar. El reembolso de las pruebas genéticas con fines médicos debe mejorar para que los avances de gran relevancia clínica en el campo de la genética humana puedan traducirse en diagnósticos.
Outlook
En el futuro, el diagnóstico genético será crucial, no sólo para la detección de defectos genéticos causantes de enfermedades, sino también para el análisis farmacogenético de los genes que ayudan a determinar la farmacocinética y la dinámica de los fármacos utilizados y, por tanto, su selección y dosificación. Además, aumentará la importancia médica del registro de las mutaciones genéticas somáticas. Los cambios (epi)genéticos que no afectan directamente a la secuencia de ADN de los genes, sino a su regulación, también están siendo cada vez más estudiados y comprendidos. También pueden identificarse fuertes efectos genéticos en enfermedades multifactoriales comunes.
Nuevos métodos como CRISPR/Cas abren posibilidades pero también peligros en el tratamiento de enfermedades genéticas. A pesar de los prometedores resultados de los experimentos in vivo realizados hasta ahora, esta tecnología aún está lejos de abrirse camino en la práctica médica diaria. Por un lado, porque el método aún no está totalmente desarrollado y, por otro, porque es necesario debatir las cuestiones éticas y jurídicas para limitar cualquier posibilidad de abuso.
Sin embargo, es obvio que la genética determinará el futuro de la medicina y que ésta se orientará hacia la genética en la prevención, el diagnóstico y la terapia.
Mensajes para llevarse a casa
- No todas las pruebas genéticas son iguales: Los métodos utilizados determinan la importancia de cada prueba.
- Con las pruebas genéticas de última generación adecuadas, hoy en día se pueden realizar diagnósticos que de otro modo no serían posibles.
- La aparición frecuente y/o precoz o sindrómica de una enfermedad en la familia puede indicar una causa genética.
- El esclarecimiento genético es importante no sólo para el diagnóstico, el pronóstico, la prevención y el asesoramiento familiar, sino también para el tratamiento causal o farmacológico.
Literatura:
- Meienberg J, et al.: Nuevos conocimientos sobre el rendimiento de las plataformas de captura del exoma completo humano. Nucleic Acids Res 2015; 43: e76.
- Meienberg J, et al: Secuenciación clínica: ¿es la WGS la mejor WES? Hum Genet 2016; 135: 359-362.
- Kalia SS, et al: Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2016 update (ACMG SF v2.0): a policy statement of the American College of Medical Genetics and Genomics. Genet Med 2017; 19: 249-255.
Para saber más:
- Henggeler C, Matyas G: Formas de diagnóstico – pruebas genéticas con fines médicos. HAUSARZT PRAXIS 2015; 10(3): 4.
- Matyas G, Henggeler C, Oexle K: Genética cardiovascular y diagnóstico genético. Medinfo 2015; 2: 16-24.
- Matyas G, Spiegel R: Aclaración genética con fines médicos. Medinfo 2012; 2: 50-58.
- Oexle K, Henggeler C, Matyas G: La creciente importancia de la genética en la medicina. HAUSARZT PRAXIS 2015; 10(9): 9.
PRÁCTICA GP 2017; 12(9): 14-18











