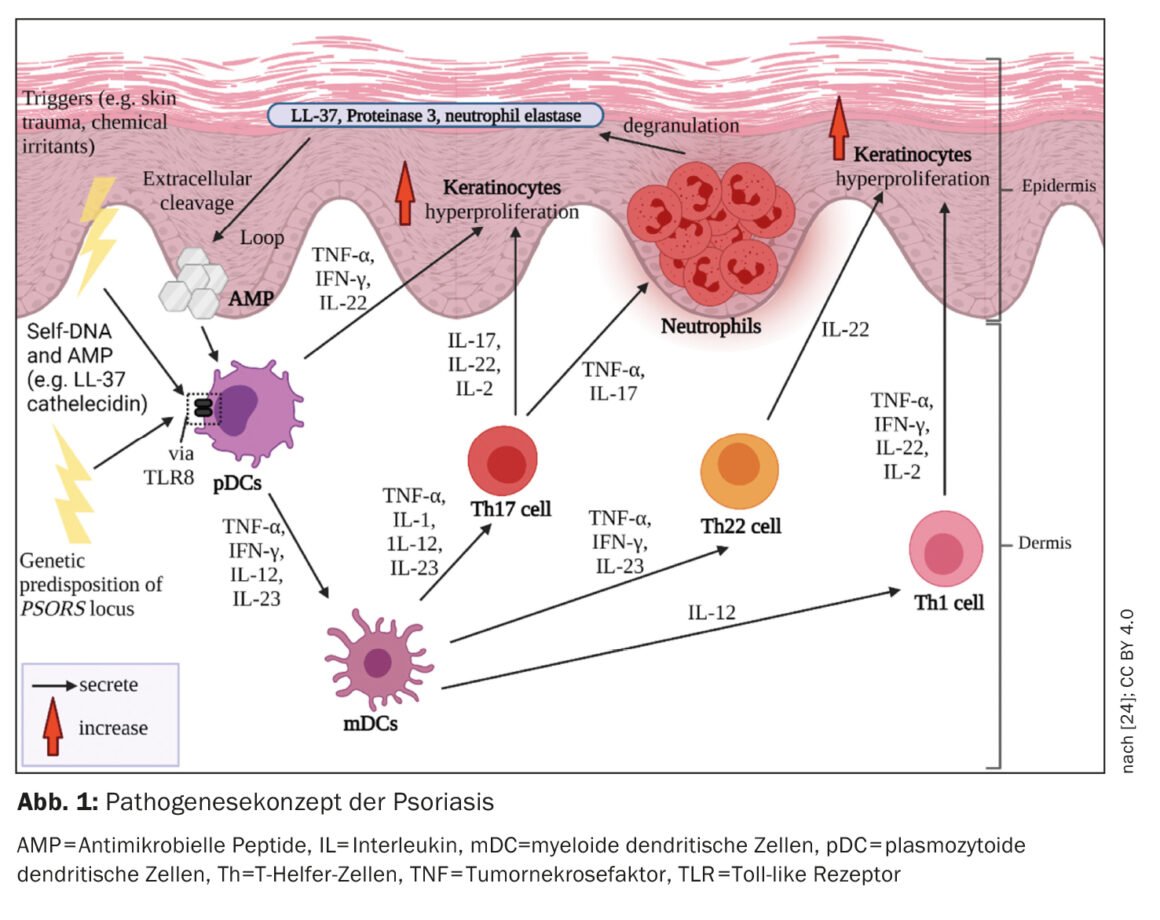
Los innovadores tratamientos sistémicos para la psoriasis son un excelente ejemplo de medicina traslacional. En una revisión publicada el año pasado en la revista Journal of Investigative Dermatology, el Dr. Peter van de Kerkhof, ex presidente de la Sociedad Europea de Investigación Dermatológica (ESDR) y jefe médico del Consejo Internacional de Psoriasis, ofrece una actualización de los conceptos inmunopatogénicos relevantes para la terapia de la psoriasis.
En las últimas décadas se ha avanzado considerablemente en la elucidación de la compleja y multifactorial patogenia de la psoriasis como base para el desarrollo de opciones terapéuticas altamente eficaces [1]. Hoy en día, a nivel celular y molecular, se considera que el patomecanismo esencial es una respuesta inmunitaria mediada por células T y un medio de citocinas característico asociado [2]. A nivel genético, se han identificado numerosos loci genéticos asociados a la psoriasis. El HLA-C*06:02 se considera el principal alelo de riesgo de la psoriasis vulgar [3]. Se localiza en el locus de susceptibilidad a la psoriasis PSORS1. Se aportaron pruebas de la existencia de patomecanismos autoinmunes en la psoriasis al descubrirse que el HLA-C*06:02 provocaba una respuesta autoinmune contra el ADAMTSL5, un autoantígeno melanocítico [17,18]. Además de ADAMTSL5, LL-37/Cathelicidin y PLA2G4D son otros dos autoantígenos potenciales que parecen desempeñar un papel en el inicio o el mantenimiento de las lesiones psoriásicas [19].
La psoriasis como enfermedad autoinmune mediada por células T
Los procesos del sistema inmunitario innato y adquirido intervienen en la inmunopatogénesis de la psoriasis (Fig. 1). In el inicio de la cascada inflamatoria intervienen células del sistema inmunitario innato. Aquí, las células dendríticas (CD) y los macrófagos parecen desempeñar un papel clave en el establecimiento de una respuesta inmunitaria dominada por las células T helper-1 (Th1) y Th17. La activación de las CD en la piel conduce a la liberación de interleucinas-12 (IL-12) e IL-23, que estimulan a las células T ingenuas a diferenciarse en células Th1 (por la IL-12) y Th17 (por la IL-23) [4]. Las células T helper (Th) coordinan la respuesta inmunitaria adaptativa mediada por células. Las células Th1 y Th17 activadas secretan las citocinas IFN-γ y TNF-α e IL-17 e IL-22, respectivamente, que impulsan la patogénesis posterior [5,6].
Entorno proinflamatorio
En la psoriasis, la respuesta inmunitaria está mediada principalmente por las células Th1. mientras que en la dermatitis atópica existe una dominancia Th2. Las poblaciones de células T en biopsias de lesiones psoriásicas, que mostraron infiltrados de células T diferentes en comparación con las lesiones en el contexto de la dermatitis atópica en el mismo paciente, confirman el paradigma Th1/Th2 [1,8]. El TNF-α, el IFN-γ, la IL-17A, la IL-17F, la IL-22 y la IL-6 forman una red de citoquinas en las lesiones psoriásicas que, entre otras cosas, induce la hiperproliferación de los queratinocitos [1]. El proceso de diferenciación acelerado de los queratinocitos acorta su tiempo de tránsito del estrato basal al estrato córneo de unos 30 a 5-8 días [9]. El resultado es la descamación y el engrosamiento de la epidermis típicos de la psoriasis. Los queratinocitos activados también producen mediadores proinflamatorios y expresan moléculas de adhesión en la superficie celular, lo que conduce a la amplificación y cronificación de la respuesta inmunitaria [10].
Memoria inmunológica: Células T de memoria residentes en el tejido
Las lesiones psoriásicas presentan un recuento total de células inmunitarias superior al de la piel sana [11]. Incluso en la piel de los pacientes con psoriasis, que clínicamente no presenta lesiones, pudo detectarse un mayor número de células T que en la piel sana [11]. La acumulación intraepidérmica de células CD8 es crucial para el desarrollo de las lesiones psoriásicas [1]. Pero, ¿cómo se produce? Tras la presentación de los autoantígenos a las células dendríticas, se produce la activación de las células T. Las células T activadas migran a la epidermis, por lo que son necesarios procesos complejos para entrar en ella; se sospecha que las integrinas α1β1 desempeñan un papel importante en ello. El bloqueo de α1β1 mediante un anticuerpo monoclonal provocó la acumulación de células T epidérmicas y el desarrollo de lesiones psoriásicas en el modelo de ratón [12].
Las células T, que se localizan en la epidermis, desempeñan un papel extremadamente importante en la patogénesis de la psoriasis. En las placas psoriásicas, las células CD4 positivas se encuentran principalmente en la dermis y las CD8 positivas predominantemente en la epidermis [13]. Una gran proporción de las células CD8 positivas de la epidermis pertenecen a las “células T de memoria residentes en el tejido” (células TRM, CD8+ TRM). Se trata de células T de memoria que permanecen en las lesiones psoriásicas aclaradas y mantienen una memoria inmunológica, lo que explica por qué las lesiones psoriásicas reaparecen a menudo en los mismos sitios [14]. Los TRM CD8+ son un biomarcador potencial de la actividad residual de la enfermedad [15,16].
Revisión de la historia clínica: terapias sistémicas antipsoriásicas
En la década de 1980, los estudios con el inmunosupresor ciclosporina A, que resultó eficaz en el tratamiento de la psoriasis, confirmaron que se trataba de una enfermedad mediada por las células T [26,27]. La ciclosporina inhibe la fosfatasa calcineurina en el citoplasma y bloquea así la fosforilación del factor nuclear de las células T (NFATc), responsable de la activación de los genes de diversas citocinas proinflamatorias [1]. Los efectos antipsoriásicos de los anti-CD4 y CTLA-4-Ig [28,29] proporcionaron un apoyo adicional a la tesis de que las células T son una diana terapéutica importante. En la década de 1990, un grupo de investigación estadounidense demostró que podían inducirse lesiones inyectando células T autólogas en piel psoriásica no enferma injertada en ratones SCID [30]. En el mismo modelo, se demostró que los linfocitos T CD4+ inducen lesiones psoriásicas en piel psoriásica no enferma [31].
| Anticuerpos monoclonales y moléculas pequeñas Los productos biológicos han revolucionado las opciones de tratamiento de la psoriasis. Con las sustancias activas biológicas disponibles hoy en día, se puede lograr un control de la enfermedad eficaz y seguro a largo plazo. Mientras que el uso de anticuerpos anti-TNF-α puede lograr PASI75# en la mayoría de los pacientes, los anticuerpos anti-IL17A y los anticuerpos anti-IL-23 conducen a PASI100** en aproximadamente la mitad de los pacientes, lo que pone de relieve la relevancia de la vía IL-23/IL-17 en la psoriasis. La eficacia de los biológicos se ha comparado en metaanálisis en red [20]. Dependiendo de las características del paciente, incluidas las comorbilidades que pueda presentar, es más preferible una u otra clase de sustancia. En Suiza, además de los inhibidores del TNF-α y el anticuerpo contra la IL12-/23 ustekinumab, actualmente están aprobados varios principios activos de los grupos de los anticuerpos anti-IL17A (secukinumab, ixekizumab) y los anticuerpos anti-IL-23 (guselkumab, risankizumab, tildrakizumab) [25]. Y el inhibidor de IL17A/17F bimekizumab también ha superado ahora los obstáculos para su aprobación [25]. Del campo de las “moléculas pequeñas”, el inhibidor de la PDE-4 apremilast es un fármaco oral aprobado. Además, actualmente se están probando clínicamente el deucravacitinib (TYK2-i oral), el roflumilast (PDE-4-i tópico) y el tapinarof (agonista AHR tópico) [21–23]. |
| # PASI75 = una mejora en el PASI (Índice de Área y Gravedad de la Psoriasis) de al menos el 75%. ** PASI 100 = una mejora del PASI (índice de área y gravedad de la psoriasis) del 100%. |
Se sabe que las células CD4+ Th segregan diversas citocinas. La importancia de estas sustancias mensajeras en la patogénesis de la psoriasis queda confirmada por la muy buena respuesta terapéutica con la neutralización dirigida de citoquinas individuales del sistema inmunitario. En primer lugar, se descubrió que el bloqueo del TNF-α ayudaba a aliviar la psoriasis [32,33]. Posteriormente se aprobó el ustekinumab, un biológico dirigido contra la subunidad p40 común de la IL-12 y la IL-23, que demostró una buena eficacia en la psoriasis [1]. Los anticuerpos monoclonales que se dirigen selectivamente a la subunidad p19 de la IL-23 (guselkumab, risankizumab, tildrakizumab) han demostrado ser aún más eficaces (recuadro). Los biológicos dirigidos contra la IL-17A (secukinumab, ixekizumab) o que provocan una inhibición dual de la IL-17A y la IL17F (bimekizumab) también son muy eficaces (véase el recuadro).
Además de las diversas clases de productos biológicos (antagonistas del TNFα-, la IL-17-, la IL-12/23- o la IL-23-) y los terapéuticos sistémicos convencionales (ciclosporina A, metotrexato, acitretina o ésteres del ácido fumárico), los agentes de moléculas pequeñas también desempeñan un papel en la farmacoterapia de la psoriasis. El apremilast es un inhibidor oral de la PDE-4 (fosfodiesterasa-4) que está aprobado para el tratamiento de la psoriasis, entre otras afecciones. Los efectos antiinflamatorios del apremilast se producen por un aumento de los niveles intracelulares de AMPc. Además, actualmente se está probando en ensayos clínicos el Roflumilast, un inhibidor de la PDE-4 de aplicación tópica [34]. Esto también se aplica a otros representantes de las “pequeñas moléculas” (recuadro) .
Literatura:
- van de Kerkhof PC: From Empirical to Pathogenesis-Based Treatments for Psoriasis. J Invest Dermatol 2022; 142(7): 1778–1785.
- Di Meglio P, Villanova F, Nestle FO: Psoriasis. Cold Spring Harb Perspect Med 2014; 4(8): 1–30.
- Prinz JC: Human Leukocyte Antigen-Class I Alleles and the Autoreactive T Cell Response in Psoriasis Pathogenesis. Front Immunol 2018; 9: 954.
- Schäkel K, Schön M, Ghoreschi K: Pathogenese der Psoriasis vulgaris. Der Hautarzt 2016; 67(6): 422–431.
- Di Cesare A, Di Meglio P, Nestle FO: The IL-23/Th17 axis in the immunopathogenesis of psoriasis. Journal of Investigative Dermatology 2009; 129(6): 1339–1350.
- Lynde CW, et al.: Interleukin 17A: toward a new understanding of psoriasis pathogenesis. Journal of the American Academy of Dermatology 2014; 71(1): 141–150.
- Johansen C, et al.: Inverse regulation of the nuclear factor-κB binding to the p53 and interleukin-8 κB response elements in lesional psoriatic skin. Journal of investigative Dermatology 2005; 124(6): 1284–1292.
- Eyerich S, et al.: Mutual antagonism of T cells causing psoriasis and atopic eczema.N Engl J Med 2011; 365: 231–238.
- Schneider S, Li L, Zink A: Psoriasis – Differentialdiagnosen und Therapie. Akt Rheumatol 2022; 47: 324–332.
- Greb JE, et al.: Psoriasis. Nature Reviews Disease Primers 2016; 2: 16082.
- Lowes MA, et al.: Increase in TNF-alpha and inducible nitric oxide synthase-expressing dendritic cells in psoriasis and reduction with efalizumab (anti-CD11a). Proc Natl Acad Sci U S A 2005; 102: 19057–19062.
- Conrad C, et al.: Alpha1beta1 integrin is crucial for accumulation of epidermal T cells and the development of psoriasis. Nat Med 2007; 13: 836–842.
- Bovenschen HJ, Seyger MM, van de Kerkhof PC: Plaque psoriasis vs. atopic dermatitis and lichen planus: a comparison for lesional T-cell subsets, epidermal proliferation and differentiation. Br J Dermatol 2005; 153: 72–78.
- Clark RA: Resident memory T cells in human health and disease. Sci Transl Med. 2015 Jan 7; 7(269): 269rv1.
- Cheuk S, et al. Epidermal Th22 and Tc17 cells form a localized disease memory in clinically healed psoriasis. J Immunol 2014; 192: 3111–3120.
- Benezeder T, Wolf P: Resolution of plaque-type psoriasis: what is left behind (and reinitiates the disease). Semin Immunopathol 2019; 41: 633–644.
- Prinz JC: Melanocytes: Target Cells of an HLA-C*06:02-Restricted Autoimmune Response in Psoriasis. J Invest Dermatol 2017; 137(10): 2053–2058.
- Arakawa A, et al.: Melanocyte antigen triggers autoimmunity in human psoriasis. J Exp Med 2015; 212(13): 2203–2212.
- Hawkes JE, Chan TC, Krueger JG: Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol 2017; 140(3): 645–653.
- Armstrong AW, et al.: Comparison of biologics and oral treatments for plaque psoriasis: a meta-analysis. JAMA Dermatol 2020; 156: 258–269.
- Papp K, et al.: Phase 2 trial of selective tyrosine kinase 2 inhibition in psoriasis. N Engl J Med. 2018; 379: 1313–1321.
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
- Robbins K, et al.: Phase 2, randomized dose-finding study of tapinarof (GSK2894512 cream) for the treatment of plaque psoriasis. J Am Acad Dermatol 2019; 80: 714–772.
- Mohd Noor AA, Azlan M, Mohd Redzwan N: Orchestrated Cytokines Mediated by Biologics in Psoriasis and Its Mechanisms of Action. Biomedicines. 2022 Feb 20;10(2): 498. www.mdpi.com/2227-9059/10/2/498,(última consulta: 15 Mar 3023).
- Información sobre medicamentos, www.swissmedicinfo.ch,(última consulta: 15.03.2023)
- Ellis CN, et al.: Cyclosporine improves psoriasis in a double-blind study. JAMA 1986; 256: 3110–3116
- Griffiths CE, et al.: Clearance of psoriasis with low dose cyclosporin. Br Med J (Clin Res Ed) 1986; 293: 731–732.
- Abrams JR, et al.: Blockade of T lymphocyte costimulation with cytotoxic T lymphocyte-associated antigen 4-immunoglobulin (CTLA4Ig) reverses the cellular pathology of psoriatic plaques, including the activation of keratinocytes, dendritic cells, and endothelial cells. J Exp Med 2000; 192: 681–694.
- Nicolas JF, et al.: CD4 antibody treatment of severe psoriasis. Lancet 1991; 338: 321
- Wrone-Smith T, Nickoloff BJ: Dermal injection of immunocytes induces psoriasis. J Clin Invest. 1996; 98: 1878–1887.
- Nickoloff BJ, Wrone-Smith T: Injection of pre-psoriatic skin with CD4+ T cells induces psoriasis. Am J Pathol 1999; 155: 145–158.
- Zaba LC, et al. : Amelioration of epidermal hyperplasia by TNF inhibition is associated with reduced Th17 responses [published correction in J Exp Med 2008;205:1941]. J Exp Med. 2007; 204: 3183–3194.
- Zaba LC, et al.: et al. Effective treatment of psoriasis with etanercept is linked to suppression of IL-17 signalling, not immediate response TNF genes. J Allergy Clin Immunol. 2009; 124: 1022–1030.E395
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
DERMATOLOGIE PRAXIS 2023; 33(2): 20–22