A menudo, se presta poca atención a los linfomas cutáneos. Y, sin embargo, han ocurrido muchas cosas en los últimos años. Así, también están surgiendo opciones de tratamiento innovadoras para estas enfermedades raras a través de nuevas opciones terapéuticas como los conjugados anticuerpo-fármaco, la inmunoterapia y los virus oncolíticos. Una caracterización genética e inmunobiológica cada vez más precisa permite también diagnósticos cada vez más diferenciados.
A menudo, se presta poca atención a los linfomas cutáneos. Y, sin embargo, han ocurrido muchas cosas en los últimos años. Así lo pusieron de manifiesto varios expertos de Zúrich, Leiden y Birmingham en el Congreso de la EADO de este año. Así, también están surgiendo opciones de tratamiento innovadoras para estas enfermedades raras a través de nuevas opciones terapéuticas como los conjugados anticuerpo-fármaco, la inmunoterapia y los virus oncolíticos. Una caracterización genética e inmunobiológica cada vez más precisa permite también diagnósticos cada vez más diferenciados, tanto para los linfomas cutáneos primarios de células B como para los de células T.
Linfomas cutáneos primarios de células B: De virus oncolíticos y puntos de control inmunitarios
Aunque los linfomas cutáneos se consideran más comúnmente neoplasias de células T, aproximadamente uno de cada cinco linfomas cutáneos primarios es un linfoma de células B. Se distinguen tres subtipos: linfoma cutáneo primario de la zona marginal, linfoma cutáneo primario folicular y linfoma cutáneo primario de células B grandes. Según el Dr. med. Egle Ramelyte, del Hospital Universitario de Zúrich, en un futuro próximo podrían abrirse nuevas posibilidades terapéuticas para todas las entidades, por ejemplo mediante el uso selectivo de virus oncolíticos. Ya está aprobado para el tratamiento del melanoma maligno desde 2015 y recientemente se ha probado también en neoplasias cutáneas de células B [1]. Mediante la inyección intralesional del virus del herpes simple 1 modificado genéticamente talimogene laherparepvec (T-VEC). Se obtuvieron resultados prometedores.
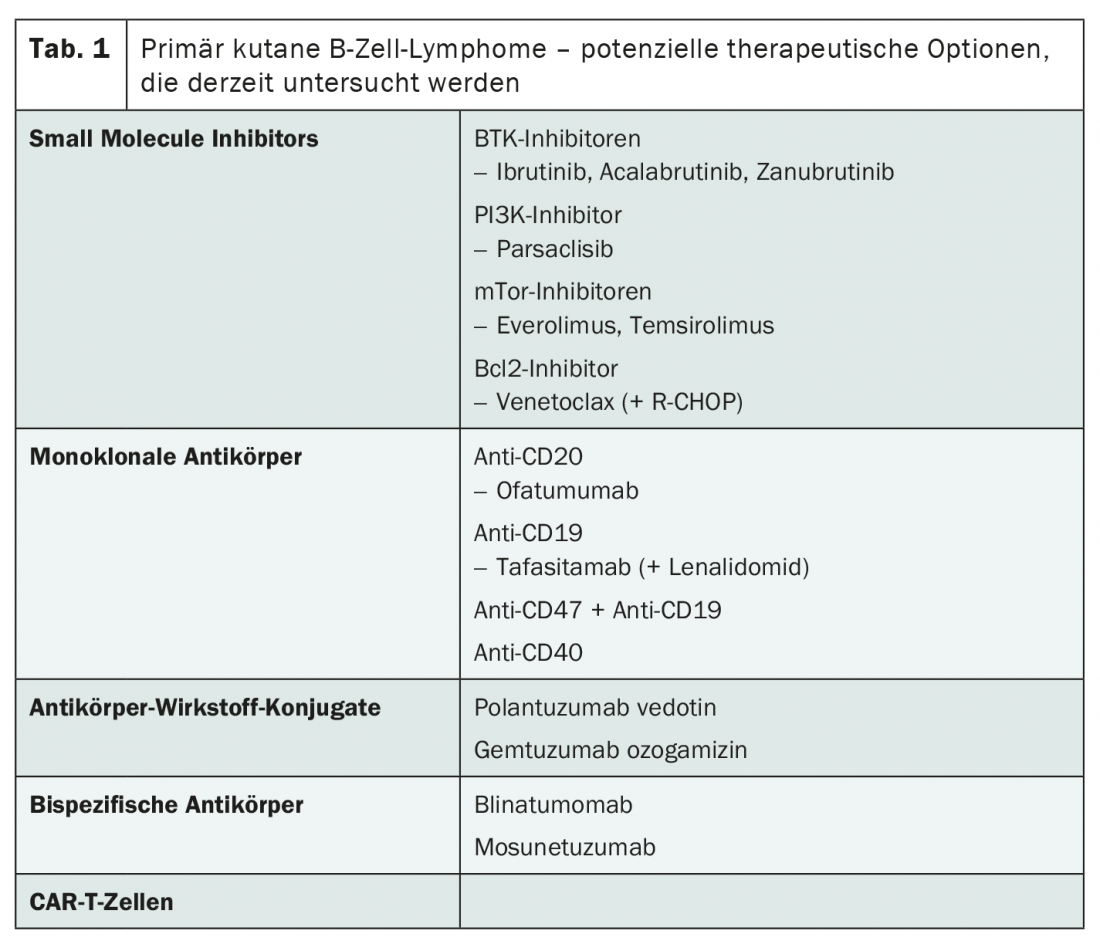
El panorama actual de la investigación también tiene mucho que ofrecer en términos de terapia para estadios avanzados. Aunque la mayoría de los compuestos se están investigando en el linfoma difuso de células B grandes (LDCBG) ganglionar, los resultados del estudio también deberían ser relevantes para los linfomas cutáneos primarios de células B, afirma Ramelyte. Así pues, pronto podría haber alternativas a la radioterapia, el rituximab y la quimioterapia con R-CHOP. Además de los inhibidores de moléculas pequeñas y los anticuerpos monoclonales, cabe destacar los conjugados anticuerpo-fármaco, los anticuerpos biespecíficos y las células CAR-T (Tab. 1 ). Estos últimos ya están aprobados en Suiza para el tratamiento del LDCBG en recaída o refractario, con gran éxito.
A diferencia de otras opciones inmunoterapéuticas como los anticuerpos biespecíficos, que se unen a la célula tumoral por un lado y a las células T del propio organismo por otro y conducen así a la lucha contra la neoplasia, el experto ve menos posibilidades de éxito a los inhibidores de los puntos de control en la terapia de las neoplasias cutáneas de células B. Aunque han cambiado el panorama del tratamiento de los tumores sólidos, han tenido poco éxito con las neoplasias hematológicas, aparte del linfoma de Hodgkin. La tasa de respuesta en el DLBCL a la terapia combinada anti-PD1/anti-CTLA4 es inferior al 30%, señaló Ramelyte. No obstante, actualmente se están probando varios tratamientos combinados con inhibidores de los puntos de control. Además, se está investigando el LAG3, un nuevo punto de control inmunitario potencial que se expresa en más del 70% de los casos de LDCBG. Según un estudio reciente, es probable que LAG3 se asocie a un peor pronóstico, independientemente del Índice Pronóstico Internacional [2]. Por tanto, este nuevo punto de control podría adquirir relevancia tanto diagnóstica como terapéutica.
También pueden tener importancia diagnóstica los hallazgos en los campos de la genética tumoral y la inmunohistoquímica. En la actualidad, se está probando el valor de los dos marcadores inmunohistoquímicos IRTA1 y MNDA, que se han utilizado principalmente para el diagnóstico de los linfomas MALT extracutáneos [3]. También se ha demostrado en los últimos años que la mayoría de los DLBCL cutáneos -casi el 80%- son portadores de una mutación en el gen MYD88. Esto conduce a una activación del factor de transcripción NF-κB. En los tumores en los que el gen MYD88 no está mutado, puede detectarse en la mayoría de los casos otra mutación que activa el NF-κB [4].
Linfomas cutáneos de células T: de la citometría de flujo a la varianza genética
Según los resultados de las investigaciones actuales, el panorama genético de los linfomas cutáneos de células T es mucho más heterogéneo que el de los DLBCL cutáneos. Esto podría analizarse con más detalle mediante el uso de la secuenciación de próxima generación. En general, existían grandes diferencias genéticas tanto entre los individuos afectados como dentro del mismo tumor. En concreto, según el Prof. Maarten Vermeer, MD, Jefe del Departamento de Dermatología del Hospital Universitario de Leiden (Países Bajos), la integridad genómica se ve afectada por las mutaciones del P53, diversas vías de señalización como las vías de señalización NF-κB y JAK/STAT, y el panorama epigenético se ve afectado por las aberraciones genómicas. A pesar de la diversidad del cuadro, los cambios característicos en la metilación del ADN y la modificación de las histonas podrían tener valor diagnóstico y servir potencialmente como marcadores en el futuro – con nombres como CMTM2, PROM1 o GNMT [5,6]. Esto se debe a que en la actualidad se carece de herramientas de diagnóstico fiables para la identificación clara de los linfomas cutáneos de células T. Y ese no es el único inconveniente de la gran varianza genética: Vermeer advierte de la posible resistencia a las terapias dirigidas mediante la selección de subpoblaciones de células tumorales.
Aunque hoy en día sigue existiendo cierta incertidumbre en el diagnóstico, especialmente en el campo del diagnóstico sanguíneo, se han logrado importantes avances desde la era de la identificación morfológica de las células tumorales circulantes. La clasificación correcta de estas células malignas circulantes es importante, ya que es crucial para la estadificación y, por tanto, para el pronóstico y la terapia. Con la introducción generalizada de la citometría de flujo para la estadificación, ésta se ha normalizado y mejorado en los últimos años, aunque la estandarización del procedimiento y la identificación de marcadores adecuados siguen siendo un reto [7].
Pronóstico y terapia en transición
También existen aún incertidumbres sobre los factores pronósticos de los linfomas cutáneos de células T. Sin embargo, en los últimos años han surgido nuevos marcadores pronósticos como la carga total de mutaciones y la frecuencia de clones tumorales (TCF) en la lesión. Un TCF superior al 25% fue un factor predictivo de progresión más potente que todos los demás factores pronósticos establecidos en el estudio correspondiente [8]. Un requisito previo para la determinación del TCF es la identificación del clon de células T, que ahora puede llevarse a cabo mediante la secuenciación de alto rendimiento con una sensibilidad significativamente mayor que con la PCR tradicional (reacción en cadena de la polimerasa) . Sin embargo, este método es caro y hasta ahora sólo se utiliza en unos pocos centros. Para crear por fin claridad en el campo del pronóstico, en 2015 se puso en marcha el estudio PROCLIPI (Estudio prospectivo del índice pronóstico internacional del linfoma cutáneo), en el que se recopilan continuamente datos y materiales definidos para un biobanco creado especialmente. Está prevista una duración del estudio de 10 años, y ya se han reclutado 1991 pacientes de 19 países.
Además de investigar los factores pronósticos, el estudio PROCLIPI también pretende evaluar las terapias actuales. Desde 2017, se han aprobado en la Unión Europea tres nuevas sustancias para el tratamiento de los linfomas cutáneos de células T: Brentuximab vedotin, mogamulizumab y gel de clormetina. El primero también está disponible en Suiza. Mientras que el gel de clormetina puede utilizarse para la terapia tópica en todos los estadios de la micosis fungoide, el conjugado anticuerpo-fármaco brentuximab vedotin y el anticuerpo monoclonal mogamulizumab se utilizan para el tratamiento de los linfomas cutáneos de células T recidivantes.
Incluso con estos avances, el trasplante alogénico de células madre, realizado desde 1980, sigue siendo la única opción curativa. Las mejoras en los métodos de depleción de células T, los regímenes menos intensivos y los nuevos conocimientos sobre el tratamiento de la enfermedad de injerto contra huésped (EICH) también la han hecho más tolerable. Una revisión publicada en 2019 informó de una mortalidad a 1 año del 15% con una tasa de recurrencia del 50% [9]. En este contexto, la Prof. Dra. med. Julia Scarisbrick del Hospital Universitario de Birmingham, Inglaterra, subrayó que el uso precoz del trasplante alogénico de células madre debería evaluarse cada vez más. Por último, una respuesta completa a cualquier terapia es rara en estadios avanzados y los trasplantes a pacientes con enfermedad residual no han demostrado ser eficaces. Por ello, abogó por una evaluación del trasplante de células madre en la primera remisión.
Fuente: Simposio SY13 “Linfomas cutáneos: ¿qué hay de nuevo?” por el Prof. Dr med. Maarten Vermeer (Leids Universitair Medisch Centrum), la Dra med. Egle Ramelyte (Hospital Universitario de Zúrich) y la Prof. Dra med. Julia Scarisbrick (Hospital Universitario de Birmingham), 15 de abril de 2021, 10º Congreso Mundial de Melanoma/17. Congreso de la EADO, el congreso tuvo lugar de forma virtual.
Literatura:
- Ramelyte E, et al.: Respuesta antitumoral mediada por viroterapia oncolítica: una perspectiva unicelular. Célula cancerígena. 2021; 39(3): 394-406. e4.
- Keane C, et al: LAG3: un nuevo punto de control inmunitario expresado por múltiples subconjuntos de linfocitos en el linfoma difuso de células B grandes. Blood Adv. 2020; 4(7): 1367-77.
- Wang Z, Cook JR: Expresión de IRTA1 y MNDA en el linfoma de la zona marginal: utilidad en el diagnóstico diferencial e implicaciones para la clasificación. Am J Clin Pathol. 2019; 151(3): 337-343.
- Zhou XA, et al: Los análisis genómicos identifican alteraciones recurrentes en los genes de evasión inmunitaria en el linfoma difuso de células B grandes, tipo pierna. J Invest Dermatol. 2018; 138(11): 2365-2376.
- Qu K, et al.: Paisaje de accesibilidad a la cromatina del linfoma cutáneo de células T y respuesta dinámica a los inhibidores HDAC. Célula cancerígena. 2017; 32(1): 27-41. e4.
- van Doorn R, et al.: El análisis epigenómico del síndrome de Sézary define patrones de metilación aberrante del ADN e identifica marcadores de diagnóstico . J Invest Dermatol. 2016; 136(9): 1876-1884.
- Scarisbrick JJ, et al: Avances en la comprensión de la afectación sanguínea y el estadio en la micosis fungoide/síndrome de Sezary. Eur J Cancer. 2018; 101: 278-280.
- de Masson A, et al: La secuenciación de alto rendimiento del gen del receptor β de células T identifica la micosis fungoide agresiva en fase inicial. Sci Transl Med. 2018; 10(440).
- Johnson WT, et al: Trasplante alogénico de células madre hematopoyéticas en la micosis fungoide y el síndrome de Sézary en estadio avanzado: una revisión concisa. Chin Clin Oncol. 2019; 8(1): 12.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(3): 28-29 (publicado el 15.6.21, antes de impresión).