Los IBP son medicamentos muy eficaces y en gran medida seguros. Una prescripción debe estar bien justificada, especialmente para una terapia a largo plazo. Para la terapia a largo plazo, debe utilizarse la dosis eficaz más baja. Si se producen síntomas de rebote, el segundo intento para dejarlo debe hacerse disminuyendo lentamente la dosis durante varias semanas.
La introducción en el mercado de los inhibidores de la bomba de protones (IBP) hace casi 30 años revolucionó el tratamiento de las úlceras gastroduodenales y la enfermedad por reflujo gastroesofágico. Entretanto, estos preparados forman parte de los medicamentos prescritos con más frecuencia. Son muy eficaces y en la mayoría de los casos bien tolerados. Sin embargo, su uso excesivo y su indicación incorrecta (tanto en atención primaria como en hospitales) conllevan elevados costes sanitarios y también hay cada vez más indicios de posibles efectos secundarios a largo plazo [1]. En la actualidad, algunos preparados están disponibles sin receta y se comercializan hábilmente, por lo que cabe esperar un nuevo aumento del uso de estos IBP incluso sin una indicación correcta.
Mecanismo de acción y administración óptima
La secreción de ácido en el estómago está estimulada por moduladores endocrinos, paracrinos y neuronales, como la acetilcolina (nervio vago), la gastrina y la histamina (Fig. 1) . La gastrina, que se libera tras la distensión gástrica, no sólo estimula directamente la secreción ácida, sino que también contribuye significativamente a la liberación de histamina de las células ECL. A su vez, la histamina provoca un aumento de la secreción ácida al unirse al receptor H2. Esto explica la buena eficacia de los bloqueantes específicos de los receptores H2 en principio, pero ésta es limitada en el tiempo debido a las interacciones y la redundancia de las diferentes vías de activación. Al inhibir directamente las bombas de protones apical/luminal de las células parietales (H+-K+-ATPasa), se puede inhibir la secreción ácida de forma eficaz y duradera si el medicamento se administra correctamente [2].
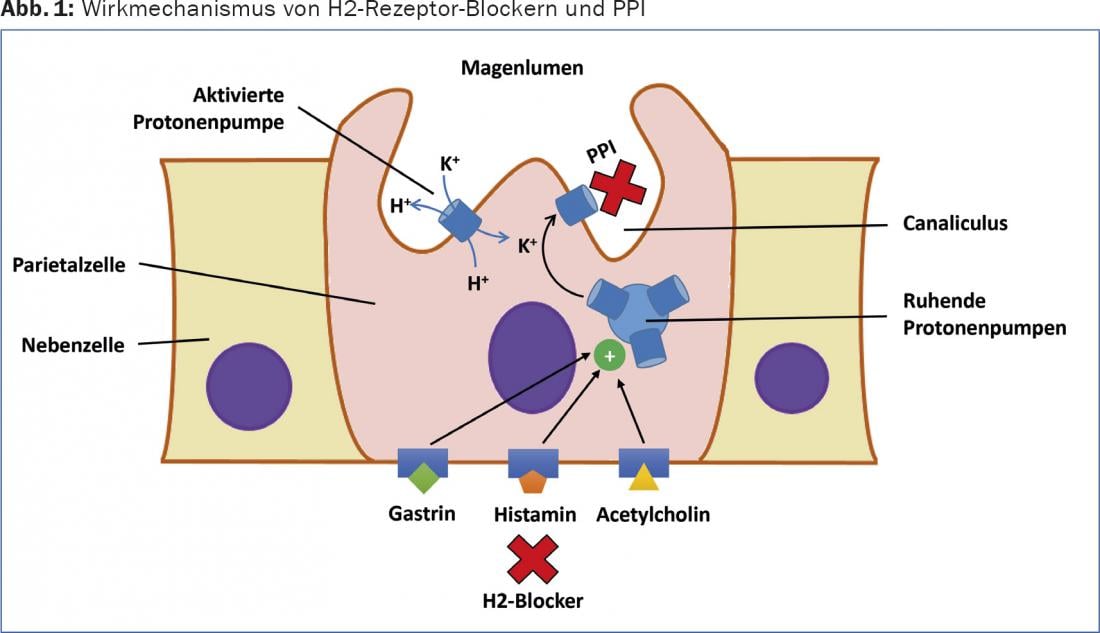
Los IBP son pro-fármacos que se acumulan en el sistema de canales secretores ácidos de las células parietales estimuladas y teóricamente alcanzan allí una concentración 1000 veces mayor a pH 1 que en la sangre. En el sistema de canales de la célula vascular, las sustancias se convierten en los metabolitos activos y despliegan allí su efecto mediante la unión covalente a la bomba de protones. Los IBP sólo se unen a las bombas de protones activadas y, en consecuencia, actúan con mayor eficacia sobre las células parietales en la fase de secreción posprandial. La ingesta de alimentos aumenta la secreción de ácido y, por tanto, la proporción de bombas de protones activas. Debido a su vida media muy corta, a su nivel plasmático máximo relativamente precoz (1-2 horas después de la ingestión) y a su reducida absorción posprandial, los IBP deben tomarse, por tanto, aproximadamente media hora antes de comer para desarrollar un efecto óptimo.
Los bloqueantes de los receptores H2 no deben administrarse concomitantemente con IBP, ya que limitan potencialmente su eficacia. Los estudios en animales indican que cuando se administran simultáneamente antagonistas de los receptores H2 y un IBP, el efecto inhibidor de la acidez del IBP puede verse muy reducido. El antagonista del receptor H2 llega a la célula vestibular antes que el IBP y reduce la concentración de ácido en el sistema de canales secretores. Sin embargo, los IBP ven reducido teóricamente su efecto inhibidor de la acidez en un 90% incluso cuando el pH se eleva de 1 a 2. Si ambos fármacos deben administrarse juntos, el intervalo de tiempo óptimo entre las dos dosis no está claro. Normalmente, los bloqueantes de los receptores H2 se administran justo antes de acostarse para los síntomas nocturnos.
En Suiza se dispone actualmente de seis principios activos de IBP diferentes (Tab. 1). Éstos difieren, entre otras cosas, en términos de biodisponibilidad y niveles plasmáticos máximos. En algunos estudios se comparó la eficacia de los distintos agentes, pero no se encontraron diferencias clínicamente relevantes.

Interacciones y seguridad
Los IBP son metabolizados por diferentes enzimas hepáticas del citocromo P450. Las interacciones resultantes no suelen ser clínicamente relevantes, pero deben examinarse en cualquier caso. El pantoprazol parece tener el menor potencial de interacción en comparación con los demás preparados. Existen preocupaciones específicas sobre la posible interacción de los IBP con el clopidogrel, pero los datos siguen siendo controvertidos [3]. Además, la supresión de ácidos puede perjudicar la absorción de ciertos medicamentos.
Los IBP se consideran muy seguros para un uso a corto plazo. Los efectos secundarios gastrointestinales más frecuentes son diarrea, estreñimiento, flatulencia o náuseas. No es necesario ajustar la dosis (a la dosis estándar) en caso de insuficiencia renal o hepática. Sin embargo, ahora existe preocupación por las consecuencias de una administración a largo plazo. Se cree que una supresión ácida prolongada favorece la colonización de los tractos gastrointestinal y respiratorio superior. Los metaanálisis de estudios observacionales indican en parte un mayor riesgo de infección por Clostridium difficile o neumonía [4]. Sin embargo, hasta ahora no se puede deducir una causalidad fiable de estos datos.
Además, existen pruebas de cierta malabsorción en el contexto de la terapia a largo plazo con IBP. Se ha descrito una menor absorción de magnesio, hierro y vitamina B12, pero no se conoce con certeza su relevancia clínica [5]. Si la terapia con IBP se ha utilizado durante muchos años, puede considerarse la posibilidad de realizar determinaciones periódicas (por ejemplo, anuales) de los niveles. Sin embargo, la situación de los datos al respecto no está clara. También hay cada vez más estudios que muestran una correlación de mayor riesgo de fractura con el uso prolongado de IBP [6]. Se sospecha una malabsorción subyacente de calcio.
IBP para el tratamiento de las úlceras pépticas
Los IBP curan las úlceras gastroduodenales mucho más rápido que los antagonistas de los receptores H2 [7]. Por regla general, se recomienda una terapia de cuatro a ocho semanas. La cicatrización de las úlceras gástricas debe asegurarse siempre por vía endoscópica para no pasar por alto un carcinoma gástrico. Si se trata una infección subyacente por Helicobacter, también debe comprobarse el éxito de la erradicación. La terapia de mantenimiento tras úlceras gastroduodenales con un IBP no suele estar indicada. En caso de úlceras gastroduodenales complicadas (con hemorragia o perforación) para las que no pueda encontrarse una causa remediable o prevenible (uso de AINE, Helicobacter pylori), debe llevarse a cabo una terapia a largo plazo para la profilaxis secundaria. También se recomienda la terapia continua después de una hemorragia ulcerosa bajo una sustancia anticoagulante que no puede interrumpirse.
Además, existen ciertas circunstancias que hacen útil la profilaxis primaria. En la tabla 2 se enumeran importantes factores de riesgo de hemorragia por úlcera gastroduodenal. Si se inicia la terapia con un AINE y está presente al menos un factor de riesgo, se recomienda la terapia concurrente con un IBP. Si se utilizan inhibidores de la COX-2 como alternativa, se puede prescindir de un IBP en esta situación. Debe administrarse profilaxis con IBP cuando se utilice un AINE junto con un medicamento anticoagulante o cuando se utilicen simultáneamente dos o más medicamentos anticoagulantes. En pacientes críticos sometidos a tratamiento de cuidados intensivos, a menudo se administra un IBP como profilaxis contra las llamadas úlceras de estrés. Para esta indicación temporal, lo mejor es interrumpir el IBP durante el transcurso de la estancia hospitalaria para evitar una terapia innecesaria a largo plazo. Un factor de riesgo de hemorragia gastrointestinal que a menudo se pasa por alto es el uso de inhibidores selectivos de la recaptación de serotonina (ISRS). Un metaanálisis publicado recientemente muestra un riesgo moderadamente mayor con la terapia de ISRS sola; el riesgo aumenta de forma relevante en combinación con AINE [8]. Se recomienda la profilaxis con IBP con esta combinación de medicamentos. Además, siempre debe cuestionarse críticamente la indicación de los ISRS, sobre todo después de que se haya producido una hemorragia.

IBP para la erradicación de Helicobacter pylori
Los IBP son parte integrante de cualquier terapia de erradicación. Suele durar entre 7 y 14 días. Si existe una gastritis asociada a Helicobacter no complicada sin úlcera acompañante, no es necesario tomar el IBP durante más tiempo que la medicación antibiótica. El control de la erradicación no debe realizarse hasta cuatro semanas después de finalizar la terapia antibiótica. Además, para comprobar de forma fiable el éxito de la erradicación (evitar resultados falsos negativos), el IBP debe suspenderse dos semanas antes.
IBP para la enfermedad por reflujo gastroesofágico
Si se sospecha una enfermedad por reflujo gastroesofágico en ausencia de síntomas típicos de reflujo, puede administrarse inicialmente un tratamiento empírico con IBP en dosis estándar durante cuatro semanas sin necesidad de más diagnósticos. A partir de entonces, tras una terapia aguda exitosa, puede administrarse a demanda un tratamiento con un IBP a la mitad de la dosis estándar. Los pacientes sometidos a endoscopia son tratados con un IBP a dosis estándar durante cuatro semanas en caso de esofagitis por reflujo leve y ocho semanas en caso de esofagitis por reflujo grave. En la esofagitis por reflujo leve, se realiza un intento de salida después de la terapia aguda. Si se requiere una terapia a largo plazo, debe determinarse la dosis mínima eficaz. En la esofagitis por reflujo grave, los pacientes suelen requerir un tratamiento a largo plazo con dosis bajas debido a las frecuentes recidivas y al riesgo de complicaciones (hemorragias, estenosis) [9].
IBP para la dispepsia funcional
En ausencia de síntomas de alarma, puede realizarse un ensayo de IBP limitado en el tiempo (2-4 semanas). Si no hay respuesta, deben llevarse a cabo más investigaciones.
Interrupción correcta del IBP
Dos estudios controlados con placebo en voluntarios sanos demostraron que tras cuatro y ocho semanas de terapia con un IBP, las molestias dispépticas en el sentido de un rebote ácido se producen con frecuencia cuando se interrumpe bruscamente el IBP [10,11]. Los datos al respecto no son concluyentes para el uso de IBP en pacientes con reflujo. El riesgo de rebote parece aumentar con la duración de la terapia.
En principio, los IBP pueden suspenderse sin disminuir la dosis, independientemente de la duración de la toma. En caso de un intento infructuoso de interrupción (reaparición de los síntomas en las dos primeras semanas), debe reiniciarse la terapia y eliminarse lentamente. No se recomienda una estrategia clara para ello, pero parece sensata una retirada progresiva a lo largo de varias semanas (reducción a la dosis más baja y, a continuación, prolongación constante del intervalo de dosis). No puede recomendarse el uso alternativo de bloqueantes de los receptores H2, ya que éstos también provocan hipersecreción ácida tras su interrupción [12]. En el mejor de los casos, las sustancias neutralizantes pueden tener un efecto de apoyo.
Literatura:
- Pasina L, et al: Indicaciones basadas en la evidencia y no autorizadas de los inhibidores de la bomba de protones y preferencias de los pacientes para su interrupción: un estudio piloto en una muestra de farmacias comunitarias italianas. J Clin Pharm Ther 2016 abr; 41(2): 220-223.
- Wolfe MM, et al: Supresión ácida: optimización de la terapia para la cicatrización de úlceras gastroduodenales, la enfermedad por reflujo gastroesofágico y el síndrome erosivo relacionado con el estrés. Gastroenterología 2000; 118(2 Suppl 1): S9-31.
- Vaduganathan M, et al: Eficacia y seguridad de los inhibidores de la bomba de protones en subconjuntos cardiovasculares de alto riesgo del ensayo COGENT. Am J Med 2016 Abr 30, pii: S0002-9343(16)30438-7.
- Kwok CS, et al: Riesgo de infección por Clostridium difficile con fármacos supresores de la acidez y antibióticos: metaanálisis. Am J Gastroenterol 2012; 107: 1011.
- McColl KE: Efecto de los inhibidores de la bomba de protones sobre las vitaminas y el hierro. Am J Gastroenterol 2009; 104 Suppl 2: S5.
- Yu EW, et al: Inhibidores de la bomba de protones y riesgo de fracturas: un metaanálisis de 11 estudios internacionales. Am J Med 2011; 124(6): 519-526.
- Fischbach W, et al: [S2k-guideline Helicobacter pylori and gastroduodenal ulcer disease]. Z Gastroenterol 2016; 54(04): 327-363.
- Anglin R, et al: Riesgo de hemorragia gastrointestinal alta con inhibidores selectivos de la recaptación de serotonina con o sin uso concurrente de antiinflamatorios no esteroideos: una revisión sistemática y metaanálisis. Am J Gastroenterol 2014; 109: 811-819.
- DGVS Guideline Gastrooesophageal Reflux Disease, www.awmf.org/leitlinien/detail/ll/021-013.html, consultado el 07/2016.
- El-Omar E, et al: Hipersecreción ácida de rebote marcada tras el tratamiento con ranitidina. Am J Gastroenterol 1996; 91: 355-359.
- Niklasson A, et al: Desarrollo de síntomas dispépticos tras la interrupción de un inhibidor de la bomba de protones: un ensayo doble ciego controlado con placebo. Am J Gastroenterol 2010; 105: 1531-1537.
- Reimer C, et al.: La terapia con inhibidores de la bomba de protones induce síntomas relacionados con la acidez en voluntarios sanos tras la retirada del tratamiento. Gastroenterología 2009; 137: 80-87.
PRÁCTICA GP 2016; 11(9): 8-13