“¡No somos nuestros genes!” Con esta afirmación, la profesora Katharina Domschke, de Friburgo, se refirió a la importancia de las influencias medioambientales y a cómo éstas moldean nuestra salud mental a través de procesos epigenéticos. Este mecanismo es especialmente importante en los trastornos de ansiedad y podría abrir nuevas opciones terapéuticas.
Uno de los platos fuertes del simposio de aniversario de este año de la Sociedad Suiza para la Ansiedad y la Depresión (SGAD) fue la conferencia de la Prof. Dra. med. Katharina Domschke, Directora Médica del Departamento de Psiquiatría y Psicoterapia del Hospital Universitario de Friburgo (D). Llamó la atención sobre la dimensión epigenética de los trastornos de ansiedad. Porque: los trastornos de ansiedad en particular están determinados en gran medida por nuestros genes.
Frecuentes, gravosas y costosas
Los trastornos de ansiedad son los más frecuentes en la especialidad de neuropsiquiatría y afectan al 14% de las personas en toda Europa. Son dos veces más frecuentes que la depresión unipolar o el insomnio, que son los siguientes grupos en cuanto a frecuencia. Debido a su elevada cronicidad, los trastornos de ansiedad son también enfermedades muy caras: Después de los trastornos afectivos, la demencia y los trastornos psicóticos, los trastornos de ansiedad ocupan el cuarto lugar en términos de coste: . Esta carga para los enfermos, los familiares y el sistema sanitario se ve agravada por el hecho de que los trastornos de ansiedad suelen derivar en enfermedades psicológicas y/o somáticas. La ansiedad predispone al desarrollo de un episodio depresivo posterior o de un trastorno depresivo [1].
La epigenética como intérprete entre el medio ambiente y la genética
En este contexto, comprender la etiología es de gran importancia. Los trastornos de ansiedad son poligenéticos, es decir, están formados por un gran número de genes. En el 30-60% de los pacientes ya existe una disposición genética para padecer un trastorno de ansiedad. Sin embargo, esta disposición no determina la forma de la enfermedad directamente, sino a través de una cadena de factores: el cambio en los sistemas de mensajería nerviosa y las redes neuronales, ciertos ajustes psicofisiológicos (por ejemplo,la sensibilidad al CO2 y las reacciones fisiológicas correspondientes), así como factores ambientales como las noxas, los traumatismos y los acontecimientos de la primera infancia o prenatales (Fig. 1).

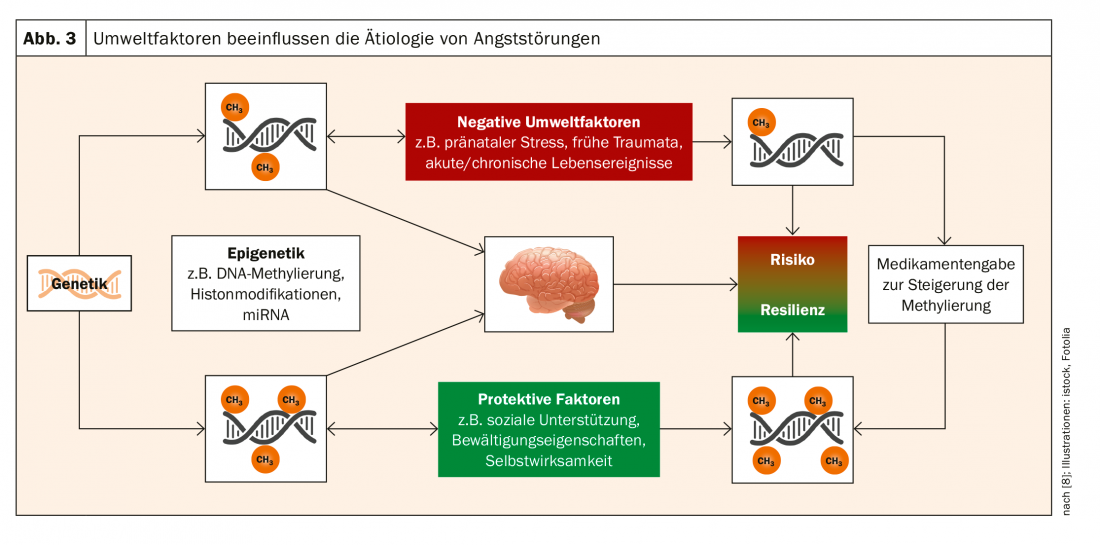
La epigenética desempeña el papel de mediador entre los factores medioambientales y la genética. Esto es muy relevante para la psiquiatría, que se basa en el modelo de vulnerabilidad al estrés. En este modelo, se asume la vulnerabilidad individual, que viene determinada tanto genéticamente como por factores ambientales desencadenantes. La epigenética asume la “función de intérprete”, por así decirlo, entre el nivel de los factores medioambientales y el de la genética. La epigenética se refiere a los procesos bioquímicos que modifican la función de ciertos genes alterando el ADN y su estructura espacial. “Esto contradice el modelo determinista”, explica el profesor Domschke. “Efectivamente estamos codeterminados por nuestros genes, pero: ¡no somos nuestros genes!”. Así pues, los genes pueden modificarse a través de la epigenética, pero ¿cómo?
Cómo la epigenética moldea nuestra salud
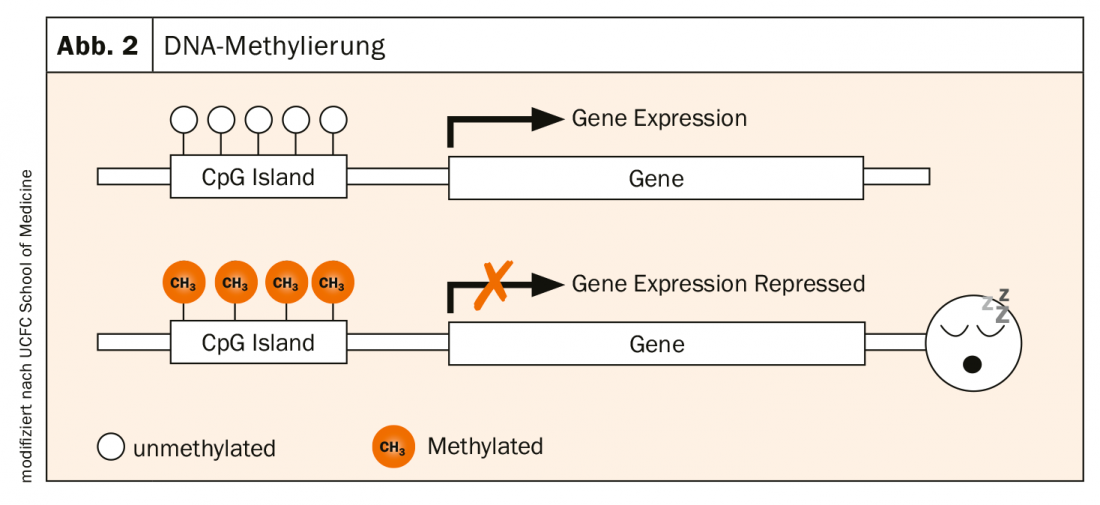
La actividad de los genes está determinada por varios procesos. Una muy central es la metilación del ADN: la unión enzimática de grupos metilo (-CH3) a las bases nucleicas (islas CpG) del ADN. Se trata de una modificación natural causada por influencias medioambientales. Las islas CpG se encuentran a menudo en la región promotora de los genes. Si esta región no está metilada, el gen está activo y puede transcribirse. Si está metilado, es decir, si un grupo CH3 se acopla allí, el gen en cuestión deja de expresarse. Se “duerme” (Fig. 2).
Un gen de riesgo tanto para los trastornos de ansiedad como para la depresión es la monoaminooxidasa A (MAOA). Descompone la serotonina, la noradrenalina y la dopamina. Esta enzima es bien conocida en la práctica diaria por el uso de inhibidores de la MAO. En un estudio, el Prof. Domschke y sus colegas pudieron demostrar que la metilación del MAOA conduce a una reducción de la función del gen, un hallazgo significativo para la terapia de enfermedades relacionadas con la actividad de este gen [2]. Esta metilación periférica afecta a los procesos neuronales: Cuanto menor sea la metilación periférica de la MAOA, mayor será la actividad de la MAOA en el cerebro. El Prof. Domschke y sus colegas encontraron una correlación entre la hipometilación del promotor de la MAOA y el trastorno de pánico [3]. Así, la metilación de la MAOA parece ser un biomarcador de la ansiedad y la depresión.
El Prof. Domschke y sus colegas investigaron si la epigenética también puede ayudar a predecir la respuesta a la terapia en un estudio realizado durante seis semanas. Compararon la respuesta a la administración de ISRS en pacientes con alta metilación de MAOA frente a pacientes con baja metilación de MAOA. Esto demostró que los pacientes con una metilación MAOA elevada responden significativamente mejor a los ISRS. Aún se necesitan más estudios para comprender mejor el mecanismo. Pero una consecuencia práctica de este hallazgo podría ser que los pacientes que de todos modos tienen una metilación baja de la MAOA deberían ser tratados con un IRSN o un inhibidor de la MAOA en lugar de un ISRS.
¿Prevenir las enfermedades mentales mediante la epigenética?
“Lo apasionante no es sólo este mecanismo patogenético-funcional, sino que existe una bidireccionalidad”, subraya el Prof. Domschke. “La genética es inmutable. Pero la epigenética, la metilación, es dinámica. Responde a las influencias del entorno”. Los acontecimientos vitales subjetivamente negativos contribuyen a reducir la metilación de la MAOA. Por lo tanto, el trauma puede conducir a un estado de riesgo epigenético. La buena noticia a la inversa: los acontecimientos positivos se correlacionaron positivamente con la metilación del MAOA. Las medidas que fomentan la resiliencia pueden contribuir a la profilaxis de las enfermedades mentales (Fig. 3).
En este contexto, también se examinó el papel de la psicoterapia. Se demostró que la psicoterapia también conduce a una normalización de la metilación y, por tanto, a una mejora de los síntomas. A medio plazo, una comprensión epigenética de los mecanismos de acción de la psicoterapia podría conducir a su aumento mediante fármacos que eleven a los pacientes con baja metilación de la MAOA al nivel de los altamente metilados, afirma el profesor Domschke.
En conjunto, según los conocimientos actuales, la epigenética representa una posibilidad para predecir la respuesta terapéutica individual en el sentido de una farmacoterapia personalizada y – posiblemente – para explicar los mecanismos de acción de la psicoterapia.
¿Qué hay de nuevo en farmacoterapia?
Las fobias específicas no se tratan con medicación, sino con terapia cognitivo-conductual. Para la fobia social, el trastorno de pánico y el trastorno de ansiedad generalizada, los ISRS y los IRSN son el tratamiento de elección. Según un estudio publicado en 2017, la agomelatina parece ser eficaz no sólo en la depresión, para la que está aprobada, sino también en el tratamiento del trastorno de ansiedad generalizada [4]. Por lo tanto, la agomelatina es un buen suplemento. La quetiapina, aprobada para la esquizofrenia y el trastorno bipolar, también mostró una eficacia significativa como monoterapia en el tratamiento del trastorno de ansiedad generalizada [5]. El extracto de aceite de lavanda, indicado para la ansiedad y los trastornos del estado de ánimo, también ha demostrado en estudios su eficacia en el tratamiento del trastorno de ansiedad generalizada [6].
Unas palabras sobre la pregabalina: Aunque esta sustancia tiene una eficacia clara y las pruebas Ia correspondientes, se sospecha que puede crear adicción. Por lo tanto, actualmente sólo existe una recomendación B para la pregabalina. Lo mismo se aplica a la gabapentina. Sin embargo, hay que señalar que el riesgo de estas sustancias es el más bajo en comparación con otras sustancias activas con potencial de dependencia. Además, la dependencia de los gabapentinoides se asocia regularmente a otras adicciones, especialmente a la adicción al opio y a la politoxicomanía. De ello se deduce que no debe prescindirse de la pregabalina ni de la gabapentina en la terapia, salvo en el tratamiento de las personas que ya son dependientes. En su lugar, debe evitarse la administración de benzodiacepinas. Los (endo)cannabinoides, de los que tanto se habla, no cuentan actualmente con pruebas suficientes, por lo que tampoco representan una opción de tratamiento.
Fuente:10º Foro Suizo de los Trastornos del Ánimo y la Ansiedad
Literatura:
- Meier SM, et al: Depresión secundaria en trastornos de ansiedad graves: un estudio de cohortes basado en la población en Dinamarca. Lancet Psychiatry 2015; 2(6): 515-523.
- Ziegler C, Domschke K: Firma epigenética de los genes MAOA y MAOB en los trastornos mentales. J Neural Transm 2018; 125(11): 1581-1588.
- Domschke K, et al.: Hipometilación del ADN del gen de la monoaminooxidasa A: ¿un factor de riesgo para el trastorno de pánico? Int J Neuropsicofarmacol 2012; 15(9): 1217-1228.
- Stein DJ, et al: Eficacia y seguridad de la agomelatina (10 ó 25 mg/día) en pacientes ambulatorios no deprimidos con trastorno de ansiedad generalizada: Un estudio doble ciego controlado con placebo de 12 semanas de duración. Eur Neuropsychopharmacol 2017; 27(5): 526-537.
- Maneeton N, et al: Monoterapia con quetiapina en el tratamiento agudo del trastorno de ansiedad generalizada: revisión sistemática y metaanálisis de ensayos controlados aleatorizados. Drug Des Devel Ther 2016; 10: 259-276.
- Kasper S, et al: El preparado de aceite de lavanda Silexan es eficaz en el trastorno de ansiedad generalizada – una comparación aleatoria a doble ciego con placebo y paroxetina. Int J Neuropsychopharmacol 2014; 17(6): 859-869.
- Domschke K: Factores predictivos en los trastornos de ansiedad. Neurólogo 2014; 85(10): 1263-1268.
- Ziegler C, Schiele M, Domschke K: Patho- und Therapieepigenetik psychische Erkrankungen. Neurólogo 2018; 89: 10.1007/s00115-018-0625-y.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(3): 24-29.










