La radioterapia de los tumores torácicos, en especial el carcinoma de pulmón, se debate entre el objetivo de lograr la mayor probabilidad de control tumoral posible y la evitación de toxicidades. Un efecto secundario relevante es la neumonitis radiogénica. Esto ocurre con una latencia temporal de semanas a meses tras la finalización del tratamiento.
La radioterapia de los tumores torácicos, en especial el carcinoma de pulmón, se debate entre el objetivo de lograr la mayor probabilidad de control tumoral posible y la evitación de toxicidades.
Un efecto secundario relevante es la neumonitis radiogénica. Esto ocurre con un tiempo de latencia de semanas a meses tras la finalización del tratamiento, con la mayoría de los casos apareciendo en las primeras 8 semanas post radiaciónem [1]. Clínicamente, suele haber una tríada sintomática de disnea de esfuerzo, tos no productiva e hipoxia, que contribuyen a la pronunciada sensación subjetiva de enfermedad del paciente. A diferencia de las infecciones bacterianas o víricas, las febrículas son más bien raras, pero también pueden ser secundarias a sobreinfecciones. En la fase aguda, la morfología del TAC muestra un edema intersticial. Esta afección inflamatoria aguda puede curarse posteriormente de forma espontánea o mediante intervención farmacológica. Sin embargo, a largo plazo, también es posible la fibrosis del tejido pulmonar afectado con el consiguiente encogimiento. Dependiendo de su extensión en relación con el pulmón aún funcional, los trastornos restrictivos de la función pulmonar pueden quedar como residuos irreversibles. Afortunadamente, los cursos mortales de la enfermedad son raros y en la literatura se informa de menos del 2% [2].
El patomecanismo subyacente de la radiopneumonitis aún no ha sido descifrado en toda su complejidad. El sistema alveolar está compuesto por neumocitos de tipo I y II. Mientras que los neumocitos de tipo I, como células diferenciadas, proporcionan alrededor del 90% de la superficie alveolar, las células de tipo II sintetizan surfactante y sirven como reserva de repoblación para las células de tipo I dañadas [3]. El agotamiento de estas células inducido por la radiación provoca la pérdida de la función de barrera en el alvéolo y la reducción de la integridad microvascular. Estos procesos conducen a la formación de edema y desencadenan, entre otras cosas, la migración de macrófagos y la liberación de citoquinas proinflamatorias [4]. Los neumocitos supervivientes también pueden diferenciarse en miofibroblastos y secretar el factor de crecimiento transformante beta (TGF-beta), que en última instancia promueve el desarrollo de la fibrosis.
Clasificación de la neumonitis
La gravedad de la neumonitis se clasifica según los Criterios Terminológicos Comunes para Efectos Adversos (CTCAE), versión 4.0: asintomática (grado 1); sintomática, necesidad de medicación, deterioro de las actividades diarias (grado 2), síntomas graves, necesidad de oxígeno, deterioro de las actividades diarias (grado 3) o disfunción respiratoria potencialmente mortal (grado 4). En los estudios clínicos, el riesgo de neumonitis de grado 2 ó 3 es especialmente relevante.
La probabilidad de neumonitis de cualquier grado en el tratamiento primario definitivo del cáncer de pulmón avanzado se cifra entre el 15 y el 40%, dependiendo de la fuente bibliográfica [1]. Sin embargo, este efecto secundario relacionado con la terapia también desempeña un papel en la irradiación de otras entidades. Un metaanálisis de Tonison et al. [5], por ejemplo, identificó 19 estudios con 874 pacientes que recibieron radioterapia para el cáncer de esófago. Se encontró una tasa de neumonitis de grado ≥2 del 6,6%. Un análisis retrospectivo de Pinnix et al. [6] registraron la toxicidad pulmonar de 150 pacientes sometidos a radioterapia de consolidación o de rescate que incluía el mediastino debido a un linfoma. La incidencia de neumonitis independiente del estadio fue del 14%, con grados ≥2 clínicamente relevantes en el 8% de los pacientes. La radioterapia adyuvante del carcinoma de mama también puede provocar una exposición relevante de los pulmones a la radiación, especialmente durante la radiación electiva de los ganglios linfáticos mamarios internos paraesternales. El ensayo EORTC 22922/10925 [7] comparó los resultados del tratamiento de radioterapia adyuvante sólo en la glándula mamaria o la pared torácica con el tratamiento adicional de las vías de drenaje linfático mamario interno y supraclavicular medial. El análisis de la toxicidad muestra un aumento de la tasa de neumonitis del 0,7% frente al 0,1% (p<0,0012) con la irradiación prolongada. Aunque estos valores parezcan numéricamente bajos, hay que tener en cuenta que la radioterapia adyuvante para el cáncer de mama es una indicación estándar absoluta en muchas instituciones de radiooncología. Sólo en Alemania, cada año se diagnostica cáncer de mama a 70.000 mujeres, una gran parte de las cuales se somete a irradiación como parte del concepto terapéutico.
Existen relaciones dosis-respuesta tanto para el control del tumor como para la neumonitis radiogénica. En teoría, los carcinomas bronquiales grandes y locorregionalmente avanzados, en particular, requieren una dosis de radiación elevada en el volumen diana, cuya aplicación, sin embargo, también se asocia a un aumento de las dosis en el tejido pulmonar sano y a un mayor riesgo de neumonitis. Tradicionalmente, los oncólogos radioterápicos utilizan los datos de la revisión QUANTEC (Quantitative Analysis of Normal Tissue Effects in the Clinic) como pauta para evaluar la seguridad de un plan de radiación [8]. Para ello, se revisó sistemáticamente la bibliografía sobre la reacción a la radiación inducida por la terapia en los tejidos normales. Para la evaluación del órgano pulmonar de riesgo, se recomienda limitar la dosis pulmonar media a 20 Gy para mantener la tasa de neumonitis clínicamente manifiesta por debajo del 20%.
Riesgo con carboplatino/paclitaxel
Sin embargo, además de estos valores orientativos dosimétricos, existen otros factores de riesgo relacionados con el paciente y la terapia que son relevantes. En un metaanálisis exhaustivo realizado por Palma et al. [2], se incluyeron datos de un total de 836 pacientes de 12 estudios y se analizaron con respecto a los factores predictivos de la aparición de penumonitis de grado ≥2. Todos los pacientes recibieron radioquimioterapia simultánea al diagnóstico de CPNM (cáncer de pulmón no microcítico) y la dosis mediana aplicada fue de 60 Gy. El volumen pulmonar que recibió ≥20 Gy (denominado V20) pudo identificarse como un parámetro dosimétrico relevante. Esto mostró una OR de 1,03 por cada 1 por ciento de aumento en V20 (p=0,008). Se pudo demostrar un aumento significativo del riesgo en el caso de la quimioterapia simultánea combinada con las sustancias carboplatino y paclitaxel (OR 3,33 en comparación con la quimioterapia con cisplatino/etopósido, p<0,001). En cuanto a la edad de los pacientes, sólo se observó una tendencia al aumento del riesgo (OR 1,24 por década de vida, p=0,09). Sin embargo, el análisis multivariante mostró que el mayor riesgo de desarrollar neumonitis (>50%) correspondía a la combinación de edad >65 años y administración simultánea de carboplatino/paclitaxel.
En una moderna comparación aleatoria de dos niveles de dosis para la radioterapia del cáncer de pulmón no microcítico (CPNM), se produjeron neumonitis ≥ grado 3 en el 7% (brazo terapéutico de 60 Gy) y del 4% (brazo terapéutico de 74 Gy) [9]. La supervivencia significativamente menor en el brazo de dosis altas no se explica, por tanto, por una tasa de neumonitis documentada más elevada, pero sugiere, no obstante, una influencia de las consecuencias no registradas de la terapia en combinación con las comorbilidades.
Las técnicas de radiación modernas, especialmente los métodos de radioterapia de intensidad modulada (IMRT), permiten una reducción relevante de la dosis pulmonar con una dosis constante en el volumen diana en comparación con la planificación conformada 3D convencional. En un estudio prospectivo de fase 1 realizado por Boyle et al. [10] Se trató a 24 pacientes con IMRT definitiva en el momento del diagnóstico de CPNM avanzado y se calculó un plan de radiación correspondiente con técnica conformada 3D para su comparación. Esto demostró una ventaja dosimétrica de la IMRT tanto en términos de dosis pulmonar media (11,9 frente a 14,9 Gy, p
Otra posibilidad para reducir la dosis en el tejido sano normal es la planificación del volumen diana basada en la PET/TC con 18F-fluorodeoxiglucosa–(18F-FDG). Este procedimiento se ha convertido en un estándar para la estadificación del CPNM y detecta con gran sensibilidad la actividad biológica de un primario, pero también posibles ganglios linfáticos mediastínicos afectados. En la planificación convencional de la radiación, dependiendo de la localización del tumor, las estaciones de los ganglios linfáticos mediastínicos drenantes suelen irradiarse también de forma electiva, lo que a veces da lugar a grandes volúmenes diana. Del mismo modo, a veces es difícil diferenciar entre el tumor primario y la atelectasia consecutiva en las imágenes de TC convencionales (por ejemplo, en caso de obstrucción de las vías respiratorias), por lo que, en caso de duda, el contorneado suele ser algo más generoso.
Un estudio de planificación italiano [11] comparó la exposición a la dosis en los órganos de riesgo de 18 pacientes que iban a recibir radioterapia primaria para el CPNM localmente avanzado. Se crearon varios planes de tratamiento individuales para cada paciente, en los que una versión incluía sólo las estructuras positivas para la PET y otra versión irradiaba también los niveles de ganglios linfáticos electivos. En el 33% de los pacientes se logró una reducción de la estadificación sobre la base de las imágenes PET, en particular porque ya no se podía detectar la afectación del Ln mediastínico. Al centrar la radioterapia en los focos positivos para la PET, la dosis pulmonar media pudo reducirse de 20,5 a 15,5 Gy. Lo mismo ocurre con el V20, que cayó del 34 al 26%.
En un estudio prospectivo aleatorizado, Nestle et al. [12]si la radioterapia sola de las estructuras positivas al PET también conduce a los mismos resultados oncológicos. Un total de 205 pacientes con CPNM localmente avanzado fueron asignados aleatoriamente a la planificación basada en PET o convencional de la radioquimioterapia primaria. Con una mediana de tiempo de seguimiento de 29 meses, no se pudo demostrar ninguna desventaja de la radioterapia basada en PET en términos de supervivencia libre de progresión. El riesgo de progresión local al cabo de un año fue sólo del 14% frente al 29% en el brazo estándar (HR 0,57; IC 0,3-1,06). Por lo tanto, es seguro adaptar el volumen diana para un paciente de forma individual sobre la base de la PET-TC y, por lo tanto, reducirlo significativamente si es necesario.
En última instancia, se plantea la cuestión de si la mejora de los parámetros dosismétricos se traduce realmente en una reducción de la tasa de expresión clínica de la neumonitis. En el estudio de comparación de dosis ya mencionado de Bradley et al. [9], se permitió la IMRT así como la técnica conformada 3D más antigua en ambos brazos. La IMRT se utilizó en pacientes con mayores volúmenes tumorales diana (mediana de 486 frente a 427 ml), pero se asoció a una menor tasa de neumonitis ≥ grado 3 (3,5% frente a 7,9%) y tendió a tener una supervivencia global a los 2 años aún mejor (53,2% frente a 49,4%) [13].
Reducción de las costuras de seguridad gracias a la compuerta
Otra innovación técnica en el campo de la radioterapia es la aplicación de procedimientos de gating. Al registrar y/o corregir la movilidad respiratoria del tumor, permiten reducir los márgenes de seguridad del volumen diana de planificación (PTV), que tiene en cuenta no sólo la extensión clínica de un primario sino también las imprecisiones posicionales diarias. Este enfoque se utiliza, por ejemplo, en la Esto es posible realizando la irradiación en inspiración profunda, lo que a menudo se denomina en la literatura DIBH (Deep Inspiration Breath Hold). Para ello, la curva respiratoria del paciente se registra digitalmente mediante un espirómetro o con escáneres de superficie y se hace visible en una pantalla. A continuación, se indica a los pacientes que respiren profundamente mediante una señal visual o acústica. Si se supera un valor umbral previamente definido, el aire se detiene en esta posición durante unos 15 segundos. Sólo durante este tiempo el aparato de tratamiento, el llamado acelerador lineal, recibe el visto bueno para la irradiación, por lo que los propios pacientes pueden interrumpir la terapia en cualquier momento. Tras una breve “pausa respiratoria”, el procedimiento continúa hasta el final de la sesión diaria de tratamiento. Tras una breve fase de familiarización, muchos pacientes están tan familiarizados con el manejo del procedimiento que inspiran de forma independiente en el momento adecuado por encima del umbral. Así aprenden, por así decirlo, a controlar ellos mismos la radiación con su propia respiración. Un estudio comparativo de Josipovic et al. [14] investigaron las diferencias dosimétricas entre el tratamiento de “respiración libre” y el DIBH en 10 pacientes con CPNM avanzado y radioterapia primaria. Dependiendo de la técnica de irradiación utilizada, tanto la dosis pulmonar media como la V20 podrían reducirse significativamente en aproximadamente un 20% cada una mediante la DIBH. En otro análisis, el mismo grupo de trabajo investigó la cuestión de si los pacientes con CPNM avanzado son aptos para el tratamiento con parada respiratoria a pesar de su enfermedad subyacente y posiblemente otras enfermedades pulmonares secundarias (por ejemplo, EPOC) [15]. En un análisis provisional de un estudio prospectivo, usted llegó a la conclusión de que aproximadamente el 70% de los pacientes examinados son capaces de realizar una DIBH de más de 20 segundos y además se benefician dosimétricamente de esta técnica.
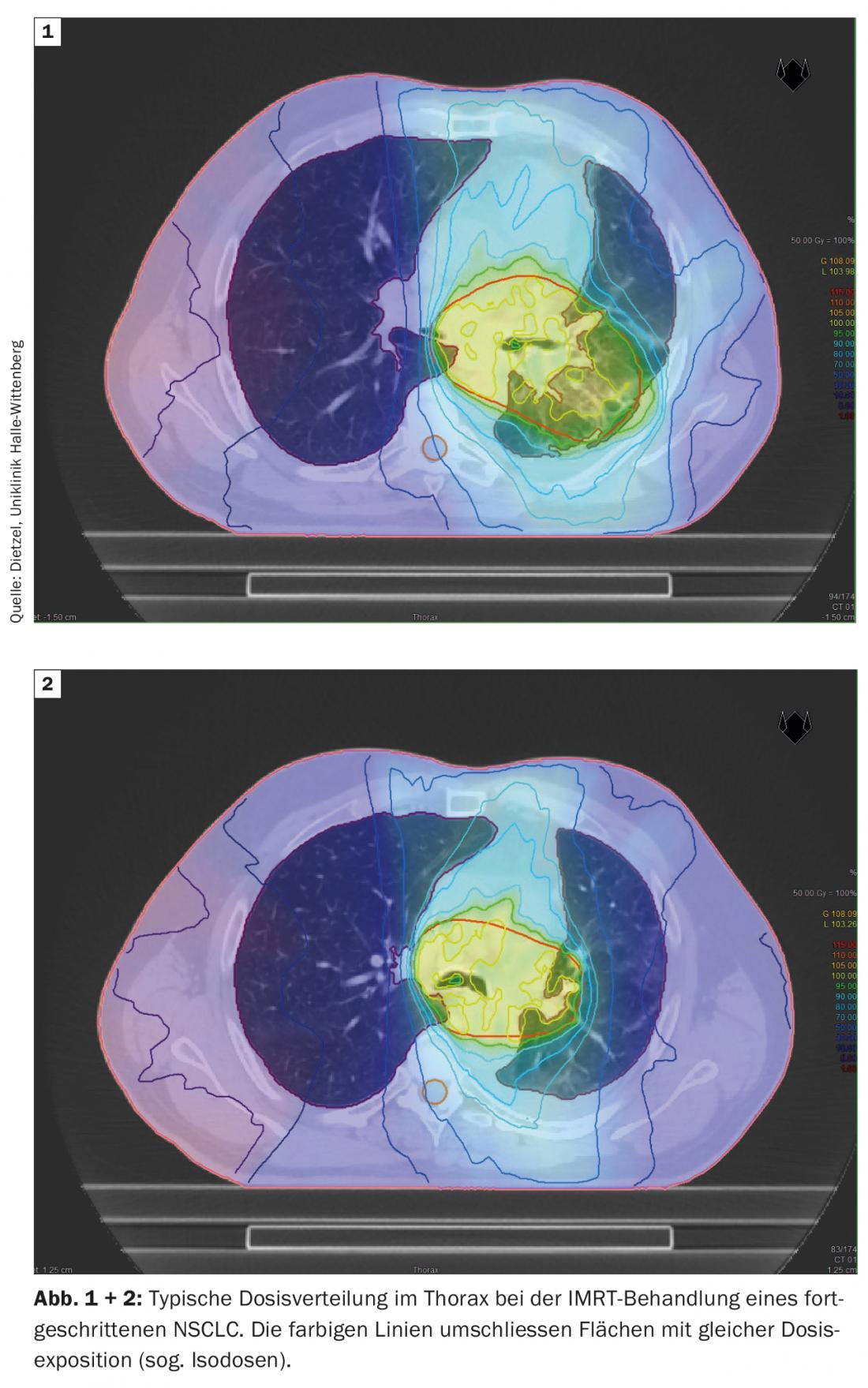
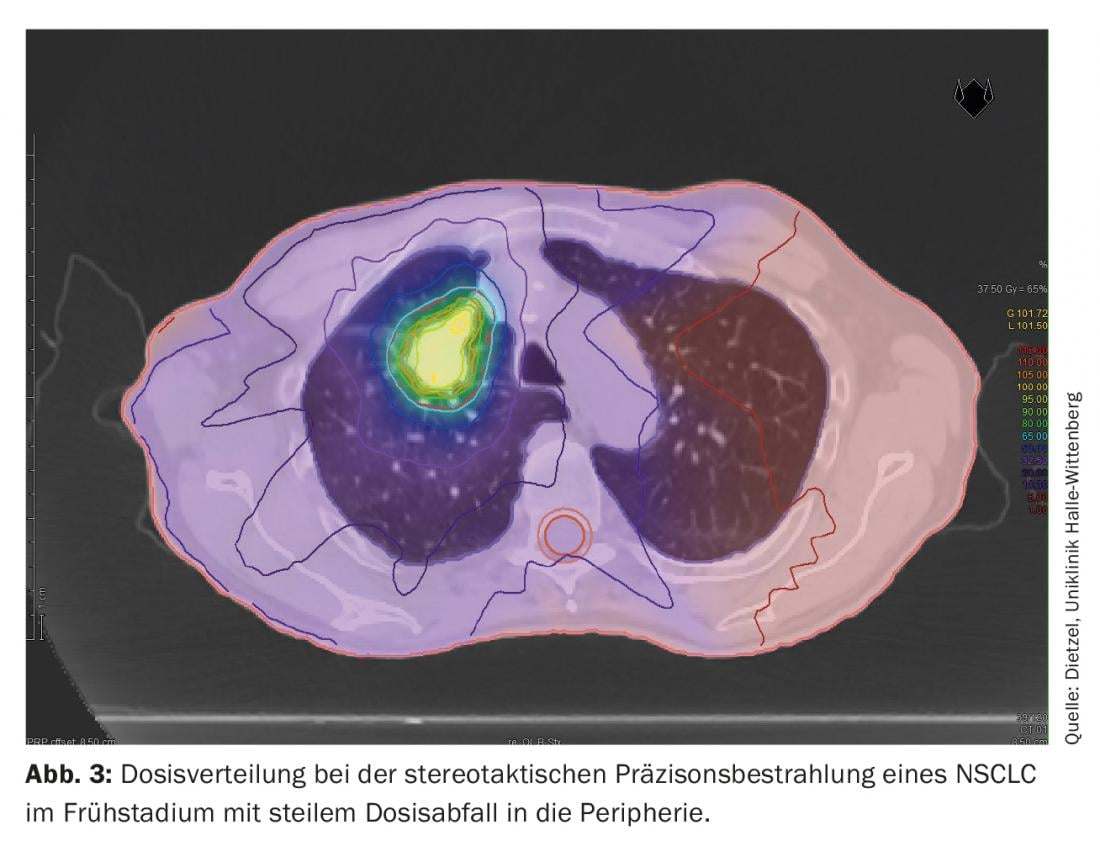
La técnica DIBH también desempeña un papel decisivo en la radioterapia adyuvante del cáncer de mama, especialmente en el caso de los tumores del lado izquierdo, para evitar dosis de radiación innecesarias en los órganos circundantes de riesgo. En este caso, el efecto de la insipración profunda se utiliza principalmente para preservar las estructuras cardiacas al levantar la pared torácica del pericardio y bajar el corazón caudalmente. Sin embargo, como efecto secundario positivo, el aumento y el desplazamiento del volumen también protegen los pulmones. Basándose en un estudio de planificación de la Universidad Técnica de Múnich, que tuvo en cuenta a 31 pacientes con cáncer de mama, se demostró que la DIBH puede reducir la dosis media para el pulmón izquierdo en un 19 ± 9% y la V20 en un 24 ± 10% [16]. Mientras que en el CPNM estadio III, los grandes volúmenes pulmonares están expuestos a dosis más altas e intermedias (Fig. 1 y 2), En la radioterapia estereotáctica del CPNM en fase inicial, sólo pequeñas secciones del pulmón se exponen a dosis de radiación relevantes. (Fig. 3), por lo que el método se utiliza principalmente para pacientes internamente inoperables -a menudo con EPOC de alto grado y a veces O2-obligación- se utiliza. Incluso en este grupo de pacientes seleccionados negativamente, sólo se observaron tasas de neumonitis de grado 2 y 3 del 7% y el 2%, respectivamente, con los regímenes de dosis estándar [17].
La inmunoterapia abre nuevas perspectivas
La introducción de la inmunoterapia en el tratamiento del CPNM ha abierto nuevas perspectivas clínicas en los últimos años, que han contribuido a una mejora significativa del pronóstico. Por ejemplo, en el caso de la combinación secuencial de radioquimioterapia seguida de durvalumab como terapia primaria, tal y como se investigó en el ensayo PACIFIC, fue posible mostrar una reducción significativa del número de pacientes tratados con durvalumab. se demostró una mejora de la supervivencia a 2 años del 55,6% al 66,3% (p=0,005) [18]. Sin embargo, especialmente en lo que respecta a la toxicidad adicional de la inmunoterapia, en la actualidad sólo se está recopilando experiencia bien fundamentada a largo plazo. En la evaluación del ensayo PACIFIC, sólo se notificó una baja tasa de neumonitis ≥ grado 3 del 3,4%, frente al 2,6% en el brazo de control (radioquimioterapia seguida de placebo) [18]. En el tratamiento combinado del CPNM con radioterapia e inmuno-oncología, la neumonitis debe considerarse una toxicidad solapada. Los datos iniciales de un estudio de fase II sobre la administración simultánea de nivolumab con radioquimioterapia mostraron una tasa de neumonitis de grado 3 del 10,3%, considerada aceptable por los autores, pero probablemente aumentada en comparación con la radioquimioterapia sola [19].
Opciones terapéuticas
Según las recomendaciones para la terapia de la neumonitis radiogénica de la actual directriz S3 “Supportive Therapy in Oncological Patients” [20], el tratamiento debe ser con esteroides. Los regímenes de dosificación típicos incluyen una dosis diaria de prednisona de 60-100 mg/tgl. inicial, que se reduce lentamente durante un periodo de 8-12 semanas [1]. Se trata de una terapia sintomática de la fase inflamatoria aguda de la enfermedad, que presumiblemente no influye en el desarrollo posterior de la fibrosis [21]. Tras una decisión caso por caso (por ejemplo, en caso de alivio insuficiente), la administración de esteroides puede complementarse o sustituirse por azatioprina o ciclosporina. La administración profiláctica de antibióticos sólo se recomienda en pacientes con factores de riesgo (por ejemplo, inmunodepresión, procesos estenosantes, etc.). Si la fiebre es pronunciada, puede administrarse una terapia antibiótica calculada. Si esto no surte efecto, debe buscarse la confirmación microbiológica, por ejemplo mediante un lavado bronquial, para iniciar una terapia basada en el resistograma o para excluir una neumonía fúngica. En la profilaxis farmacológica, se está debatiendo la administración de amifostina, que actúa como captador de radicales. Según la directriz, la aplicación puede llevarse a cabo como uso fuera de indicación en pacientes con radioquimioterapia planificada. Actualmente no existe ninguna opción de tratamiento eficaz para la fibrosis preexistente.
En resumen, la neumonitis radiogénica es un efecto secundario relevante de la radioterapia, que puede conducir a una fibrosis pulmonar crónica y, por tanto, a una carga a largo plazo para el paciente. Sin embargo, el conocimiento de las relaciones dosis-efecto pertinentes y de los factores de riesgo relacionados con el paciente, junto con la constante innovación técnica en el campo de la oncología radioterápica, ha llevado a que se pueda hablar de un riesgo calculable.
Mensajes para llevarse a casa
- La neumonitis radiogénica es un efecto secundario relevante tras la irradiación de tumores torácicos y suele aparecer sólo después de varias semanas o meses.
- Además de una fase inflamatoria aguda, en el curso de la enfermedad puede desarrollarse una fibrosis con síntomas crónicos acompañantes.
- Además de la carga pulmonar radiogénica (dosis pulmonar media y V20), los factores relacionados con el paciente (edad, comorbilidades) y la aplicación de terapias sistémicas simultáneas también influyen en la probabilidad de expresión.
- Las técnicas modernas de radioterapia, como la radioterapia de intensidad modulada (IMRT), la sincronización de la respiración y la planificación basada en PET, permiten una reducción significativa de la dosis no deseada en la zona pulmonar.
Literatura:
- Jain V, et al: Neumonitis por radiación: viejo problema, nuevos trucos. Cancers 2018; 10 (7).
- Palma DA, et al: Predicción de la neumonitis por radiación tras la quimiorradioterapia para el cáncer de pulmón: un metaanálisis internacional de datos de pacientes individuales. Int J Radiat Oncol Biol Phys 2013; 85 (2): 444-450.
- Giuranno L, et al: Lesión pulmonar inducida por radiación (RILI). Front Oncol 2019; 9: 877.
- Citrin DE, et al: Papel de la senescencia neumocítica de tipo II en la fibrosis pulmonar inducida por radiación. J Natl Cancer Inst 2013; 105 (19): 1474-1484.
- Tonison JJ, et al: Neumonitis por radiación tras la radioterapia de intensidad modulada para el cáncer de esófago: datos institucionales y una revisión sistemática. Sci Rep 2019; 9 (1): 2255.
- Pinnix CC, et al: Predictores de neumonitis por radiación en pacientes que reciben radioterapia de intensidad modulada para el linfoma Hodgkin y no Hodgkin. Int J Radiat Oncol Biol Phys 2015; 92 (1): 175-182.
- Matzinger O et al: Toxicidad a los tres años con y sin irradiación de la cadena linfática mamaria interna y supraclavicular medial en el cáncer de mama en estadio I a III (ensayo EORTC 22922/10925). Acta Oncol 2010; 49 (1): 24-34.
- Bentzen, et al: Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC): an introduction to the scientific issues. Int J Radiat Oncol Biol Phys 2010; 76 (3 Suppl): 3-9.
- Bradley JD, et al: Radioterapia conformada de dosis estándar frente a radioterapia conformada de dosis alta con carboplatino más paclitaxel concurrente y de consolidación con o sin cetuximab para pacientes con cáncer de pulmón no microcítico en estadio IIIA o IIIB (RTOG 0617): un estudio de fase 3 aleatorizado y factorial de dos por dos. Lancet Oncol 2015; 16 (2): 187-199.
- Boyle J, et al: Ventajas dosimétricas de la radioterapia de intensidad modulada en el cáncer de pulmón localmente avanzado. Adv Radiat Oncol 2017; 2 (1): 6-11.
- Ceresoli GL, et al.: Papel de la fusión de imágenes de tomografía computarizada y tomografía por emisión de positrones con fluorodesoxiglucosa [18F] en la radioterapia conformada del cáncer de pulmón de células no pequeñas: comparación con técnicas estándar con y sin irradiación ganglionar electiva. Tumori 2007; 93 (1): 88-96.
- Nestle U, et al: Reducción del volumen diana basada en imágenes en la quimiorradioterapia para el cáncer de pulmón no microcítico localmente avanzado (PET-Plan): un ensayo multicéntrico, abierto, aleatorizado y controlado. Lancet Oncol 2020; 21 (4): 581-592.
- Chun SG, et al: Impacto de la técnica de radioterapia de intensidad modulada para el cáncer de pulmón no microcítico localmente avanzado: un análisis secundario del ensayo clínico aleatorizado RTOG 0617 de NRG Oncology. J Clin Oncol 2017; 35 (1): 56-62.
- Josipovic M, et al: Radioterapia de contención de la respiración en inspiración profunda para el cáncer de pulmón localmente avanzado: comparación de diferentes técnicas de tratamiento en la cobertura del objetivo, la dosis pulmonar y el tiempo de administración del tratamiento. Acta Oncol 2013; 52 (7): 1582-1586.
- Persson GF, et al: Deep Inspiration Breath Hold Compliance in Radiation Therapy for Locally Advanced Lung Cancer. Int J Radiat Oncol Biol Phys 2017; 99 (2): Suplemento 2017: E491.
- Oechsner M, et al.: Retención de la respiración en inspiración profunda para la irradiación mamaria del lado izquierdo: Análisis de los histogramas dosis-masa y del impacto de la expansión pulmonar. Radiat Oncol 2019; 14 (1): 109.
- Guckenberger M, et al.: ¿Existe un límite inferior de función pulmonar pretratamiento para una radioterapia corporal estereotáctica segura y eficaz para el cáncer de pulmón de células no pequeñas en estadio inicial? J Thorac Oncol 2012; 7 (3): 542-551.
- Antonia SJ, et al: Supervivencia global con Durvalumab tras quimiorradioterapia en CPNM estadio III. N Engl J Med 2018; 379 (24): 2342-2350.
- Peters S, et al: Safety evaluation of nivolumab added concurrently to radiotherapy in a standard first line chemo-radiotherapy regimen in stage III non-small cell lung cancer-The ETOP NICOLAS trial. Cáncer de pulmón 2019; 133: 83-87.
- Programa de directrices oncológicas (Sociedad Alemana contra el Cáncer, Ayuda Alemana contra el Cáncer, AWMF): Terapia de apoyo en pacientes oncológicos – versión larga 1.3, 2020, número de registro AWMF: 032/054OL, www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie; fecha de acceso: 24.08.2020.
- Sekine I, et al: Análisis retrospectivo de la terapia con esteroides para la lesión pulmonar inducida por la radiación en pacientes con cáncer de pulmón. Radiother Oncol 2006; 80 (1): 93-97.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2020; 2(4): 6-10