La braquiterapia (BT) es una forma de radioterapia en la que se coloca una fuente radiactiva de forma precisa en el tumor o lecho tumoral durante un tiempo generalmente breve. Está indicado para un amplio espectro de entidades tumorales. La forma altamente precisa de irradiación se limita a la región de riesgo y permite una dosis elevada al tiempo que se preservan los tejidos circundantes.
La braquiterapia (BT) es una forma de radioterapia en la que se coloca una fuente radiactiva de forma precisa en el tumor o lecho tumoral durante un tiempo generalmente breve. Está indicado para un amplio espectro de entidades tumorales [1]. La dosis de radiación focalmente alta con baja exposición simultánea del tejido sano circundante explica los éxitos del tratamiento. La primera parte del artículo de revisión explicará los aspectos físicos y prácticos generales de la BT. La segunda parte destacará el uso basado en pruebas de la BT para las indicaciones más importantes y el proceso de tratamiento respectivo.
Terminología
El prefijo “brachy” procede del griego y significa “corto”, como la radiación de corto alcance que caracteriza a esta forma de tratamiento. En los países francófonos se utiliza el término “Curiethérapie”, llamado así por Marie y Pierre Curie, que sentaron importantes bases para la BT con el descubrimiento del radio y la propuesta, hacia 1901, de introducir una fuente de radiación en un tumor. La BT debe distinguirse de las terapias con radionucleidos en medicina nuclear (por ejemplo, la terapia con lutecio-PSMA); a diferencia de estas formas de terapia, la radiooncología utiliza fuentes cerradas (y no abiertas) y las aplica de forma controlada localmente (y no sistémicamente).
Irradiación “desde dentro vs. desde fuera” – BT vs. EBRT
Esquemáticamente, pueden distinguirse dos formas de aplicación de dosis en radiooncología: la irradiación percutánea (radioterapia de haz externo, EBRT) y la BT. Con las técnicas de EBRT (como la radioterapia de intensidad modulada, la radiación estereotáctica o la terapia de protones), el haz terapéutico se genera fuera del paciente y el dispositivo de radiación puede encenderse y apagarse. En la BT, se introduce una fuente radiactiva de unos pocos milímetros en el tumor o en el lecho tumoral, normalmente durante poco tiempo. Aquí la fuente está continuamente activa, puede extenderse y retraerse pero no encenderse ni apagarse. La intensidad de la radiación disminuye con el tiempo en función de la desintegración natural del radionucleido seleccionado (en el caso del iridio-192, la mitad de la actividad original sigue presente al cabo de unos 2,5 meses). Para poder mantener el tiempo de tratamiento constantemente bajo, la clínica de Iridio-192, por ejemplo, utiliza un método de tratamiento especial. se realiza un cambio de fuente cada 3-4 meses.
En radioterapia, las incertidumbres de posicionamiento o debidas a los movimientos intrínsecos de los órganos se compensan con un margen de seguridad adicional, que suele medir entre 3 y 5 milímetros, alrededor del volumen de tratamiento deseado (el llamado “margen PTV”). Dado que el aplicador o la fuente de radiación se mueve con el tumor (lecho) durante la BT, se omite este margen de seguridad, por lo que el volumen de irradiación es menor. La influencia del margen de seguridad en el volumen total puede ilustrarse bien con el ejemplo frecuentemente citado de una naranja [2]. Si a una naranja se le quita la cáscara de unos milímetros, su volumen se reduce a la mitad (el volumen de la esfera disminuye con la tercera potencia del radio). Con la BT, se puede prescindir del margen de seguridad (es decir, de la “piel de naranja”), limitando así el volumen de irradiación a la región de riesgo real.
Formas de BT
Según el tipo de aplicación elegida, los instrumentos utilizados o la tasa de dosis, la BT puede clasificarse de forma diferente. En cuanto a la localización del tejido tumoral que debe cubrirse con el aplicador, se distingue entre braquiterapia de contacto, BT intracavitaria y BT intersticial:
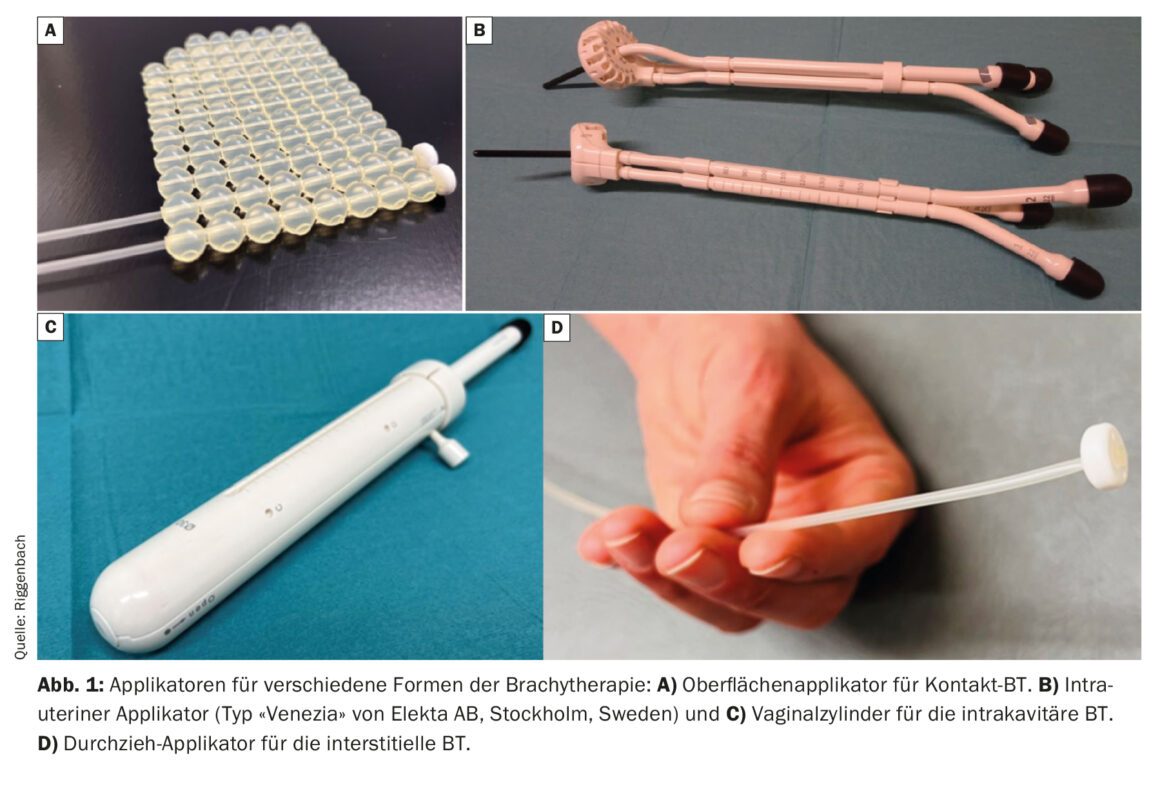
Con la braquiterapia de contacto, se pueden fijar a la piel mudas hechas a medida. Los catéteres se integran en estos moulages, separados entre sí aproximadamente 1 cm y a unos 5 mm de la piel [3]. Una forma especial de terapia de contacto es la radiación intraoperatoria; en ella, la zona quirúrgica de la que se resecó previamente el tumor puede tratarse como una superficie tumoral aún microscópica (Fig. 1) [4,5].
Con la BT intracavitaria, la fuente de radiación se acerca al volumen diana a través de las cavidades naturales del cuerpo. Las indicaciones habituales son los tumores del aparato genital femenino (inserción de un cilindro vaginal para el tratamiento de la cúpula vaginal en el carcinoma de endometrio operado o inserción de un aplicador intrauterino en la radioterapia definitiva del carcinoma de cuello uterino) [6,7]. Para la BT de cavidades alargadas (esófago [8], bronquios, nasofaringe o recto) existen aplicadores especiales de diferentes diámetros y longitudes.
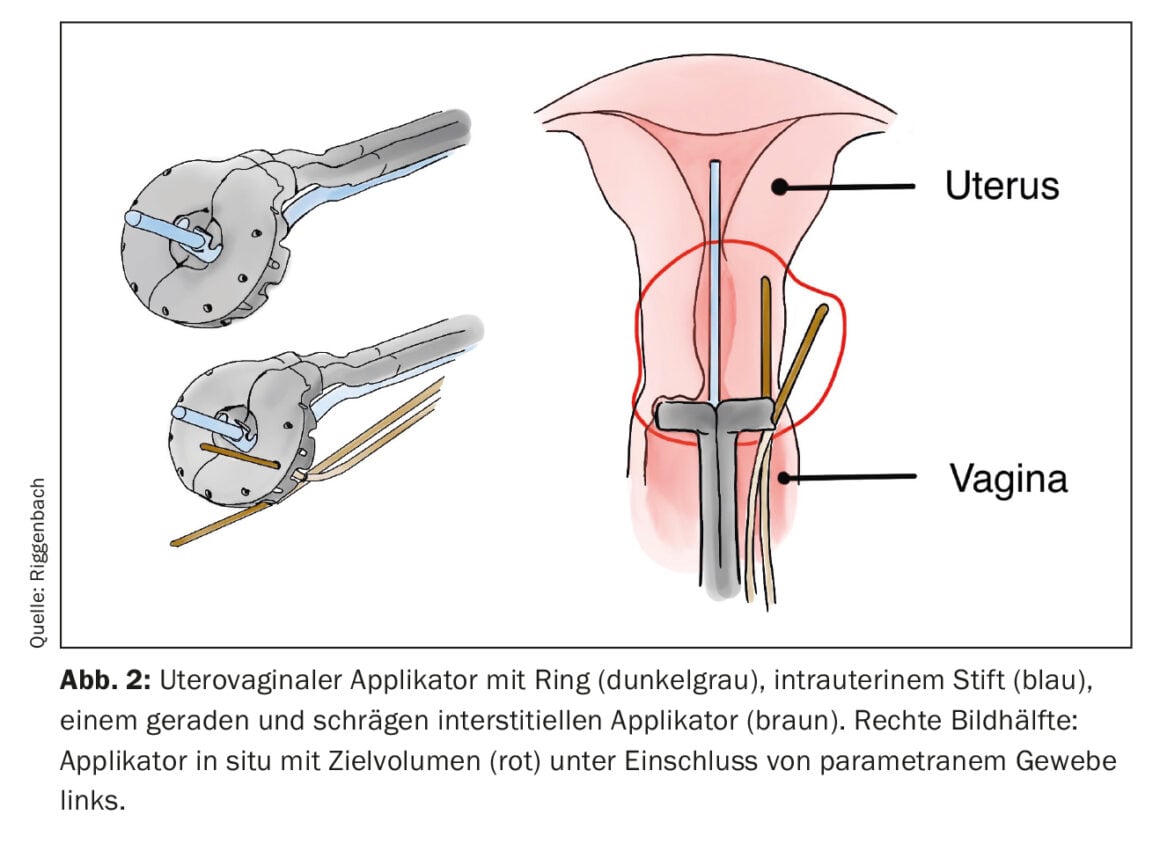
Si la región diana a tratar está más alejada de la piel o la mucosa, o el tumor supera cierto grosor, la BT intersticial es más adecuada. Para ello, se introducen tubos de plástico flexible directamente en el tumor o en el lecho tumoral a través de guías metálicas o de plástico rígido (las denominadas “cribbing”). Ejemplos habituales del uso de la BT intersticial son la irradiación parcial de la mama o el tratamiento adicional de los parametrios mediante agujas intersticiales en el carcinoma cervical. Con una disposición paralela y equidistante de los aplicadores insertados intersticialmente, es posible una distribución más homogénea de la dosis. Para la disposición regular, la punción puede apoyarse en disposiciones de orificios fabricadas industrialmente (por ejemplo, en la superficie anular de los aplicadores uterovaginales) (Fig. 2) . Como alternativa, la inserción se guía por la imagen mediante la técnica de mano alzada.
Clasificada según la tasa de dosis (número de rayos por tiempo), la irradiación continua de larga duración (LDR, BT de baja tasa de dosis) puede distinguirse de la irradiación fraccionada de corta duración (HDR, BT de alta tasa de dosis). Determina el radionucleido seleccionado. En la LDR-BT, que sigue utilizándose principalmente en el tratamiento de la próstata, se suele emplear yodo-125 como fuente radiactiva. Las semillas de yodo-125 encapsuladas se colocan intersticialmente de forma permanente.
Para el HDR-BT temporal, el emisor más utilizado es el Iridio-192. Debido a la elevada tasa de dosis, la fuente ya ha depositado la dosis deseada en el tumor(/cama) al cabo de poco tiempo y se retira de nuevo inmediatamente después. Para que la inserción y la extracción sean precisas al segundo y al milímetro, primero debe colocarse un aplicador, una aguja o un catéter, a través de cuya cavidad puede guiarse la fuente en el procedimiento de poscarga.
Una forma especial de BT HDR es la BT PDR (tasa de dosis pulsada), en la que se suele utilizar una fuente HDR para administrar un pulso de terapia cada hora a través, por ejemplo, de la PDR. una semana de tratamiento en régimen de ingreso. Aunque biológicamente favorable para el tumor, la PDR está siendo sustituida cada vez más por la HDR-BT a nivel internacional por razones logísticas y actualmente tampoco se ofrece en ningún centro de Suiza.
Principios físicos
La razón física por la que la radiación utilizada en BT se denomina de corto alcance es la ley del cuadrado de la distancia: si se duplica la distancia a la fuente, la dosis se reduce a la cuarta parte. Dado que en la BT la fuente está situada directamente junto a la zona que se va a irradiar (es decir, la distancia es pequeña), esta ley es mucho más importante que en la irradiación percutánea en el acelerador lineal (donde la distancia entre el tumor y la “fuente” o cabezal del acelerador suele ser de aproximadamente un metro). Cuando se aumenta la distancia de 1 cm a 2 cm o 3 cm, la dosis disminuye en un 75% y un 90%, respectivamente, con la BT, mientras que sólo se reduce en un pequeño porcentaje con la terapia percutánea. Por supuesto, en el caso de la irradiación percutánea, habría que tener en cuenta muchos otros factores, como la atenuación de la radiación por el tejido, para poder explicar la distribución real de la dosis. En BT, en cambio, la ley de la distancia al cuadrado supone la mayor contribución a la dosis, especialmente cerca de la fuente. Por tanto, la dosis disminuye muy rápidamente con la BT, el llamado gradiente de dosis es pronunciado, lo que, por un lado, da lugar a picos de dosis muy elevados en las inmediaciones de la fuente o el tumor y, por otro, expone sólo ligeramente los órganos de riesgo circundantes.
Procedimiento práctico de la braquiterapia HDR
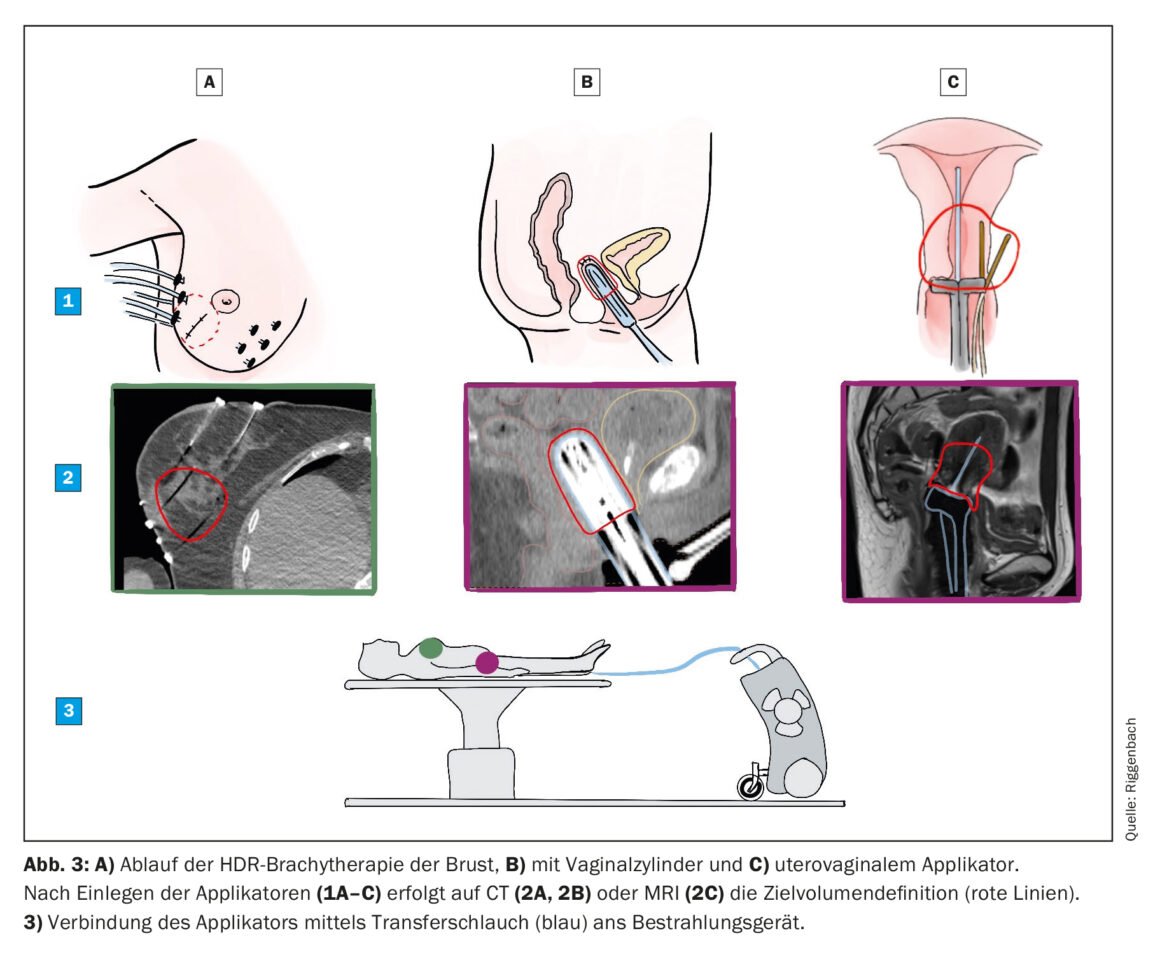
En la actualidad, la mayoría de los tratamientos de BT se realizan con el método de recarga por razones logísticas y de protección radiológica. Para ello, primero se inserta un aplicador inactivo sin radiación. Cada aplicador tiene una cavidad a través de la cual se hace pasar la fuente de radiación en un paso posterior. La fuente de Iridum-192 tiene aproximadamente el tamaño de un grano de arroz y está unida al extremo de un cable fino guardado en una caja fuerte móvil. Tras la inserción del aplicador, se realiza un TAC y/o una resonancia magnética en la que se marcan el volumen objetivo y los órganos en riesgo. El físico médico es el responsable de elaborar el plan de irradiación. La posición de la fuente (dentro de la longitud del aplicador) y el tiempo de irradiación en la posición respectiva pueden seleccionarse libremente y se optimizan mediante el software de planificación. Una vez alcanzados los objetivos, se envía el plan de irradiación a la consola de irradiación, se acompaña al paciente a la sala de tratamiento y se conecta el aplicador insertado a la caja fuerte (Fig. 3). El tratamiento se inicia y se controla a distancia desde la sala contigua. Sólo tarda unos minutos, tras los cuales la fuente de radiación se retrae automáticamente de nuevo a la caja fuerte y se retira el aplicador.
Retos y perspectivas
La complejidad de la braquiterapia no se basa en la técnica, sino en las habilidades manuales de inserción y la interacción del personal especializado dentro de la radiooncología y la interdisciplinariedad. Requiere mucha mano de obra, pero sigue siendo rentable gracias a su sencilla tecnología, que es una de las razones por las que es tan importante en los países con pocos recursos. Con más de 100 años de experiencia, es una de las opciones de tratamiento más antiguas en oncología, por lo que a veces también se considera histórica o anticuada. La braquiterapia actual, con aplicadores modernos, inserción guiada por imagen y optimización de la dosis basada en software, ha implementado el progreso médico y encaja perfectamente en los planteamientos de la “medicina individualizada”. Como todas las modalidades de radioterapias, preserva los órganos, pero debido a su enfoque mínimamente invasivo, a la moderna implementación de imágenes y a su amplio uso, requiere un equipo de expertos dedicado e interdisciplinar.
Mensajes para llevarse a casa
- La braquiterapia es una forma de tratamiento muy precisa en la que
el volumen de irradiación se limita a la región de riesgo real. - El gradiente de dosis pronunciado conduce a una dosis elevada en la región diana al tiempo que se preservan al máximo los tejidos circundantes.
- Puede aplicarse en la superficie (BT de contacto), en una cavidad corporal (BT intracavitaria) o en el tejido (BT intersticial).
- El uso más común es la HDR-BT temporal, en la que una alta dosis de
se aplica en unas pocas sesiones utilizando el método de recarga. - El amplio uso de la braquiterapia la convierte en una
Forma de tratamiento.
Literatura:
- Chargari C, Deutsch E, Blanchard P, et al: Braquiterapia: Una visión general para clínicos. CA Cancer J Clin 2019; 69(5): 386-401.
- Verellen D, Ridder M De, Linthout N, et al: Innovaciones en radioterapia guiada por imagen. Nat Rev Cancer 2007;7(12): 949-960.
- Guinot JL, Rembielak A, Perez-Calatayud J, et al: Recomendaciones GEC-ESTRO ACROP en braquiterapia cutánea. Radiother Oncol 2018; 126(3): 377-385.
- Roeder F, Krempien R: Radioterapia intraoperatoria (RIO) en el sarcoma de tejidos blandos. Radiat Oncol 2017.
- Tom MC, Joshi N, Vicini F, et al: Declaración de consenso de la Sociedad Americana de Braquiterapia sobre radioterapia intraoperatoria. Braquiterapia 2019;18(3): 242-257.
- Harkenrider MM, Block AM, Alektiar KM, et al: American Brachytherapy Task Group Report: Adjuvant vaginal brachytherapy for early-stage endometrial cancer: A comprehensive review. Braquiterapia 2017; 16(1): 95-108.
- Schmid MP, Fokdal L, Westerveld H, et al: Recomendaciones del grupo de trabajo ginecológico (GYN) GEC-ESTRO – ACROP: Concepto de objetivo para la braquiterapia adaptativa guiada por imagen en el cáncer vaginal primario. Radiother Oncol 2020;145: 36-44.
- Rovirosa Á, Tagliaferri L, Chicheł A, et al.: ¿Por qué se infrautiliza una técnica muy fácil, útil y antigua? Una visión general de la braquiterapia esofágica – radioterapia intervencionista. J Contemp Brachytherapy 2022;14(3): 299-309.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2023; 11(2): 6-9