La resistencia a los macrólidos y a los inhibidores de la girasa es lo que más influye en el éxito de la erradicación de la infección por H. pylori. Los factores de riesgo clínicos como la edad, el tabaquismo y el cumplimiento terapéutico también desempeñan un papel en el fracaso del tratamiento.
En todo el mundo, alrededor del 50% de las personas están infectadas por H. pylori [1,2]. La transmisión suele producirse en la infancia. Así, una vez adquirida la infección, ésta suele persistir hasta la vejez sin tratamiento, lo que explica por qué las personas de 70-80 años de hoy en día están infectadas en más de un 50%, mientras que las de 20-30 años lo están en bastante menos de un 50% (el llamado efecto cohorte). En los países occidentales, el contacto directo (“oro-oral”) se considera el factor de riesgo para la transmisión de persona a persona; en los países en desarrollo, también predominan otras vías (“fecal-oral”). La prevalencia de H. pylori en Europa Central se sitúa actualmente entre el 5% (niños) y el 25-40% (adultos). Es mayor entre los inmigrantes (35-85%). Como las condiciones de vida sociales e higiénicas (es decir, también el número de nuevas infecciones) han mejorado continuamente en los países occidentales, la infestación de la población total está disminuyendo. Como resultado, disminuye la mortalidad específica por edad asociada al H. pylori tanto de cáncer gástrico como de úlcera péptica.
Síntomas – manifestaciones de la enfermedad
Los síntomas clínicos como presión abdominal alta, sensación de plenitud, dolor (en ayunas), náuseas, mareos son inespecíficos (estómago irritable o dispepsia funcional, DF). Los síntomas de la infección por H. pylori no difieren de los de otras causas como el estrés, los fármacos tóxicos gastroduodenales como la aspirina (AAS) en particular, o los antiinflamatorios no esteroideos (AINE). La extensión de las molestias tampoco es indicativa de la gravedad de los hallazgos endoscópicos (gastritis sin/con erosiones, enfermedad ulcerosa). La hemorragia por úlcera debida a H. pylori no difiere clínicamente de la debida a AAS/AINE u otras causas.
Aproximadamente el 20% de las personas infectadas desarrollan enfermedad ulcerosa (úlcera duodenal, UD; úlcera gástrica, GU) a lo largo de su vida y, dependiendo de la región, entre el 1% y el 2% desarrollan también carcinoma gástrico (GC) o linfoma MALT [1,2]. El historial médico del paciente puede indicar que existen antecedentes familiares de carcinoma gástrico o enfermedad ulcerosa. El resto de personas infectadas a menudo sólo presentan síntomas leves sin lesiones visibles endoscópicamente o son completamente asintomáticas. El tipo de distribución de la gastritis es crucial para evaluar el riesgo de carcinoma gástrico (Fig. 1) . En general, cualquier úlcera gastroduodenal/carcinoma de estómago sigue siendo sospechosa de infección por H. pylori hasta que se demuestre lo contrario, sobre todo cuanto más joven es el paciente.
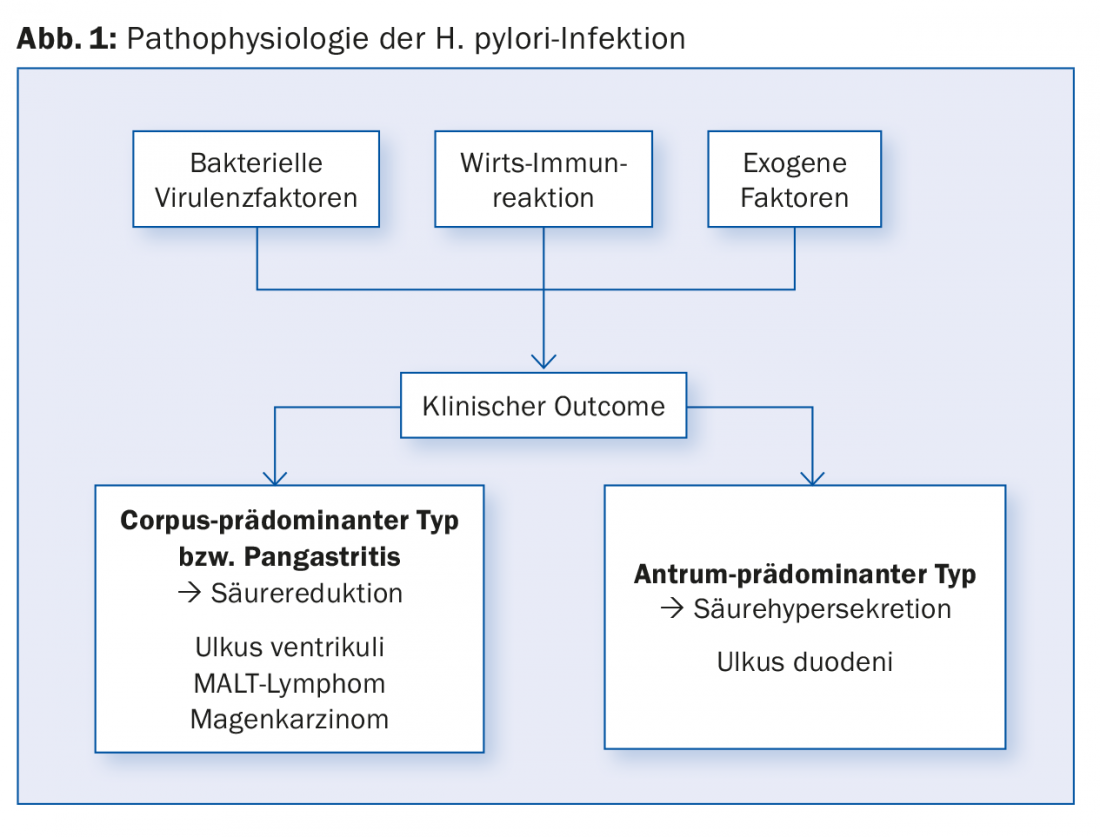
Diagnóstico
La situación clínica determina la elección de las pruebas necesarias para el esclarecimiento [1–5]. Elegible:
- Prueba del aliento basada en la ureasa (UBT)
- Prueba de antígenos en heces (SAT)
- Prueba rápida de la ureasa (HUT) e histología (HISTO), si es necesario con cultivo microbiológico y fenotípico o PCR con determinación de la resistencia genotípica como parte de la endoscopia.
- Serología (incl. inmunoblot).
Detección primaria: Excepto la serología, se pueden utilizar todas las pruebas mencionadas, la especificidad es de >95%. A excepción del cultivo microbiológico, la sensibilidad (sin factores de falsificación) es de aproximadamente el 90%, una prueba positiva es suficiente para detectar la infección. Si se requiere una esofago-gastro-duodenoscopia por razones clínicas, se utilizarán pruebas de biopsia (HUT e histología, PCR/cultivo si es necesario); si se requiere el cribado de H. pylori debido a síntomas de “escaldado”, se utilizará la prueba de heces o la prueba del aliento (equiefectiva); la preferencia del paciente suele ser por la prueba de heces.
Planificación de la terapia incl. Determinación de la resistencia: Hasta hace poco, éste era el dominio del cultivo microbiológico. Debido al engorroso procedimiento de transporte, al largo cultivo y a las pruebas de resistencia fenotípica (de dos a tres semanas) y a numerosos factores de interferencia, la tasa de cultivo sólo ronda el 70%, dependiendo del laboratorio. En este caso, la PCR con prueba genómica para la resistencia a macrólidos y fluoroquinolonas tiene una clara ventaja: la determinación también puede realizarse a partir de bacterias que ya han muerto en algunos casos y está teóricamente disponible entre 24 y 48 horas después de tomar la biopsia. La precisión de la determinación de la resistencia corresponde al cultivo. El único inconveniente: con él no es posible realizar análisis de resistencia a otros antibióticos (como el metronidazol o la rifabutina).
Control de la erradicación: Este es el ámbito de la prueba del antígeno en heces (o prueba del aliento). Si, por ejemplo, la cicatrización de una úlcera gástrica debe controlarse endoscópicamente por razones clínicas, también pueden utilizarse, por supuesto, las pruebas biópticas, pero entonces todas las pruebas deben ser negativas para poder hablar de una erradicación con éxito.
Situaciones especiales que conducen a resultados falsos de las pruebas [5]:
- En las neoplasias gástricas (Ca, linfoma MALT) con detección negativa de H. pylori con los métodos habituales, puede tener sentido realizar una serología.
- Factores de interferencia que deben tenerse en cuenta: Aunque apenas hay pruebas falsas positivas, la detección de H. pylori puede ser falsa negativa si no se observan los siguientes factores de interferencia: Tomar bloqueantes de la bomba de protones (IBP) o antibióticos (durante más de tres a cinco días) da lugar a resultados falsos negativos en la prueba en aproximadamente el 80% de los casos, por lo que es esencial dejar de tomar el IBP al menos una (preferiblemente dos) o un antibiótico al menos dos (preferiblemente cuatro) semanas antes de que se realice la prueba. Los bloqueantes H2 o los antiácidos apenas suelen interferir y pueden administrarse alternativamente como “terapia puente”.
- Número insuficiente de biopsias para HUT e histología Ò una del antro gástrico y otra del corpus para HUT y una (mejor dos) de cada una para histología
- Realizar una prueba en caso de hemorragia gastrointestinal aguda Ò Comprobar de nuevo a intervalos
- Prueba del aliento o prueba de heces en caso de estómago parcialmente resecado (también parcialmente en caso de trastorno del vaciado gástrico) -> aquí debe preferirse la prueba bióptica.
Tratamiento de la infección por H. pylori [1–5]
Patrones de enfermedad/indicaciones de tratamiento asociados a la infección por H. pylori: En la tabla 1 [5] se ofrece una visión general. La erradicación acelera la cicatrización de la úlcera en una sexta parte de los pacientes con GU y una quinta parte con DU y previene la recidiva de la úlcera (Número Necesario a Tratar, NNT de 3 para GU y NNT de 2 para DU). El beneficio sigue siendo controvertido, especialmente para la mayoría de los pacientes con terapia NUD; en este caso, el beneficio de la mejora sintomática permanente mediante la erradicación (en comparación con el placebo) es de alrededor del 5-10% (NNT 10-20), que, sin embargo, no es peor que la terapia IBP a largo plazo. La profilaxis del cáncer gástrico mediante la erradicación de H. pylori tiene tanto más éxito cuanto más precozmente se lleve a cabo y si se trata especialmente a los pacientes de alto riesgo.
Los factores causantes del fracaso del tratamiento son [5]:
- Resistencia a los antibióticos (con mucho, la más importante: diferencia de riesgo absoluto aprox. 20-50%, correspondiente a un NNT 2-5); en su mayoría debida a una terapia antibiótica previa para otras infecciones, por ejemplo, pulmonares, del tracto urinario, ginecológicas
- Duración demasiado corta de la terapia con tripleregímenes
- Estado de CYP2C19 de tipo salvaje para los IBP que se metabolizan adecuadamente, como omeprazol, lansoprazol, pantoprazol (no se aplica a esomeprazol, rabeprazol, dexlansoprazol).
- Fumar
- Edad joven (menos de 50-60 años)
- NUD (enfermedad no ulcerosa)
- Falta de cumplimiento debido a los efectos secundarios (varía mucho en función del régimen, los probióticos pueden mejorar la tolerabilidad).
Una diferencia de riesgo absoluto del 8-12% (correspondiente a un NNT/NNH de aproximadamente 10) se aplica a todos estos factores de influencia clínicos o farmacológicos.

Recomendaciones para las pruebas de resistencia [2–5]:
- Pruebas obligatorias de resistencia de H. pylori tras el fracaso del tratamiento único/múltiple
- Opcional antes de la terapia inicial si situación de alergia positiva, presencia de factores de riesgo clínicos nombrados, terapia antibiótica previa frecuente.
De lo contrario, las pruebas de resistencia no son obligatorias (consideración coste-beneficio). Para ahorrar costes, recomiendo esperar a la prueba rápida. Si ésta es positiva, se puede tomar la biopsia del HUT y enviarla al laboratorio para la prueba de resistencia PCR incluso después de 48-72h, lo que aumenta enormemente el rendimiento positivo y sólo falla en alrededor del 10% de los pacientes.
Recomendaciones para la llamada “terapia de primera línea o primaria”: Los regímenes recomendados con las dosis se enumeran en la tabla 2. Con la introducción de las terapias triples de una semana a principios de los años 90, éstas se declararon el estándar para la terapia primaria en la mayoría de los países occidentales. La base de la recomendación fue la opinión de las llamadas conferencias de consenso de Maastricht I, II, III (1997, 2002, 2007) [1] de que las terapias triples de una semana de IBP, claritromicina y amoxicilina o metronidazol tienen unas tasas de éxito del 85-90% y las tasas de resistencia a macrólidos/claritromicina antes de la terapia son inferiores al 15-20%. En la actualidad, sin embargo, las tasas de erradicación en numerosos metaanálisis son de una media de sólo el 75% para un régimen triple, lo que resulta inaceptable [5]. Las resistencias a los macrólidos suelen superar localmente el 15%, en el periodo 2014-2017 según datos locales propios de Aarau (n=200) exactamente el 20%. Clínicamente, es casi imposible registrar de forma fiable todas las terapias antibióticas previas (es decir, no sólo las iniciadas por H. pylori) de un paciente, por lo que a menudo ya subyace una situación de resistencia [4,5]. Lamentablemente, ninguna de las directrices actuales tiene esto en cuenta, por lo que muchos microbiólogos, al contrario que el resto de clínicos, exigen pruebas de resistencia incluso antes de la primera (!) terapia de erradicación, ya que la distinción entre “terapia primaria y secundaria” de la infección por H. pylori [1–3] no hace justicia a la realidad [5].

Por lo tanto, la tendencia es claramente hacia las terapias cuádruples en lugar de las triples, a pesar de que éstas, por desgracia, se mantuvieron en la directriz alemana actualizada (DGVS) de 2016 [3]. En mi opinión, debería aplicarse prioritariamente lo siguiente (Tab. 3) Una terapia combinada sin bismuto, denominada concomitante de siete a diez días con IBP, amoxicilina, claritromicina y metronidazol (IBP-ACM) terapia combinada con bismuto con IBP y tetraciclina/metronidazol/bismuto (Pylera®, PPI-BMT/Pylera®) durante 10-14 días Terapia de reserva tras el fracaso de uno de los dos regímenes mencionados o si Pylera® no está disponible: IBP más amoxicilina, levofloxacino (IBP-AL).

Terapia del fracaso de la erradicación (Tab. 3) [2–5]: En general, esto depende del régimen primario utilizado, por lo que no se puede hacer ninguna recomendación general; como muy tarde, ¡se deberían realizar pruebas de resistencia con antelación! Con una o varias erradicaciones infructuosas, las tasas de resistencia aumentan drásticamente (Fig. 2). Mientras tanto, en ausencia de información sobre la resistencia, se recomienda utilizar uno de los dos regímenes restantes mencionados. Si esto no es suficiente, puede recurrirse (en raras ocasiones) a una combinación de diez días con IBP-amoxicilina-rifabutina o a una terapia dual de altas dosis tres veces al día con IBP-amoxicilina durante quince días.

A partir de la experiencia clínica, puede concluirse que la edad joven, el tabaquismo activo y una infección por H. pylori no asociada a úlceras deberían dar motivos para prolongar más bien la duración de la terapia (5-10% de aumento de la tasa de éxito). Por el contrario, si el cumplimiento es escaso, debe procurarse elegir un régimen que sea lo más breve/fácil de tomar posible. Si el paciente tiene que tomar 20 + 120 comprimidos en diez días con el régimen PPI-Pylera®, pero sólo 56 comprimidos en siete días con la terapia cuádruple “concomitante”, la preferencia está claramente establecida. Se sabe por numerosos estudios que el régimen IBP-Pylera® tiene un rendimiento dramáticamente pobre cuando se toma durante menos de siete días y el régimen “concomitante” pierde eficacia cuando se toma durante menos de cinco días.
Mensajes para llevarse a casa
- El descenso de nuevas infecciones por H. pylori en Europa Central está directamente relacionado con el descenso de la mortalidad por cáncer gástrico y úlcera péptica.
- El fenotipo de la gastritis determina la entidad clínica en términos de asociación ácida.
- Si no existe una indicación obligatoria de erradicación de H. pylori, deberá abstenerse de realizar las pruebas si de ellas no se deriva ninguna consecuencia terapéutica. El diagnóstico de H. pylori no se recomienda expresamente durante la terapia en curso con inhibidores de la bomba de protones.
- Los factores de riesgo clínicos deben incluirse en la selección o estratificación de los regímenes terapéuticos, en la medida en que sean fácilmente determinables (edad, tabaquismo, diagnóstico endoscópico, alergias, cumplimiento terapéutico).
- La resistencia a los macrólidos y a los inhibidores de la girasa tiene el mayor impacto clínico (en todos los regímenes en cuestión) sobre el éxito de la erradicación, lo que favorece las pruebas de resistencia genotípica por PCR ya en el diagnóstico primario en los grupos de riesgo (alergias a los antibióticos, terapias antibióticas previas frecuentes, fracaso documentado de la erradicación de H. pylori).
Literatura:
- Fischbach W, et al.: Directriz S3 “helicobacter pylori y enfermedad ulcerosa gastroduodenal” de la Sociedad Alemana de Enfermedades Digestivas y Metabólicas (DGVS) en colaboración con la Sociedad Alemana de Higiene y Microbiología, la Sociedad de Gastroenterología Pediátrica y Nutrición e. V., la Sociedad Alemana de Reumatología, AWMF-registration-no. 021/001. Z Gastroenterol 2009; 47(12): 1230-1263.
- Malfertheiner P, et al: Tratamiento de la infección por Helicobacter pylori – Informe de consenso de Maastricht V/Florence. Gut 2017; 66: 6-30.
- Fischbach W, et al: Guía S2k Helicobacter pylori y enfermedad ulcerosa gastroduodenal. Z Gastroenterol 2016; 54: 327-363.
- Graham DY, Lee YC, Wu MS: Terapia racional del Helicobacter pylori: medicina basada en la evidencia en lugar de medicina basada en la evidencia. Clin Gastroenterol Hepatol 2014; 12: 177-186.
- Conductor G: Helicobacter pylori y úlcera gastroduodenal. Un comentario actualizado de la directriz alemana S3. Med World 2010; 61: 204-212.
- Wüppenhorst N, et al.: Estudio multicéntrico prospectivo sobre la resistencia antimicrobiana del Helicobacter pylori en Alemania. Revista de quimioterapia antimicrobiana 2014; 69(11): 3127-3133.
PRÁCTICA GP 2018; 13(9): 34-38











