La incidencia anual del melanoma maligno ha aumentado de forma constante en los últimos 40 años. Aunque el pronóstico es bueno en las fases iniciales, se deteriora a medida que aumenta el estadio del tumor. La terapia adyuvante con inhibidores de los puntos de control o de BRAF/MEK ha tenido un impacto duradero en el tratamiento de los casos avanzados y sigue en auge.
La incidencia anual del melanoma maligno ha aumentado de forma constante en los últimos 40 años y varía dentro de Europa de 3-5/100.000 en los países mediterráneos a 12-35/100.000 en los países nórdicos. En este contexto, el 80% de los melanomas malignos se diagnostican en un estadio localizado. Para el melanoma en estadio inicial, la resección quirúrgica es el tratamiento estándar y se asocia a un buen pronóstico a largo plazo. La tasa de supervivencia global (SG) a cinco años es del 65-100% para la enfermedad en estadios I-II y disminuye para los pacientes con metástasis locales (estadio III) a 41-71% y en pacientes con metástasis a distancia (estadio IV) al 9-28% [1].
Clasificación del melanoma y alteraciones genéticas moleculares
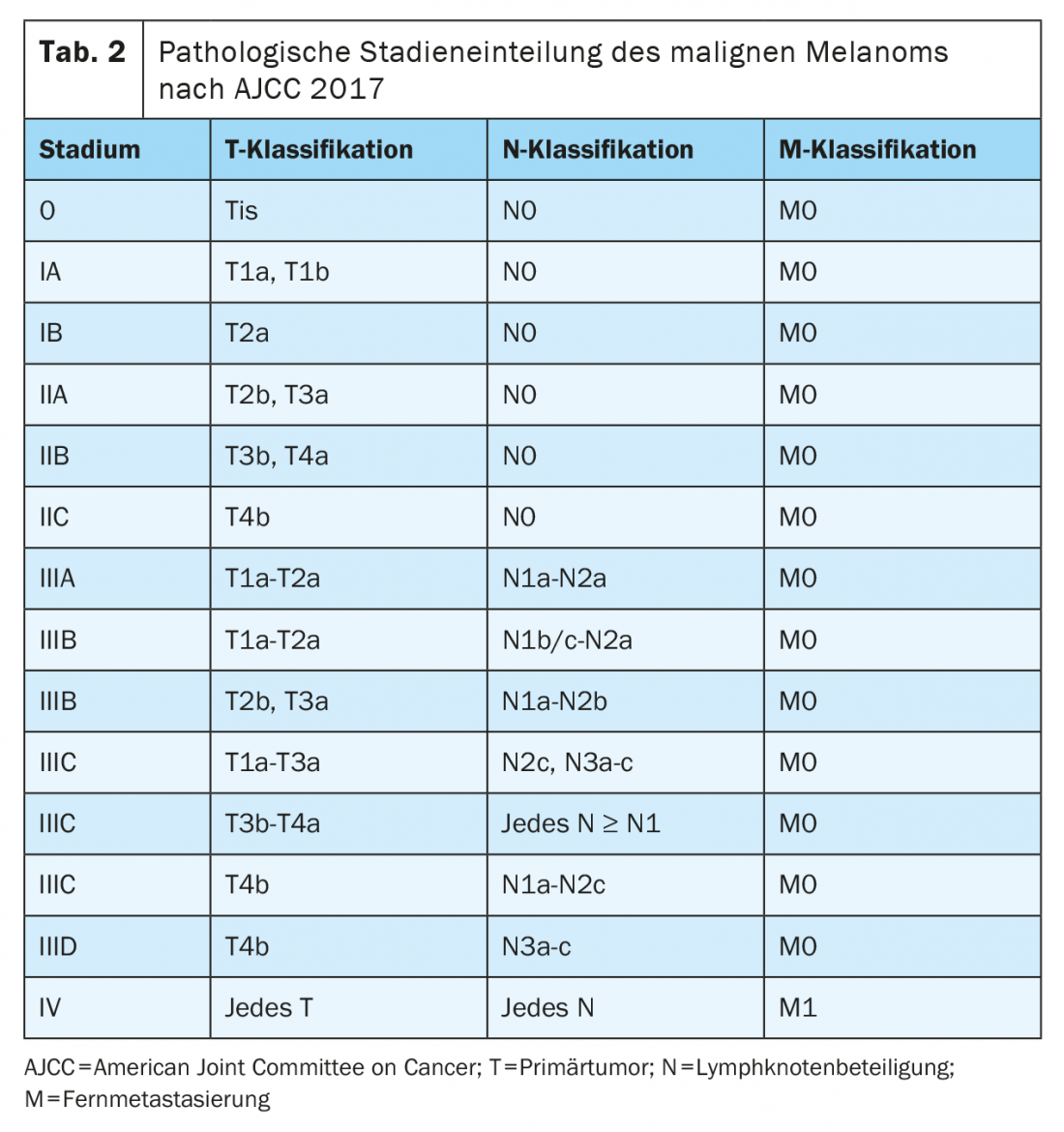
Desde enero de 2018, el melanoma se clasifica según la 8ª edición del Manual de Estadificación de la AJCC (Tablas 1 y 2) . El grosor tumoral vertical según Breslow es el factor pronóstico más importante y se tiene en cuenta a la hora de determinar el tratamiento posterior, incluidos los márgenes de seguridad requeridos y la necesidad de una biopsia del ganglio linfático centinela. La presencia de ulceración es otro marcador histopatológico relevante, que se asocia a un peor pronóstico y se registra en el estadio T de la clasificación TNM.
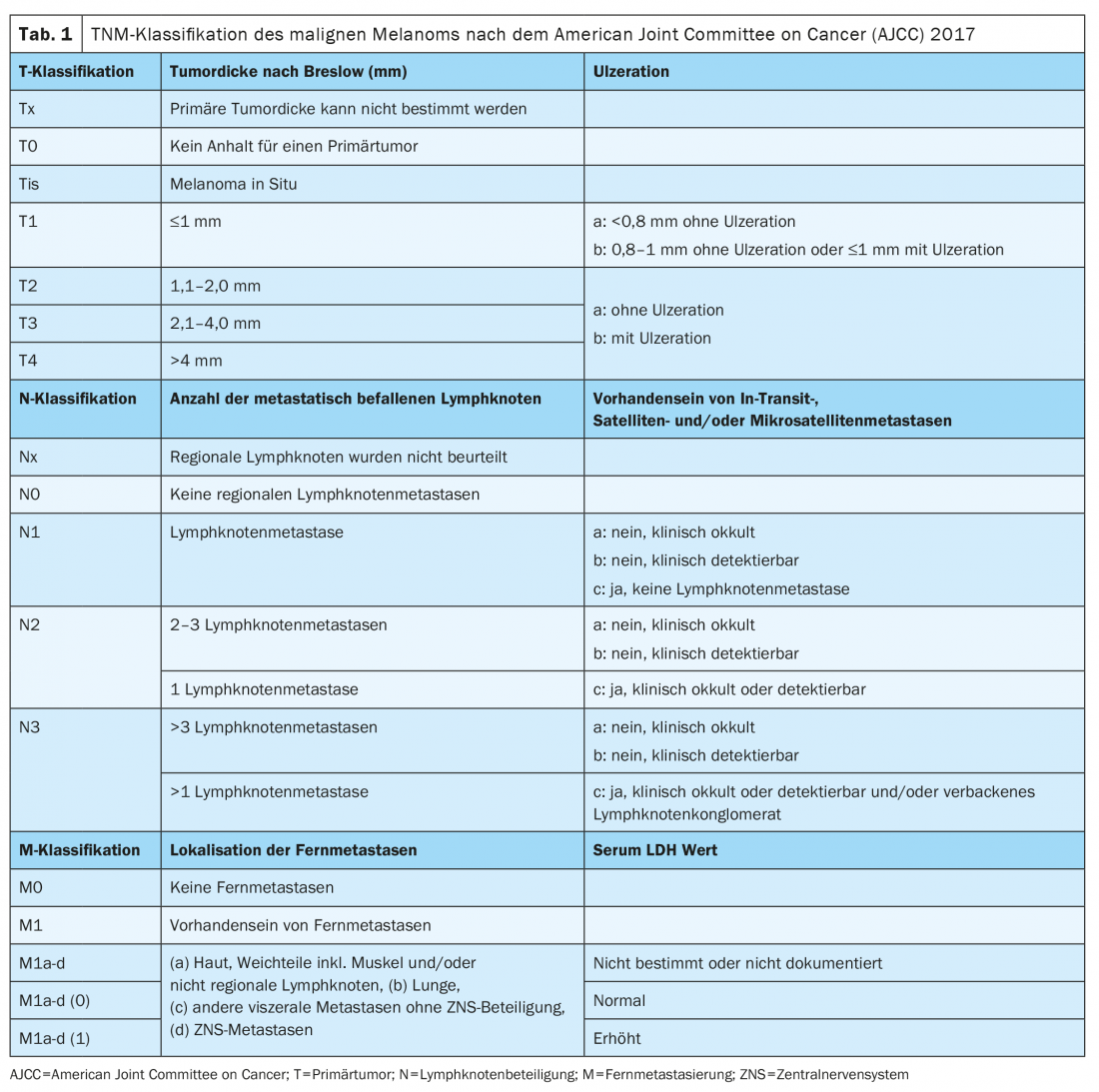
El diagnóstico patológico molecular mediante secuenciación de nueva generación (NGS) para determinar el estado de BRAF debe realizarse en el melanoma localmente avanzado o metastásico de los estadios III y IV. El examen inmunohistoquímico sólo permite detectar una mutación V600E, mientras que la V600K y otras mutaciones atípicas no pueden detectarse. La clasificación genómica del melanoma cutáneo prevé una división en cuatro subtipos: Melanoma con mutación BRAF (50%); mutación N-Ras, K-Ras o H-Ras (25%); mutación NF1 (15%) y melanoma triple de tipo salvaje (10%) [2].
A pesar de los importantes avances en la comprensión de las bases genéticas del melanoma, el uso de las alteraciones genéticas con fines diagnósticos, pronósticos o terapéuticos sigue siendo limitado. El estado de la mutación BRAFV600E/K es predictivo del tratamiento con inhibidores de BRAF. Aunque actualmente no existen terapias dirigidas establecidas para las demás alteraciones genéticas, éstas proporcionan información importante para la inclusión en el estudio, así como posibles enfoques terapéuticos futuros.
Terapia quirúrgica del tumor primario y los ganglios linfáticos regionales
Si se sospecha clínicamente un melanoma maligno, debe realizarse una escisión in toto. Tras la confirmación histopatológica de un melanoma maligno, el tratamiento primario es la escisión local con un margen de seguridad suficiente, en función del grosor tumoral según Breslow (0,5 cm para melanomas in situ, 1 cm para melanomas con un grosor tumoral de hasta 2 mm, 2 cm a partir de un grosor tumoral de 2 mm). Un margen de seguridad suficiente se asocia a una reducción de la tasa de recidiva local sin mejorar la supervivencia global [3]. Para las localizaciones en la zona facial o genital, la distancia de seguridad recomendada puede ajustarse si debe asumirse una morbilidad significativa a pesar de la cirugía reconstructiva. Hay que subrayar que las distancias de seguridad no deben reducirse por razones estéticas.
En las directrices de la ESMO se recomienda una biopsia del ganglio linfático centinela (BGC) para un estadio pT1b (es decir, un grosor tumoral según Breslow de >0,8 mm o <0,8 mm con ulceración) según la 8ª edición de la AJCC. El estudio prospectivo MSLT-I validó el valor pronóstico y la contribución del ganglio linfático centinela (GLC) a la estadificación sin demostrar un beneficio para la supervivencia de este procedimiento [4]. Hasta 2017, la disección completa del ganglio linfático centinela positivo se consideraba el tratamiento estándar. Tanto el estudio alemán DeCOG-SLT como el estudio internacional MSLT-2 compararon el seguimiento ecográfico regular de la zona de drenaje linfático con la disección completa de los ganglios linfáticos (DGL) en caso de SLK positivo [5,6]. Ambos estudios constataron un aumento de la morbilidad (linfedema) pero ninguna mejora significativa de la supervivencia específica del melanoma. Por lo tanto, a partir de 2019, la DGL para un ganglio centinela positivo ya no se recomienda en las directrices de la ESMO [7]. Sin embargo, la DGL sigue recomendándose en caso de afectación macroscópica de los ganglios linfáticos. Debe tenerse en cuenta que ambos estudios se realizaron antes de la introducción de las terapias sistémicas adyuvantes y que la disección de los ganglios linfáticos se realizó en las poblaciones de estudio de las terapias adyuvantes [8–10].
Terapia del sistema adyuvante
Tras una resección completa con un margen de seguridad suficiente y libre de tumor, los pacientes con melanoma en estadios IIB, IIC, III y IV tienen un riesgo significativo de recidiva. En estos estadios tumorales, debe considerarse la terapia sistémica adyuvante para reducir el riesgo de recidiva local y metástasis a distancia y mejorar la supervivencia global. Los inhibidores de los puntos de control inmunitarios y las terapias dirigidas están actualmente aprobados en EE.UU. y Europa para el tratamiento adyuvante del melanoma completamente resecado en estadios III y IV y reducen el riesgo de recidiva en aproximadamente un 50%. Las indicaciones y las autorizaciones difieren en función de los criterios de inclusión del estudio. Cabe señalar que la estadificación de estas poblaciones de estudio se basa en la AJCC 7ª edición de 2009.
Terapia dirigida adyuvante con inhibidores de BRAF y MEK
En el ensayo COMBI-AD de fase III (Tab. 3 ), los pacientes con melanoma completamente resecado con una mutación BRAFV600E/K en estadios IIIA (metástasis SLK >1 mm), IIIB y IIIC fueron tratados durante 12 meses con terapia peroral dirigida con los inhibidores de BRAF y MEK dabrafenib y trametinib o placebo. En una mediana de seguimiento de cinco años, se demostró una mejora significativa de la supervivencia libre de recidiva (RFS) (cociente de riesgos HR 0,51) y también de la supervivencia libre de metástasis (HR 0,55) para esta terapia adyuvante en comparación con el placebo. La combinación también mejoró la supervivencia global (SG) a los tres años (HR 0,57). El beneficio se documentó en todos los subgrupos [8,11]. Posteriormente, la terapia dirigida con dabrafenib y trametinib recibió la aprobación en toda la UE en agosto de 2018 para el tratamiento adyuvante del melanoma maligno metastásico linfogénico con mutación BRAFV600E/K.
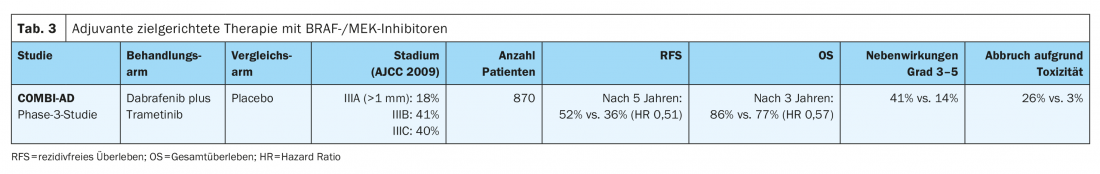
El ensayo BRIM8 comparó la monoterapia adyuvante con el inhibidor de BRAF vemurafenib con placebo en melanomas resecados en estadio IIC-III. El criterio de valoración primario de prolongar la supervivencia libre de enfermedad no se cumplió en el estudio, por lo que la monoterapia con un inhibidor de BRAF en el contexto adyuvante no es una opción de tratamiento.
Inmunoterapia adyuvante
En el estudio CheckMate-238 (Tab. 4) La terapia adyuvante intravenosa con el anticuerpo monoclonal anti-PD-1 nivolumab (3 mg/kg) mostró una mejora significativa de la supervivencia libre de recidiva (HR 0,71) y de metástasis (HR 0,79) al cabo de cuatro años en melanomas en estadio IIIB/C y IV completamente resecados en comparación con el anticuerpo anti-CTLA4 de dosis alta ipilimumab (10 mg/kg). La supervivencia global a los cuatro años fue comparable en los dos brazos de tratamiento (HR 0,87). Además, en comparación con las dosis altas de ipilimumab, con nivolumab se produjeron significativamente menos acontecimientos adversos graves (grado 3-5) con interrupción consecutiva del tratamiento (9,7% frente a 42,6%). Los resultados en cuanto a toxicidades tardías fueron similares en los dos brazos de tratamiento (1% frente a 2%) [10,12]. El nivolumab fue aprobado en toda la UE en 2018 para el tratamiento adyuvante del melanoma maligno en estadios III y IV tras una metastasectomía completa.
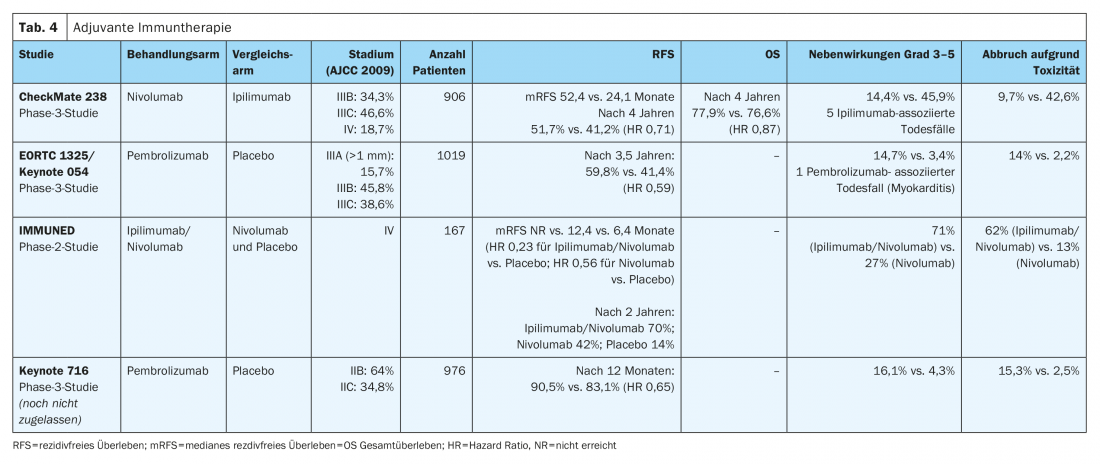
La eficacia del anticuerpo anti-PD-1 pembrolizumab quedó demostrada en el ensayo de fase III EORTC1325/Keynote-54 en pacientes con melanoma en estadio IIIA completamente resecado (metástasis en ganglio linfático centinela >1 mm), IIIB o IIIC (sin metástasis en tránsito) (Tabla 4). En una mediana de seguimiento de tres años, el pembrolizumab se asoció con una supervivencia libre de recaída significativamente mayor en comparación con el placebo en la población global (HR 0,56). Se observaron acontecimientos adversos graves (grado 3-5) con mayor frecuencia con pembrolizumab que con placebo (14% frente a 3%) [9]. El pembrolizumab recibió la aprobación en toda la UE para esta indicación en enero de 2019.
El efecto positivo en términos de mejora de la supervivencia libre de recaída se observó en todos los subgrupos predefinidos tanto en el ensayo EORTC1325/Keynote-054 como en el ensayo CheckMate-238. En ambos estudios, el inhibidor de los puntos de control inmunitarios se administró durante una duración total de la terapia de un año.
Los resultados preliminares del ensayo aleatorizado de fase III CheckMate 915 (Tab. 4) no muestran ninguna mejora en la supervivencia sin recaída de los pacientes con melanoma avanzado resecado en estadio IIIB-D o IV que reciben tratamiento adyuvante con nivolumab (240 mg cada 2 semanas) en combinación con ipilimumab (1 mg/kg cada 6 semanas) durante una duración total del tratamiento de 12 meses en comparación con la monoterapia con nivolumab (480 mg cada 4 semanas). Estos resultados difieren significativamente de los resultados del estudio adyuvante de fase II IMMUNED (Tab. 4). Este estudio demostró una clara superioridad de la terapia combinada adyuvante con nivolumab (1 mg/kg) e ipilumab (3 mg/kg) durante 4 ciclos cada 3 semanas sobre la monoterapia con nivolumab (3 mg/kg) cada 2 semanas o placebo en pacientes con melanoma maligno en estadio IV sin evidencia de enfermedad tras la cirugía. El cociente de riesgo de recidiva fue de 0,23 en el grupo de nivolumab/ipilimumab en comparación con el grupo placebo y de 0,56 en el grupo de nivolumab en comparación con el grupo placebo. Los acontecimientos adversos de cualquier grado asociados a la terapia provocaron la interrupción del tratamiento en el 62% de los pacientes del grupo de nivolumab/ipilimumab y en el 13% de los participantes en el estudio que recibieron tratamiento con nivolumab [13].
Basándose en estos resultados, los pacientes con melanoma maligno en estadio IV sin evidencia de enfermedad deben recibir inmunoterapia combinada adyuvante tras la cirugía o la radioterapia, independientemente del estado de la mutación BRAFV600. En el caso de los pacientes con contraindicaciones para la inmunoterapia combinada con nivolumab e ipilumumab, en esta situación debería administrarse un año de terapia adyuvante con nivolumab como monoterapia, de forma análoga al estudio CheckMate 238. Esta terapia tiene un perfil de toxicidad más controlable y está aprobada para el tratamiento de pacientes con enfermedad en estadio IV completamente resecada [10].
Inmunoterapia adyuvante en estadios IIB y IIC
Los pacientes con melanoma resecado y un grosor tumoral según Breslow de >4 mm o >2 mm en presencia de ulceración sin afectación de los ganglios linfáticos (estadio IIB o IIC según la 8ª edición de la AJCC) tienen un mayor riesgo de recidiva. El riesgo de recidiva y mortalidad es comparable al de los pacientes con melanoma en estadio IIIA o IIIB. Los datos del ensayo aleatorizado de fase III Keynote-716 se presentaron en el Congreso ESMO 2021. Estos muestran una mejora significativa de la supervivencia libre de recaída en pacientes con melanoma en estadio IIB o IIC completamente resecado con 12 meses de tratamiento adyuvante con el anticuerpo anti-PD1 pembrolizumab en comparación con placebo (HR 0,65). El pembrolizumab aún no está aprobado para esta indicación.
Valor de la terapia sistémica adyuvante en estadio IIIA
El pronóstico en el estadio tumoral IIIA (según la 8ª edición de la AJCC) es muy bueno, con una tasa de supervivencia del 88% al cabo de 10 años. Este hecho condujo al debate sobre si la terapia sistémica adyuvante es un tratamiento excesivo para este grupo de pacientes. Sopesar el riesgo de toxicidad grave y posiblemente irreversible frente al beneficio potencial es especialmente importante en aquellos pacientes con melanoma en estadio IIIA.
El ensayo CheckMate-238 no incluyó a pacientes con melanoma AJCC en estadio IIIA (7ª edición) [12]. Por el contrario, el ensayo EORTC1325/Keynote-54 incluyó a pacientes con melanoma en estadio IIIA (7ª edición) de la AJCC con metástasis en los ganglios linfáticos de más de 1 mm. En el subgrupo de pacientes con enfermedad en estadio IIIA de la AJCC (7ª edición), la supervivencia libre de recaída al año fue del 89,8% con el tratamiento con pembrolizumab en comparación con el 76,8% con placebo (HR 0,32, intervalo de confianza del 99% 0,09 -1,23; p=0,0217). Tras la reclasificación de los pacientes según el melanoma AJCC 8ª edición, el 8% de los pacientes tenían un melanoma en estadio tumoral IIIA. En cuanto a la supervivencia sin recaída, se observó un efecto positivo comparable en todos los subgrupos. Debe tenerse en cuenta que el tiempo de seguimiento fue muy limitado y que el intervalo de confianza para los pacientes con tumores en estadio IIIA según la 8ª edición de la AJCC fue muy grande [14]. El estudio COMBI-AD también incluyó a pacientes con tumor en estadio IIIA (AJCC 8ª edición) con metástasis en ganglio linfático centinela de >1 mm. También en este estudio se documentó un efecto positivo con respecto a la supervivencia libre de recidiva en todos los subgrupos, pero también con un resultado menos claro para este estadio [8].
Perfil de efectos secundarios
Para la terapia adyuvante del melanoma en estadio III con mutación BRAFV600, se dispone tanto de los inhibidores de los puntos de control inmunitarios nivolumab y pembrolizumab como del tratamiento dirigido con los inhibidores de BRAF/MEK dabrafenib y trametinib. Los perfiles de efectos secundarios de las terapias dirigidas y de los inhibidores de los puntos de control inmunitarios difieren significativamente. Mientras que los efectos secundarios reversibles son más frecuentes con las terapias dirigidas, los efectos secundarios inmunomediados poco frecuentes pueden ser duraderos e irreversibles con los inhibidores de puntos de control inmunitarios [15]. Estos efectos secundarios inmunomediados pueden afectar a cualquier órgano. Las endocrinopatías se encuentran entre los efectos secundarios inmunomediados más comunes y, a diferencia de las demás toxicidades, suelen ser irreversibles. En consecuencia, requieren una terapia de sustitución de por vida. Las complicaciones endocrinas más comunes son la distireosis (30%), las hipofisitis (5,6 -11%), la diabetes mellitus tipo 1 (0,2-2%) y las insuficiencias suprarrenales (0,7%), aunque también se han descrito casos raros de hipoparatiroidismo. Además, los limitados datos disponibles sugieren que el hipogonadismo primario inmunomediado debido a la orquitis, o el hipogonadismo secundario en el contexto de la hipofisitis, plantean riesgos potenciales de infertilidad posterior [16]. La mitad de los pacientes con melanoma de una cohorte nacional danesa sometidos a terapia adyuvante con nivolumab interrumpieron prematuramente el tratamiento previsto de un año debido a toxicidad o recaída. Además, se documentó un deterioro temporal de la calidad de vida [17].
Se produjeron toxicidades de grado 3 – 4 asociadas a la terapia en el 41% de los pacientes del brazo de tratamiento (dabrafenib en combinación con trametinib) en el estudio COMBI-AD, mientras que esto sólo se observó en el 14% de los pacientes del grupo placebo. La pirexia es el motivo más frecuente de modificación de la dosis y de interrupción del tratamiento dirigido.
Además, los pacientes suelen mostrar síntomas generales inespecíficos como fatiga o efectos secundarios gastrointestinales en el sentido de náuseas. Los efectos secundarios cardíacos (disfunción ventricular izquierda, prolongación del intervalo QT) ocurren raramente, aunque está indicado un seguimiento cardiológico regular. En general, debe tenerse en cuenta que cuando se producen reacciones adversas a los fármacos, suele bastar con reducir la dosis de uno de ellos o de ambos. Los efectos secundarios suelen ser completamente reversibles tras la interrupción de la terapia combinada.
Selección de la terapia del sistema adyuvante en la vida cotidiana
Existen muy pocos datos sobre la toxicidad y las tasas de interrupción del tratamiento en la práctica diaria. En un estudio holandés, se demostró que un total del 93% de los pacientes que cumplían los requisitos para recibir terapia adyuvante recibieron tratamiento adyuvante anti-PD-1. Estos datos mostraron una mayor tasa de toxicidad con interrupciones prematuras del tratamiento consecutivas más frecuentes. La supervivencia libre de recurrencia fue comparable a la de los ensayos pivotales [18].
Para los pacientes con melanoma de tipo BRAF salvaje, el bloqueo PD-1 es la terapia adyuvante de elección. Para los pacientes con melanoma con mutación BRAFV600E/K, el riesgo de acontecimientos adversos inmunomediados persistentes con inmunoterapia debe tenerse en cuenta a la hora de elegir el tratamiento adyuvante, ya que el cociente de riesgo de supervivencia libre de recidiva es comparable en los tres ensayos de tratamiento adyuvante. Por lo tanto, la elección de la terapia debe discutirse con los pacientes y hacerse conjuntamente.
Mensajes para llevarse a casa
- El grosor tumoral vertical según Breslow y la presencia de ulceración son los factores pronósticos más importantes.
- El diagnóstico patológico molecular mediante secuenciación de nueva generación (NGS) para determinar el estado de BRAF debe realizarse a partir del estadio III.
- Se recomienda una biopsia del ganglio linfático centinela (BGC) para un estadio pT1b (es decir, un grosor tumoral según Breslow de >0,8 mm o <0,8 mm con ulceración) según la 8ª edición de la AJCC. La disección del ganglio linfático está indicada en caso de afectación macroscópica del ganglio linfático, pero no se recomienda en caso de ganglio linfático centinela positivo.
- Se recomienda la terapia sistémica adyuvante con un anticuerpo monoclonal anti-PD-1 o inhibidores de BRAF/MEK a partir del estadio IIIA con metástasis en ganglio linfático centinela >1 mm.
- La elección de la terapia sistémica adyuvante se basa tanto en la indicación como en la aprobación, teniendo en cuenta el estado de la mutación BRAF y el perfil de efectos secundarios.
Literatura:
- Siegel RL, Miller KD, Jemal A: Estadísticas sobre el cáncer, 2018. A Cancer Journal for Clinicians 2018; 68(1): 7-30.
- Akbani R, et al: Clasificación genómica del melanoma cutáneo. Cell 2015; 161(7): 1681-1696.
- Hayes AJ, et al: Márgenes de escisión anchos frente a estrechos para melanomas cutáneos primarios de alto riesgo: seguimiento a largo plazo de la supervivencia en un ensayo aleatorizado. The Lancet Oncology 2016; 17(2): 184-192.
- Morton DL, et al: Informe final del ensayo de biopsia del ganglio centinela frente a observación ganglionar en melanoma. New England Journal of Medicine 2014; 370(7): 599-609.
- Leiter U, et al: Análisis final del ensayo DeCOG-SLT: No hay beneficio para la supervivencia con la disección ganglionar completa en pacientes con melanoma con ganglio centinela positivo. J Clin Oncol 2019; 37(32): 3000-3008.
- Faries MB, et al: Disección completa u observación para la metástasis del ganglio centinela en el melanoma. N Engl J Med 2017; 376(23): 2211-2222.
- Michielin O, et al: Melanoma cutáneo: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimientodagger. Ann Oncol 2019; 30(12): 1884-1901.
- Dummer R, et al: Análisis quinquenal del dabrafenib adyuvante más trametinib en el melanoma en estadio III. N Engl J Med 2020; 383(12): 1139-1148.
- Eggermont AMM, et al: Adjuvant pembrolizumab versus placebo in resected stage III melanoma (EORTC 1325-MG/KEYNOTE-054): distant metastasis-free survival results from a double-blind, randomised, controlled, phase 3 trial. The Lancet Oncology 2021; 22(5): 643-654.
- Ascierto PA, et al: Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. The Lancet Oncology. 2020. 21(11): 1465-1477.
- Long GV, et al: Dabrafenib adyuvante más trametinib en el melanoma con mutación BRAF en estadio III. New England Journal of Medicine 2017; 377(19): 1813-1823.
- Weber J, et al: Nivolumab adyuvante frente a ipilimumab en melanoma resecado en estadio III o IV. New England Journal of Medicine 2017; 377(19): 1824-1835.
- Zimmer L, et al: Nivolumab adyuvante más ipilimumab o nivolumab en monoterapia frente a placebo en pacientes con melanoma resecado en estadio IV sin evidencia de enfermedad (IMMUNED): un ensayo aleatorizado, doble ciego, controlado con placebo, de fase 2. The Lancet 2020; 395(10236): 1558-1568.
- Eggermont AMM, et al: Prognostic and predictive value of AJCC-8 staging in the phase III EORTC1325/KEYNOTE-054 trial of pembrolizumab vs placebo in resected high-risk stage III melanoma. Revista Europea del Cáncer 2019; 116: 148-157.
- Ghisoni E, et al: Efectos adversos de los inhibidores de los puntos de control inmunitarios de aparición tardía y de larga duración: un aspecto pasado por alto en la inmunoterapia. Eur J Cancer. 2021. 149: 153-164.
- Ozdemir BC: Hipogonadismo e infertilidad relacionados con los inhibidores de los puntos de control inmunitarios: una cuestión olvidada en inmuno-oncología. J Immunother Cancer 2021; 9(2).
- Ellebaek EEA: Un estudio real a escala nacional sobre los resultados y la calidad de vida tras la introducción de la inmunoterapia adyuvante en pacientes daneses con melanoma. ESMO Resumen 1071P, 2021.
- De Meza MEA: Tratamiento adyuvante del melanoma en la práctica clínica: ensayo versus realidad. ESMO Resumen 1070P, 2021.
PRÁCTICA DERMATOLÓGICA 2022; 32(1): 11-16











