Los linfomas son responsables del 3,8% de todos los nuevos diagnósticos de cáncer. Según la clasificación actual de la OMS, existen más de 75 linfomegalias diferentes, que se tratan de forma distinta. En el tratamiento del linfoma difuso de células B grandes (LDCBG), el linfoma periférico de células T y el linfoma de Hodgkin clásico, han ocurrido muchas cosas en los últimos años.
Según las clasificaciones utilizadas anteriormente, los linfomas se dividen tradicionalmente en los denominados linfomas Hodgkin y no Hodgkin. Esta clasificación se sigue utilizando en las estadísticas individuales y sirve de base para el registro de la incidencia nacional (www.nkrs.ch/de/stat). Según esta recopilación de datos, algo menos de 1.600 pacientes al año desarrollan en Suiza un linfoma no Hodgkin y alrededor de 250 un linfoma de Hodgkin. Los linfomas son responsables del 3,8% de todos los nuevos diagnósticos de cáncer. La tasa de mortalidad anual es de algo más de 500 muertes. Así, los linfomas representan el 3,2% de todas las muertes por cáncer.
Clasificación actual de la OMS y presentación clínica
La Organización Mundial de la Salud (OMS) ya ha creado varias clasificaciones para los linfomas y ha sustituido cada vez más el término linfoma no hodgkiniano por una clara denominación y subtipificación de las entidades individuales. La clasificación actualmente vigente desde 2016 incluye más de 75 linfomegalias [1]. Se basa en la diferente morfología, la presentación clínica y cada vez más también en aspectos moleculares o genéticos.
En mi opinión, esta clasificación es muy importante, ya que el diagnóstico, el pronóstico y la terapia difieren fundamentalmente en algunos casos. En la actualidad, los términos indolente y agresivo deben utilizarse principalmente en relación con el comportamiento de crecimiento del linfoma respectivo. Aproximadamente el 50% de todos los linfomas pertenecen a los de crecimiento lento, por lo que se denominan indolentes. El otro 50% son linfomas de crecimiento rápido y, por tanto, bastante agresivos. En esta recopilación, me gustaría hablar brevemente de la terapia de linfomas agresivos seleccionados.
Terapia del linfoma difuso de células B grandes (LDCBG)
Los DLBCL representan el 25-30% de todos los linfomas y son, por tanto, la entidad linfomatosa más frecuente. Pertenecen a los linfomas agresivos de células B. En la mayoría de los casos, el objetivo del tratamiento debe ser el control o la curación a largo plazo de la enfermedad. Por lo general, esto sólo se consigue mediante inmunoquimioterapia intensiva, que se basa en la combinación de un anticuerpo CD20 específico con poliquimioterapia. Normalmente, se utiliza un régimen CHOP o similar al CHOP. En cuanto al pronóstico, entretanto existen varios sistemas de evaluación. La estratificación del riesgo más utilizada y que en gran medida sigue siendo válida se basa en el denominado “Índice Pronóstico Internacional (IPI)” (Tab. 1) [2]. Para los pacientes menores de 60 años, se suele utilizar el llamado “índice pronóstico internacional ajustado a la edad (aaIPI )” adaptado. Basándose en esta clasificación, los pacientes con LDCBG pueden dividirse en cuatro grupos. Mientras que los mayores de 60 años no se subtipifican más, existen tres grupos en los menores de 60 años: Pacientes en estadio precoz con pronóstico favorable (aaIPI 0), pacientes más jóvenes con pronóstico desfavorable (aaIPI 1 y/o a granel) y como tercer grupo los denominados pacientes de alto riesgo (aaIPI ≥2).
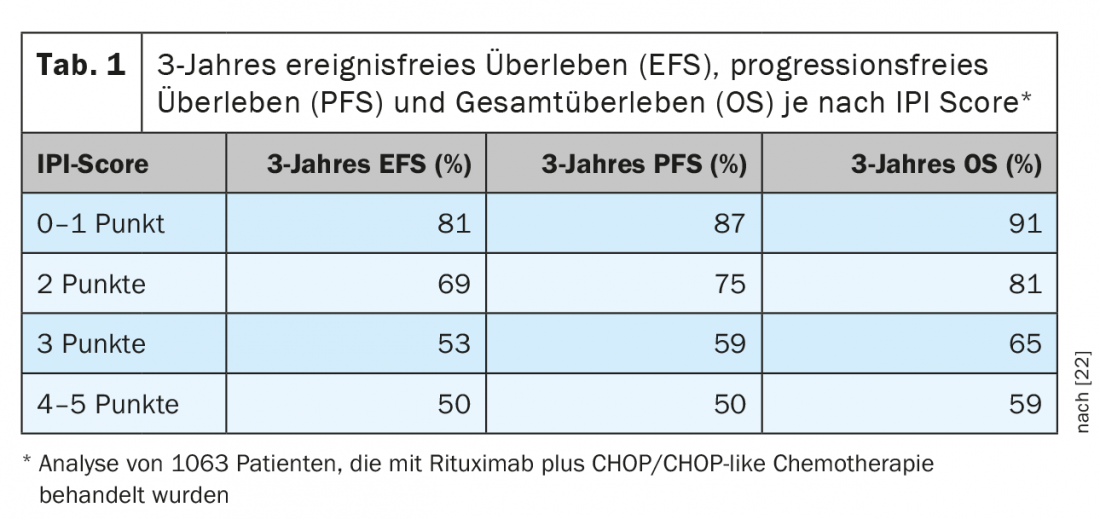
Para el tratamiento de pacientes de mayor edad (>60 años), suelen utilizarse seis ciclos de rituximab + CHOP, principalmente a intervalos de 21 días y raramente cada 14 días. La superioridad de un régimen de 14 días establecida por el grupo de estudio alemán DSHNL [3] no pudo ser confirmada ni por el grupo de estudio inglés [4], ni por el francés [5], por lo que no se da una comparabilidad directa de los estudios. No se aleatorizó el beneficio de ocho ciclos de R-CHOP en comparación con seis ciclos en el régimen de 21 días. Sin embargo, los análisis retrospectivos del ensayo aleatorizado de fase III GOYA [6], en el que se dio a los centros la posibilidad de elegir entre seis y ocho ciclos, no mostraron diferencias en la eficacia. Así, seis ciclos de R-CHOP cada 21 días se consideran a menudo estándar. La administración adicional de inmunoterapia dos veces como séptimo y octavo ciclo de tratamiento en forma de otras dos dosis de rituximab en el denominado “régimen 6 + 2” tampoco demostró ser superior en el estudio PETAL [7].
En pacientes jóvenes menores de 60 años con ausencia de factores de riesgo y pronóstico favorable (aaIPI 0, sin volumen), se demostró que cuatro ciclos de R-CHOP-21 proporcionaban una supervivencia libre de progresión (SLP) y una supervivencia global (SG) excelentes en el ensayo FLYER publicado recientemente [8]. Esto permite una reducción de la dosis y una reducción significativa de la morbilidad relacionada con la terapia con altas tasas de curación (SLP a 3 años del 96% frente al 93%). Para el segundo grupo de personas menores de 60 años con aaIPI 1 y/o bulk, se consideran estándar seis ciclos de R-CHOP-21 con radioterapia de consolidación del bulk inicial. En el estudio MINT sobre el DSHNHL [9], la supervivencia libre de acontecimientos (SLE) a 6 años con esta terapia fue del 71%. El grupo de estudio francés GELA/LYSA demostró la superioridad del régimen R-ACVBP [10] sobre el R-CHOP-21 para este colectivo. Sin embargo, este resultado debe cuestionarse críticamente porque, a diferencia del estudio DSHNHL, no se utilizó radioterapia.
Los pacientes más jóvenes de alto riesgo (aaIPI ≥ 2) siguen teniendo, por desgracia, un mayor riesgo de recidiva y, por tanto, menores posibilidades de curación. La terapia óptima para esta población de pacientes no está definida de manera uniforme. Algunos grupos de estudio utilizan el esquema R-CHOP-21 mencionado anteriormente [4]. Otros centros de estudio, como algunos centros estadounidenses y europeos, realizan a priori una terapia de consolidación de altas dosis con trasplante autólogo de células madre en la primera línea de tratamiento. El DSHNHL probó ocho ciclos de R-CHOEP-14 frente a un enfoque de triple trasplante en el ensayo MEGA-CHOEP [11]. Se demostró la superioridad (SSC a 3 años 69,5% frente a 61,4%) del brazo 8 x R-CHOEP-14. En el ámbito estadounidense, a menudo se utiliza el régimen R-DA-EPOCH en lugar del R-CHOEP. En general, la mayoría de los centros favorecen un régimen de tratamiento más intensivo en dosis que un régimen R-CHOP estándar.
En particular, el tratamiento de los pacientes más jóvenes de alto riesgo demuestra que la terapia de primera línea del DLBCL es decisiva para el pronóstico. Si la enfermedad recae en un plazo de 12-18 meses, el pronóstico suele ser malo y sólo unos pocos pacientes pueden lograr una remisión a largo plazo. Sin embargo, si los pacientes no han tenido una recaída en los primeros 18 -24 meses tras el final de la terapia, el control de la enfermedad a largo plazo con altas tasas de curación es mucho más común. Esto demuestra que debe elegirse un concepto curativo en la medida de lo posible en el contexto de la terapia de primera línea. En los últimos años, la biología molecular ha permitido profundizar en los patomecanismos subyacentes de la enfermedad y diversos estudios, basados en el régimen R-CHOP ya mencionado y establecido, han estudiado el valor terapéutico de diferentes inhibidores de la señalización. Por ejemplo, el inhibidor del proteasoma bortezomib también se probó en Suiza [12]. Lamentablemente, no se observó ningún beneficio del tratamiento en la población general. La adición del inmunomodulador lenalidomida al R-CHOP tampoco mostró beneficios significativos en el ensayo prospectivo aleatorizado ROBUST [13]. Actualmente se están realizando estudios sobre el uso de inhibidores de BTK (por ejemplo, ibrutinib) [14], así como de inhibidores de BCL2 (venetoclax) [15]. Los estudios iniciales de fase II y los análisis de subgrupos sugirieron ciertas ventajas para las dos últimas sustancias. Sin embargo, aún no se ha demostrado que estos agentes muestren una superioridad significativa sobre el estándar actual y, por lo tanto, ni los inhibidores de BTK ni los de BCL2 son actualmente objeto de nuestra rutina diaria. Como nuevo concepto de terapia, en caso de recaída, es decir, en pacientes mayores tras dos terapias previas y en pacientes más jóvenes por regla general tras dos terapias previas, incluido el tratamiento con una única terapia, fue posible demostrar la eficacia de la terapia. Terapia de altas dosis con sustitución autóloga de células madre, estableciendo la tecnología de células T CAR [16]. Está disponible en centros especializados de Suiza.
Terapia de los linfomas periféricos de células T agresivos (PTCL)
Los linfomas de células T representan alrededor del 10% de todos los nuevos casos de linfoma en el mundo occidental. La clasificación histopatológica y molecular de las distintas entidades del linfoma de células T es compleja y, por desgracia, debido a la rareza de la enfermedad, a menudo sólo se dispone de datos muy limitados procedentes de estudios aleatorizados más amplios. El pronóstico de los linfomas agresivos de células T suele ser menos favorable que el de los linfomas agresivos de células B. Sólo el denominado “linfoma periférico de células T ALK+ (PTCL) ” suele clasificarse como de mejor pronóstico. Los demás subtipos de PTCL muestran en su mayoría un curso rápido de la enfermedad con una respuesta a la terapia a menudo de corta duración. La detección del antígeno CD30 en las células del linfoma es importante para el tratamiento del PTCL. Según el estudio ECHELON-2, si esto se expresa, puede conseguirse una mejora significativa de la SLP a 3 años (57% frente a 44%) y de la SG con la combinación de brentuximab vedotin como inmunoconjugado más quimioterapia CHP [17]. El estudio comparó este tratamiento con el régimen estándar actual CHOP. Los centros del estudio eran libres de aplicar la terapia durante seis u ocho ciclos cada vez. El brentuximab vedotin, al igual que el alcaloide de la vinca vincristina, tiene una elevada neurotoxicidad, por lo que en el brazo experimental hubo que suspender la vincristina cuando se añadió el brentuximab vedotin. Así, la quimioterapia se redujo de CHOP a CHP. Como ya se ha mencionado, además del beneficio en la SLP, también se observó un beneficio en la SG. En consecuencia, esta terapia se considera actualmente el patrón oro para el PTCL CD30-positivo en primera línea. Por desgracia, otras sustancias terapéuticas como los inhibidores de HDAC, los inmunoconjugados, los antimetabolitos y los agentes quimioterapéuticos clásicos sólo tienen una duración de acción muy limitada en el PTCL. Por lo tanto, tras el fracaso de los tratamientos intensivos en terapia, a menudo sólo se dispone de opciones paliativas de corta eficacia.
Terapia del linfoma de Hodgkin clásico (LHc)
En el tratamiento del linfoma de Hodgkin clásico, muchos colegas siguen las directrices del Grupo Alemán de Estudio del Linfoma de Hodgkin (GHSG). Según la estratificación del GHSG, los pacientes con LHc se dividen en tres grupos de riesgo. La última generación de ensayos completada y publicada incluye los ensayos HD16-HD18 para el tratamiento de pacientes en estadios iniciales (HD16), intermedios (HD17) y avanzados (HD18). El ensayo HD16 probó si podía omitirse la radioterapia de consolidación en los casos de negatividad de la PET tras dos ciclos de ABVD (la llamada “negatividad PET2”). Según los resultados del estudio, no debe omitirse la radioterapia, ya que la SLP a 5 años cae del 93,4% con radioterapia al 86% sin radioterapia, por lo que cabe esperar un resultado terapéutico significativamente peor si se omite la radioterapia [18].
En la fase intermedia, se abordó una cuestión similar en el estudio HD17 [19]. Para los pacientes correspondientes, la quimioterapia incluye dos ciclos de BEACOPPPescalado (BEACOPPesc) como estándar, seguidos de dos ciclos de ABVD. Tras estos cuatro ciclos de terapia, se realiza clásicamente una PET-TC (la denominada “PET4”). En el estudio HD17, la radioterapia administrada habitualmente se omitió en caso de negatividad de la PET4. Utilizando este régimen terapéutico, se demostró una SLP a 5 años del 97% en el brazo estándar (con radioterapia) y del 95,1% en el brazo experimental, es decir, con omisión de la radioterapia en caso de negatividad de la PET4. Así pues, el tratamiento con omisión de radioterapia no fue inferior a la terapia estándar con los correspondientes resultados de PET. Según este estudio, es por tanto posible prescindir de la radioterapia de consolidación en caso de negatividad de la PET4 tras cuatro ciclos de quimioterapia.
Los datos del estudio HD18 sobre el tratamiento de los estadios avanzados del LHc ya se han mostrado en varios congresos [20]. En el ámbito del estudio, se definieron seis ciclos de BEACOPPesc como la norma de tratamiento del GHSG. En el brazo experimental, se comprobó la negatividad de la PET2 para ver si dos ciclos más de BEACOPPesc -un total de cuatro en lugar de seis- eran suficientes. El estudio mostró una SLP a 5 años del 91,2% en el brazo estándar de seis ciclos de BEACOPPesc. El brazo guiado por PET2 mostró un resultado comparable del 91,8%. Así, en caso de negatividad de la PET2, ahora puede llevarse a cabo una reducción de la dosis a un total de cuatro ciclos. Se trata de un avance significativo, sobre todo por la edad a menudo temprana de los pacientes con LHc. La reducción de la dosis puede contrarrestar la morbilidad asociada a la terapia y, en particular, la infertilidad inducida por la quimioterapia. Se espera que con la nueva norma de cuidados se produzcan menos segundas neoplasias a lo largo de la vida.
El CHL es una de las entidades con mayores tasas de respuesta a la terapia con inhibidores de PD1. En el caso de la recidiva del cHL, creo que la publicación del estudio KEYNOTE-204 es significativa para la práctica clínica diaria [21]. En este estudio, se probó el uso del inhibidor de PD1 pembrolizumab frente a brentuximab vedotin en pacientes con LHc recidivante en una comparación aleatoria. En el análisis presentado en la Reunión Anual de la ASCO de 2020, se informó de la superioridad del bloqueo de PD1 con una mayor tasa de respuesta (65% frente a 54%) y una mediana de SLP más prolongada de 13,2 frente a 8,3 meses. Además, el bloqueo con PD1 mostró una toxicidad significativamente menor, especialmente neurotoxicidad, por lo que, además de la eficacia, la tolerabilidad también habla a favor del uso temprano de la inmunoterapia en el tratamiento de las recaídas del LHc.
Mensajes para llevarse a casa
- En el tratamiento de los linfomas agresivos de células B, pueden alcanzarse altas tasas de curación mediante el uso de la inmunoquimioterapia.
- La terapia de los linfomas agresivos de células B se estratifica en función del riesgo con 4-6(8) ciclos de inmunoquimioterapia (R-CHOP o R-CHOP-like).
- Los linfomas agresivos de células T suelen tener un pronóstico significativamente peor en comparación con los linfomas agresivos de células B.
- El uso de la inmunotoxina CD30 brentuximab vedotin en combinación con quimioterapia CHP en el PTCL CD30-positivo se considera estándar.
- El CHL se trata con quimioterapia o quimioterapia más radioterapia según el estadio y el riesgo y tiene unas tasas de curación excelentes. El objetivo de los nuevos enfoques terapéuticos suele ser reducir la dosis para evitar la morbilidad relacionada con la terapia y mantener al mismo tiempo unas tasas de curación elevadas.
Literatura:
- Swerdlow SH, et al: Clasificación de la OMS de los tumores del tejido hematopoyético y linfoide. 4ª ed. revisada. Lyon: CIIC; 201.
- El Proyecto Internacional de Factores Pronósticos del Linfoma No Hodgkin. Un modelo predictivo para el linfoma no Hodgkin agresivo. N Engl J Med 1993; 329: 987-994.
- Pfreundschuh M, et al: Seis frente a ocho ciclos de CHOP-14 bisemanal con o sin rituximab en pacientes ancianos con linfomas agresivos de células B CD20+: un ensayo controlado aleatorizado (RICOVER-60). Lancet Oncol 2008; 9: 105-116.
- Cunningham D, et al: Rituximab más ciclofosfamida, doxorrubicina, vincristina y prednisolona en pacientes con linfoma no Hodgkin difuso de células B grandes recién diagnosticado: Una comparación de fase 3 de la intensificación de dosis con ciclos de 14 días frente a ciclos de 21 días. Lancet 2013; 381: 1817-1826.
- Delarue R, et al: Dosis densa de rituximab-CHOP comparada con rituximab-CHOP estándar en pacientes ancianos con linfoma difuso de células B grandes (estudio LNH03-6B): ensayo aleatorizado de fase 3. Lancet Oncol 2013; 14: 525-533.
- Sehn LH, et al: Estudio aleatorizado, abierto, de fase III de obinutuzumab o rituximab más CHOP en pacientes con linfoma difuso de células B grandes no tratado previamente: análisis final de GOYA. J Hematol Oncol. 2020; 13(1): 71-79.
- Schmitz C, et al.: Impacto de la resección quirúrgica completa en los resultados del linfoma no Hodgkin agresivo tratado con inmunoquimioterapia. Cancer Med 2020; 9(22): 8386-8396.
- Poeschel V, et. al: Cuatro frente a seis ciclos de quimioterapia CHOP en combinación con seis aplicaciones de rituximab en pacientes con linfoma agresivo de células B con pronóstico favorable (FLYER): un ensayo aleatorizado, de fase 3, de no inferioridad. Lancet.2019; 394 (10216): 2271-2281.
- Pfreundschuh M, et al: Quimioterapia tipo CHOP con o sin rituximab en pacientes jóvenes con linfoma difuso de células B grandes de buen pronóstico: resultados a 6 años de un estudio aleatorizado abierto del grupo MabThera International Trial (MInT). Lancet Oncol 2011; 12: 1013-1022.
- Recher C et al: Quimioterapia intensificada con ACVBP más rituximab frente a CHOP estándar más rituximab para el tratamiento del linfoma difuso de células B grandes (LNH03-2B): Un ensayo aleatorio abierto de fase 3. Lancet 2011; 378: 1858-1867.
- Schmitz N, et al: Quimioterapia convencional (CHOEP-14) con rituximab o quimioterapia de dosis alta (MegaCHOEP) con rituximab para pacientes jóvenes de alto riesgo con linfoma agresivo de células B: Un ensayo abierto, aleatorizado, de fase 3 (DSHNHL 2002-1). Lancet Oncol 2012; 13: 1250-1259.
- Davies A, et al: Perfil de expresión génica del bortezomib añadido a la quimioinmunoterapia estándar para el linfoma difuso de células B grandes (REMoDL-B): un ensayo abierto, aleatorizado, de fase 3. Lancet Oncol. 2019; 20(5): 649-662.
- Lue JK, O’Connor OA: Una perspectiva sobre la mejora del régimen R-CHOP: del Mega-CHOP al ROBUST R-CHOP, el PHOENIX está aún por subir. Lancet Haematol 2020; 7(11): e838-e850.
- Younes A, et al: Ensayo aleatorizado de fase III de ibrutinib y rituximab más ciclofosfamida, doxorrubicina, vincristina y prednisona en el linfoma difuso de células B grandes de centro no germinal. J Clin Oncol 2019; 37(15): 1285-1295.
- Morschhauser F, et al: A phase 2 study of venetoclax plus R-CHOP as first-line treatment for patients with diffuse large B-cell lymphoma. Sangre 2021; 137(5): 600-609.
- Schuster SJ, et al: Células T receptoras de antígeno quimérico en linfomas de células B refractarios. N Engl J Med 2017; 377: 2545-2554.
- Horwitz S, et al: Grupo de estudio ECHELON-2. Brentuximab vedotin con quimioterapia para el linfoma periférico de células T CD30-positivo (ECHELON-2): un ensayo global, doble ciego, aleatorizado, de fase 3. Lancet 2019; 393(10168): 229-240.
- Fuchs M, et al: Tratamiento guiado por tomografía por emisión de positrones en el linfoma de Hodgkin favorable en estadio temprano: Resultados finales del ensayo internacional aleatorizado de fase III HD16 del Grupo Alemán de Estudio de Hodgkin. J Clin Oncol 37 2019; 31: 2835-2845.
- Borchmann P, et al: Omisión de la radioterapia guiada por PET en el linfoma de Hodgkin desfavorable en estadio temprano (GHSG HD17): un ensayo multicéntrico, abierto, aleatorizado, de fase 3. Lancet Oncol 2021; 22(2): 223-234.
- Borchmann P, et al: Tratamiento guiado por PET en pacientes con linfoma de Hodgkin en estadio avanzado (HD18): resultados finales de un ensayo de fase 3 abierto, internacional y aleatorizado del Grupo Alemán de Estudios sobre el Hodgkin. Lancet 2018; 390(10114): 2790-2802.
- Kuruvilla J, et al.: KEYNOTE-204: Estudio aleatorizado, abierto, de fase III de pembrolizumab (pembro) frente a brentuximab vedotin (BV) en el linfoma de Hodgkin clásico en recaída o refractario (LHc R/R). Presentado en el Programa Científico Virtual de la Sociedad Americana de Oncología Clínica (ASCO) 2020. 29-31 de mayo de 2020. Resumen 8005.
- Ziepert M, et al: El índice pronóstico internacional estándar sigue siendo un predictor válido del resultado en pacientes con linfoma agresivo de células B CD20+ en la era del rituximab. J Clin Oncol. 2010; 28: 2373.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(2): 10-13