El síndrome del intestino corto (SBS) es una forma de insuficiencia intestinal que se produce en el postoperatorio de una resección intestinal extensa o debido a otra limitación funcional de los segmentos intestinales. Según el grado de restricción, están indicadas otras formas de suplementación nutritiva. Con la ayuda de una terapia nutricional específica, algunos pacientes pueden volver a alimentarse por vía oral de forma autónoma.
El síndrome del intestino corto es una enfermedad rara, potencialmente mortal, cuya prevalencia en Alemania se estima en 34 por millón de habitantes [1]. La actual directriz S3 de la Sociedad Alemana de Medicina Nutricional (DGEM) define la insuficiencia intestinal como la incapacidad de mantener el equilibrio de proteínas, energía, líquidos y micronutrientes debido a una capacidad de absorción limitada del intestino (obstrucción, dismotilidad, enfermedad congénita, absorción reducida asociada a la enfermedad) [2]. El síndrome del intestino corto es una forma de insuficiencia intestinal que se produce en el postoperatorio de una resección intestinal extensa o debido a otra limitación funcional de los segmentos intestinales. Las causas más frecuentes son el carcinoma, el infarto mesentérico, la enfermedad de Crohn y la hemorragia postoperatoria [3].
La KDS está clínicamente indicada en cuanto la longitud del intestino remanente sea inferior a 200 cm [4]. El grado de desnutrición y los síntomas individuales dependen de qué sección del intestino esté afectada y en qué medida, sobre todo porque según la sección se absorben sustancias diferentes. Los procesos adaptativos, la enfermedad subyacente y la comorbilidad también influyen [5].
Tipificación y suplementación nutritiva
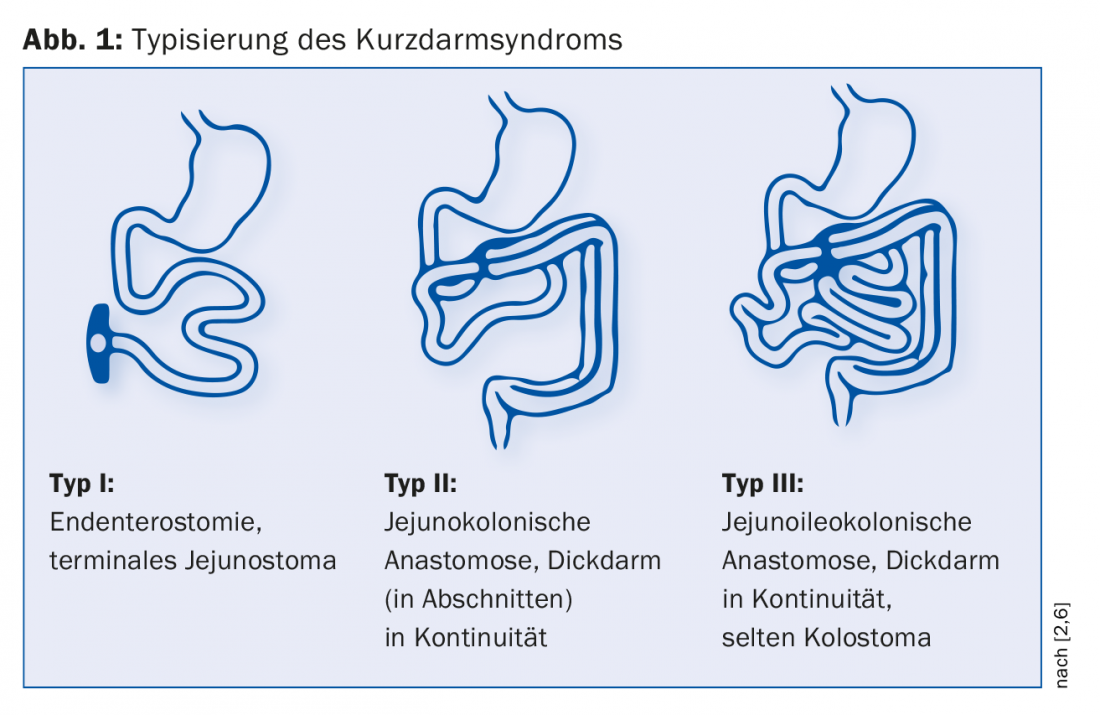
Según Messing, se distinguen tres tipos de KDS postoperatorio (Fig. 1) [6]. La endenterostomía representa el caso más difícil debido a la ausencia tanto del íleon como del colon. “Aquí hay grandes problemas, como la deshidratación con una salida elevada del estoma”, explica la Dra. Krieger-Grübel. El tipo que esté presente influye significativamente en la evolución de la enfermedad: “Si hay menos de un metro de intestino delgado residual con un estoma terminal de intestino delgado, los pacientes dependen de la nutrición parenteral y de soluciones salinas. Si, por el contrario, disponen de más de un metro de intestino delgado y el colon está presente en continuidad, probablemente no necesiten tratamiento nutricional de apoyo a largo plazo”. En un estudio se demostró la influencia de la longitud del intestino remanente en la mortalidad: Al cabo de cinco años, la probabilidad de supervivencia de los pacientes con colon en continuidad era un 30% mayor que la de aquellos con endenterostomía [6].
Terapia nutricional específica para cada fase
El objetivo principal es garantizar el equilibrio de líquidos y nutrientes y la profilaxis de las complicaciones. Dependiendo del estado del tracto gastrointestinal, también se debe capacitar a los pacientes para que vuelvan a alimentarse por vía oral de forma autónoma con una terapia adecuada [7].
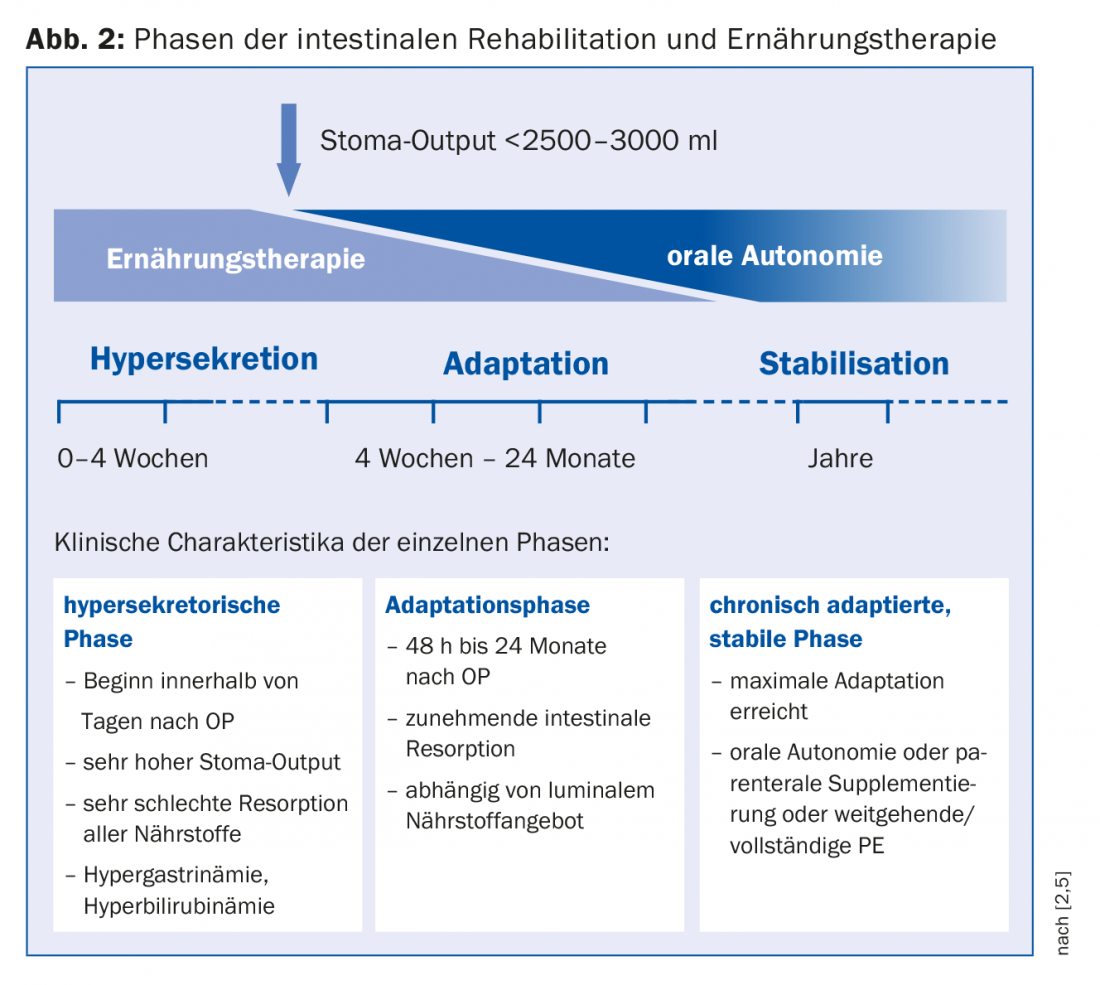
Para la planificación de la terapia, resulta adecuada una división en fase de hipersecreción, fase de adaptación y fase de estabilización, en la que estas fases se funden entre sí (Fig. 2) [1]. Cada fase requiere una estrategia nutricional específica. Inmediatamente después de la intervención, se produce una hipersecreción en forma de estoma de alta producción y diarrea. En este caso, la nutrición parenteral (NP) es inevitable debido a la malabsorción de todos los nutrientes. La monitorización de la homeostasis de fluidos es fundamental. Para comprobar el estado de hidratación (se necesitan 15 ml de líquido/kg de peso corporal para excretar sustancias urinarias), el sodio es adecuado como parámetro sensible, por lo que una cantidad de >20 mmol/l se considera suficiente. Cuando la salida del estoma pueda reducirse (<2500-3000 ml), podrá iniciarse la alimentación oral. “La nutrición enteral es el verdadero desencadenante de la proliferación celular”, subraya la Dra. Krieger-Grübel. Provoca un crecimiento celular, así como un aumento de las vellosidades y, a través de un mayor flujo sanguíneo intestinal, una mejora de la capacidad de absorción. Sin embargo, dado que en principio cabe esperar una mayor demanda de energía, la PE no debe detenerse en una fase temprana [8]. Las recomendaciones para la terapia nutricional oral en la fase de adaptación se resumen en la tabla 1. “Para la rehidratación, una combinación de sodio y glucosa es eminentemente importante porque la captación de glucosa en la célula está acoplada al sodio”. Por lo tanto, los líquidos deben salarse. Para un zumo de manzana diluido 1:3, habría entonces algo menos de 5 g de sal (1 cucharadita), lo que corresponde a unos 100 mmol. En caso de malabsorción de las grasas, la administración de ácidos grasos de cadena media está indicada si el colon está preservado. Otras complicaciones con un colon preservado, como los cálculos renales, pueden prevenirse con un aumento de la ingesta de calcio, que es el responsable de ligar el oxalato, así como con una reducción de principio de los alimentos que contienen oxalato.

Medicamentos
El objetivo de las medidas farmacéuticas es reducir la secreción y frenar la motilidad. Efecto antisecretor, por ejemplo. Inhibidores de la bomba de protones, que inhiben la H+/K+-ATPasa en la célula vestibular, o análogos de la somatostatina. La octreotida, por ejemplo, inhibe varios péptidos, hormonas y la secreción pancreática, pero también provoca una reducción del flujo sanguíneo y de la absorción de alimentos.
La loperamida se utiliza en primer lugar contra el aumento de la motilidad. Si el efecto es demasiado pequeño, puede administrarse después tintura de opio. La loperamida y la tintura de opio consiguen su efecto estimulando los receptores opioides gastrointestinales. La motilidad propulsiva se bloquea, lo que provoca un aumento de la reabsorción de líquidos, una disminución de la secreción y un aumento del tono del esfínter anal [9]. Otras opciones farmacológicas son la colestiramina (diarrea colónica en continuidad), las enzimas pancreáticas en la esteatorrea y las fibras solubles para ligar aún más el líquido intestinal. Un nuevo estudio muestra un efecto de la teduglutida en pacientes sin colon y con estoma: en este grupo de pacientes, la ingesta de líquidos parenterales se redujo en un 40%, mientras que el grupo placebo sólo consiguió una reducción del 19%; por el contrario, no hubo ningún efecto en los pacientes con colon en continuidad [11].
Fuente: Congreso de primavera de la SGAIM, 30 de mayo-1 de junio de 2018, Basilea
Literatura:
- Websky MW, et al: El síndrome del intestino corto en Alemania. Prevalencia estimada y situación asistencial. Cirugía 2014; 85(5): 433-439.
- Lamprecht G, et al.: S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin e.V. in Zusammenarbeit mit der AKE, der GESKES und der DGVS. Nutrición clínica en gastroenterología (parte 3) – Insuficiencia intestinal crónica. Medicina nutricional actual 2014; 39(2): e57-e71.
- Krafft T, et al: Resultados a largo plazo en la insuficiencia intestinal crónica: características, pronóstico y complicaciones. Z Gastroenterol 2013; 51: K285.
- Pironi L, et al: Directrices ESPEN sobre la insuficiencia intestinal crónica en adultos. Nutrición clínica 2016; 35(2): 247-307.
- Karber M, et al: Insuficiencia intestinal crónica y síndrome del intestino corto. Compendio Nutrición Parenteral Domiciliaria (HPE). Directrices KDS Charité Berlín. 2015.
- Messing B, et al.: Supervivencia a largo plazo y dependencia de la nutrición parenteral en pacientes adultos con síndrome de intestino corto. Gastroenterol 1999; 117(5): 1043-1050.
- O’Keefe SJ, et al: Síndrome del intestino corto e insuficiencia intestinal: Definiciones de consenso y visión general. Clin Gastroenterol Hepatol 2006; 4: 6-10.
- Leuenberger M, et al: El síndrome del intestino corto: un reto interdisciplinar. Medicina nutricional actual 2006; 31: 235-242.
- Dorfschmid M, Sinik-Agan C: Insuficiencia intestinal – terapia nutricional en el síndrome del intestino corto. Schw Z Ernährungsmed 2017; 1: 10-18.
- Jeppesen PB, et al: Factores asociados a la respuesta a la teduglutida en pacientes con síndrome de intestino corto e insuficiencia intestinal. Gastroenterol 2018; 154(4): 874-885.
- Matarese LE: Nutrición y optimización de fluidos en pacientes con síndrome de intestino corto. JPEN 2013; 37(2): 161-170.
HAUSARZT PRAXIS 2018; 13(7) – publicado el 8.6.18 (antes de impresión).










