Hoy en día es obligatorio realizar un diagnóstico molecular detallado del cáncer de pulmón no microcítico (CPNM). Si existe una mutación impulsora, debe utilizarse el inhibidor de la tirosina quinasa correspondiente en primera línea, si es posible. En caso de progresión de estos tumores, es muy importante realizar una rebiopsia para identificar mecanismos de resistencia específicamente abordables. Para el CPNM sin mutación impulsora, la quimioterapia citotóxica con platino sigue siendo el tratamiento de elección como tratamiento de primera línea. En la terapia de segunda línea, la inmunoterapia es claramente superior a los tratamientos anteriores y puede considerarse el nuevo estándar.
Ningún otro tumor se cobra tantas vidas en todo el mundo como el carcinoma bronquial [1]. El tabaquismo es el factor desencadenante en más del 80% de los pacientes. En Suiza, la incidencia en los hombres ha disminuido ligeramente en las últimas décadas (actualmente 51/100.000/año), pero desgraciadamente se ha observado un fuerte aumento en las mujeres debido al hábito de fumar (27/100.000/año) [2]. La incidencia del cáncer de pulmón de células pequeñas ha disminuido de forma constante durante 20 años y sigue representando el 15% de todos los cánceres de pulmón. El término carcinoma de células no pequeñas (CPNM) engloba el adenocarcinoma (CA, 45%), el carcinoma de células escamosas (CE, 30%) y el carcinoma de células grandes (CCG, 10%). El cambio en las frecuencias de los distintos grupos histológicos se debe, entre otras cosas, a la introducción de los cigarrillos con filtro.
La mayoría de los pacientes mueren a causa de su enfermedad, en parte porque el 38% ya presenta un estadio metastásico en el momento del diagnóstico [3]. A principios de la década de 1990, el tratamiento estándar para el CPNM metastásico consistía en los “mejores cuidados de apoyo” (MCS) o la participación en un ensayo clínico. Afortunadamente, eso ha cambiado radicalmente. Gracias sobre todo a los avances de la medicina molecular, hoy en día se dispone de toda una gama de opciones terapéuticas nuevas y muy eficaces.
Diagnóstico patológico preciso
El diagnóstico histopatológico exacto es decisivo para la elección de la terapia. El término CPNM no es suficiente: por un lado, hay que distinguir entre AC, LCC y PE; por otro, los análisis moleculares son obligatorios, al menos para todos los AC/LCC, para buscar la denominada mutación conductora. Como el diagnóstico suele realizarse durante una broncoscopia u otra biopsia pequeña, es un reto obtener suficiente material para todas estas investigaciones. La ASCO y otras sociedades oncológicas han desarrollado algoritmos para garantizar el uso óptimo del valioso material de biopsia [4].
En este contexto, es importante que el diagnóstico pueda realizarse también en material citológico. Recientemente, el uso de la “secuenciación de próxima generación” (NGS) ha hecho posible un análisis molecular exhaustivo incluso con poco material. La NGS es sin duda la metodología del futuro [5]. Además, las nuevas tecnologías permiten determinar los cambios genéticos de los tumores a partir del ADN libre circulante en la sangre periférica (“biopsia líquida”).
Terapia del carcinoma de células escamosas
En la EP metastásica, la terapia de primera línea de elección es una combinación de un platino con gemcitabina o paclitaxel. Esta terapia permite una mediana de supervivencia de unos 10-12 meses, frente a los 4-6 meses sin terapia o los 8 meses con platino y los fármacos citostáticos más antiguos [6]. Es importante destacar que la quimioterapia también mejora la calidad de vida en comparación con el BSC. Con una tolerancia aceptable y una progresión tumoral al menos estable, son adecuados 4(-6) ciclos [7]. Los ensayos aleatorios han demostrado que ni la terapia prolongada ni la terapia de mantenimiento conducen a una mejora de la supervivencia global (SG) [8]. El cisplatino no ha demostrado una clara ventaja en cuanto a supervivencia frente al carboplatino, menos tóxico, pero provoca una mayor tasa de respuesta [9].
Terapia de los adenocarcinomas sin mutación Driver
Existen tres diferencias importantes entre la CA sin mutaciones y la PE:
- Un gran ensayo aleatorizado demostró que la terapia combinada con un platino y el análogo del ácido fólico pemetrexed es la más eficaz, tanto en términos de tasa de respuesta como de SG. La superioridad del pemetrexed en el CA sobre la gemcitabina y los taxanos también se ha demostrado en otros estudios [6,10].
- En pacientes que muestren un curso estable o una respuesta bajo cuatro ciclos de esta terapia, puede considerarse la terapia de mantenimiento con pemetrexed solo. Esto puede mejorar tanto la SLP libre de progresión como la SG, con una SG superior a un año con esta terapia (13,9 meses) [11]. Menos común es el “mantenimiento con cambio”, en el que se administra al paciente una nueva sustancia durante la terapia de mantenimiento. Las sustancias eficaces son el erlotinib y probablemente también el docetaxel [12,13].
- El uso adicional de bevacizumab, un anticuerpo monoclonal contra el factor de crecimiento endotelial vascular (VEGF), puede mejorar aún más la supervivencia, aunque sólo en una pequeña medida [14].
Pacientes ancianos y pacientes con un estado general reducido
Durante mucho tiempo, no estuvo claro cómo debían tratarse los pacientes de edad avanzada y/o los pacientes con un estado general reducido (estado de rendimiento ECOG 2-3). Dos importantes ensayos aleatorios han ayudado en este sentido. En un estudio de la EORTC, se comparó la monoterapia con navelbina o gemcitabina con el tratamiento combinado con carboplatino y paclitaxel en pacientes mayores de 70 años con buen estado general de salud. La terapia combinada provocó una mejora significativa de la SG de 6,2 a 10,3 meses [15]. Del mismo modo, un estudio comparó la monoterapia con pemetrexed con una combinación de carboplatino y pemetrexed en pacientes con mala salud general (estado de rendimiento ECOG de 2). De nuevo, la terapia combinada fue significativamente mejor (mediana de SG 5,3 frente a 9,3 meses) [16]. Teniendo en cuenta la situación individual de cada paciente, siempre que sea posible debe optarse por una terapia combinada.
Adenocarcinomas con mutación Driver
Si se detecta una mutación impulsora, la estrategia terapéutica cambia radicalmente. Para estos tumores poco frecuentes, existen inhibidores de la tirosina quinasa (TKI) específicos y dirigidos que proporcionan una tasa de respuesta elevada (60-80%) y una SLP prolongada con una tolerabilidad relativamente buena. Encontrará una lista actualizada de las mutaciones más importantes en www.mycancergenome.org. La frecuencia de las mutaciones individuales se muestra en la figura 1.

Mutación EGFR
Las mutaciones activadoras del receptor del factor de crecimiento epidérmico (EGFR) se producen principalmente en los exones 19 y 21. Para los tumores con una deleción en el exón 19, el TKI del EGFR de elección es afatinib porque fue el único TKI que mostró un beneficio en la SG frente a la quimioterapia de primera línea en un ensayo aleatorizado, aunque se permitió el cambio a un TKI en caso de progresión en el brazo de quimioterapia [17]. El afatinib suele causar diarrea y toxicidades cutáneas. Para las mutaciones en el exón 21 (más comúnmente la mutación puntual L858R), el erlotinib o el gefitinib también son opciones establecidas. Las mutaciones raras en el exón 20 suelen asociarse a la resistencia primaria a los TKI disponibles actualmente.
A pesar de una mediana de SLP de aproximadamente un año con TKI, todos los pacientes desarrollan resistencia y progresión de la enfermedad. En casi el 50% de los casos de resistencia, la mutación portera T790M es la causa de la progresión. Actualmente se dispone del nuevo TKI osimertinib contra esta mutación, con una tasa de respuesta de al menos el 60% y una SLP de diez meses, incluso tras un tratamiento previo con un TKI estándar [18]. Algunos pacientes que se vuelven resistentes al osimertinib presentan otra mutación de portero denominada C797S. Sin embargo, aún no se dispone de ningún TKI contra esta mutación [19].
Otros mecanismos de resistencia son la transformación en carcinoma de células pequeñas, que entonces también debe tratarse como tal, o la aparición de la amplificación MET. También se dispone de TKI específicos para las amplificaciones MET, incluido el crizotinib, que también es eficaz contra el CPNM ALK-positivo. ¡Una rebiopsia tras la progresión es absolutamente recomendable debido a las importantes consecuencias terapéuticas!
Casi todos los pacientes con una mutación del EGFR reciben también quimioterapia convencional durante el curso de la enfermedad; la terapia de elección en este caso es también un platino y pemetrexed, como en el AC sin mutación impulsora.
Translocación ALK
Entre el 4 y el 7% de todos los AC presentan una translocación del gen “quinasa activada en linfoma” (ALK). Existen varios TKI contra estos tumores poco frecuentes. El crizotinib está aprobado como terapia de primera línea: conduce a una tasa de respuesta de >70% y a una SLP de 10,9 meses [20]. Los desarrollos de resistencia también son inevitables con las mutaciones ALK, pero mucho más heterogéneos que con las mutaciones EGFR. Alrededor del 50% de los pacientes siguen dependiendo de la vía de señalización ALK (entre otras cosas debido a la mutación de resistencia de ALK); en el resto de pacientes se produce en algunos casos la activación de vías de señalización alternativas.
En la terapia de segunda línea, el ceritinib y el alectinib demostraron su eficacia con tasas de respuesta en torno al 60% y una SLP de unos siete meses en ensayos de fase II [21,22]. El efecto secundario más importante del ceritinib son las náuseas. El alectinib muestra una eficacia muy buena en el SNC, donde las metástasis se localizan con mayor frecuencia en los AC ALK positivos. En la resistencia secundaria, la mutación de resistencia más importante es la mutación G1202R, contra la que tanto el ceritinib como el alectinib son ineficaces. Se han observado resultados prometedores en estos tumores con lorlatinib, un ALK-TKI de tercera generación [23]. Si la quimioterapia es necesaria, el pemetrexed y un platino también se utilizan para el CPNM con mutación ALK.
Translocación ROS1
La translocación ROS1, una alteración genética muy rara, se produce en aproximadamente el 1,5% de todas las AC. El crizotinib es igual de eficaz que en los AC ALK positivos y, por tanto, se utiliza como terapia de primera línea (aunque aún no está aprobado para ello) [24]. El ceritinib y el alectinib no tienen ningún efecto contra ROS1, mientras que el lorlatinib es eficaz.
Sobreexpresión de MET
El oncogén “factor de transición mesenquimal-epitelial” (MET) es el receptor del “factor de crecimiento de los hepatocitos” (HGF). La sobreexpresión o amplificación de MET es un mecanismo de resistencia secundario relativamente común bajo la terapia EGFR-TKI (5-20%), pero estos cambios también se producen en el CPNM no tratado (2-4%). Para las amplificaciones de MET o las mutaciones de salto de exón 14 más raras, tanto el crizotinib como el cabozantinib son TKI eficaces [25,26]. Los TKI más nuevos, incluido el INC280, se están investigando actualmente en ensayos clínicos.
Mutaciones cuyo significado aún no está claro
Muchos CPNM y especialmente el CA presentan otras mutaciones raras cuyo significado terapéutico aún no está claro, como las mutaciones BRAF y HER2 y las translocaciones RET y NTRK1 [27,28]. Existen TKI específicos para todas estas aberraciones genéticas, y se espera que en un futuro próximo puedan encontrarse estrategias terapéuticas altamente eficaces.
Una excepción importante es la mutación KRAS, que es con diferencia la mutación más común en el CA (20-25%). Desgraciadamente, en la actualidad no existen enfoques terapéuticos para ellos. Los pacientes con CPNM con mutación KRAS son tratados con quimioterapia convencional, pero en general tienen peor pronóstico que otros pacientes.
Inmunoterapias
La innovación más importante de los dos últimos años es la introducción de la inmunoterapia. La segunda generación de inmunoterapias consiste en anticuerpos dirigidos contra PD-1 o contra su ligando PD-L1, que conducen a la activación de células T citotóxicas en el tumor. Ensayos aleatorizados en CPNM de segunda línea han demostrado la superioridad de estos denominados inhibidores de puntos de control inmunitarios sobre la quimioterapia estándar con docetaxel tanto para el PE como para el CA [29,30]. No sólo consiguieron una mejor tasa de respuesta, sino también una SLP y una SG más prolongadas. Incluso existe la esperanza de que pueda lograrse una remisión larga y posiblemente duradera en algunos pacientes. Por ejemplo, en la EP con nivolumab, la mediana de SLP fue de 3,5 meses y la de SG a 1 año fue del 42%, frente a los 2,8 meses y el 21% con docetaxel.
Las inmunoterapias parecen funcionar mejor en los carcinomas inducidos por el tabaco que en los tumores con una mutación conductora. Se sospecha que la inducción de los llamados neoantígenos por la exposición al tabaco tóxico desempeña un papel. Estos neoantígenos se ofrecen al sistema inmunitario como nuevos puntos de ataque. Los fármacos mejor estudiados hasta ahora son el nivolumab (aprobado en Suiza como terapia de segunda línea) y el pembrolizumab.
Conclusión
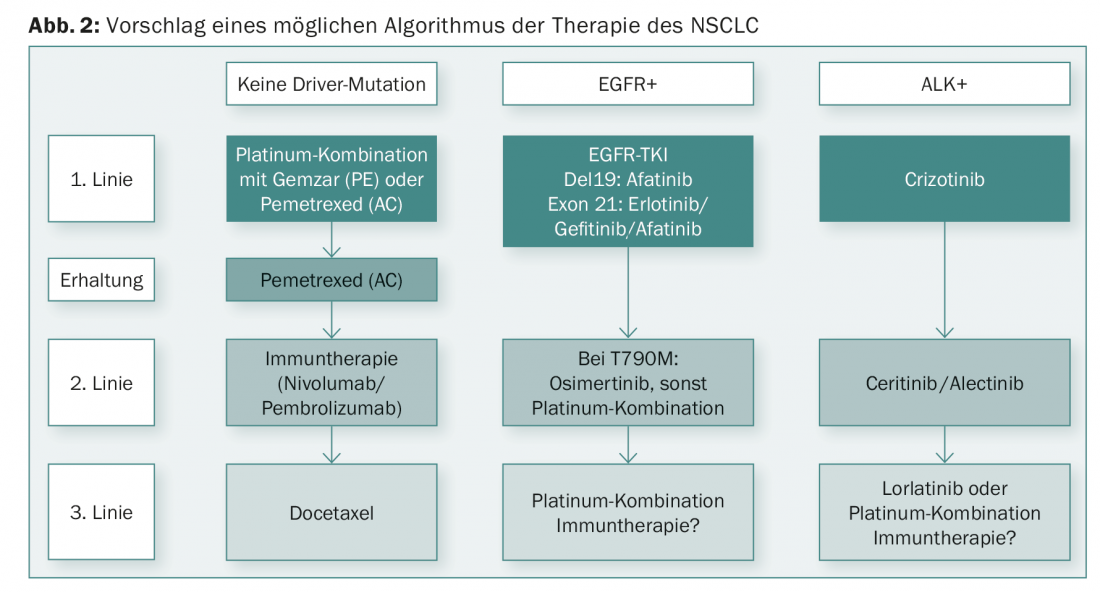
Los nuevos hallazgos de los últimos años han mejorado significativamente el pronóstico del CPNM. Los avances tanto en los TKI como en las inmunoterapias han sido rápidos. De los nuevos hallazgos puede derivarse un alograma terapéutico diferenciado (Fig. 2).
Literatura:
- Lozano R, et al: Mortalidad mundial y regional por 235 causas de muerte para 20 grupos de edad en 1990 y 2010: un análisis sistemático para el Estudio sobre la Carga Mundial de Morbilidad 2010. Lancet 2012; 380(9859): 2095-2128.
- Arndt V, et al: Informe suizo sobre el cáncer 2015: situación y evolución. Neuchatel: Oficina Federal de Estadística de Suiza; 2015.
- Morgensztern D, et al: Tendencias en la distribución por estadios de los pacientes con cáncer de pulmón de células no pequeñas: una encuesta de la Base Nacional de Datos sobre el Cáncer. J Thorac Oncol 2010; 5(1): 29-33.
- Leighl NB, et al: Pruebas moleculares para la selección de pacientes con cáncer de pulmón para los inhibidores de la tirosina quinasa del receptor del factor de crecimiento epidérmico y de la linfoma quinasa anaplásica. J Clin Oncol 2014; 32(32): 3673-3679.
- Vigneswaran J, et al: Las pruebas genéticas exhaustivas identifican alteraciones genómicas abordables en la mayoría de los pacientes con cáncer de pulmón de células no pequeñas, concretamente adenocarcinoma, investigación de un único instituto. Oncotarget 2016, Feb 26. doi: 10.18632/oncotarget.7739. [Epub ahead of print]
- Scagliotti GV, et al: Estudio de fase III que compara cisplatino más gemcitabina con cisplatino más pemetrexed en pacientes sin quimioterapia con cáncer de pulmón no microcítico en estadio avanzado. J Clin Oncol 2008; 26(21): 3543-3551.
- Rossi A, et al: Seis frente a menos ciclos planificados de quimioterapia de primera línea basada en platino para el cáncer de pulmón no microcítico: una revisión sistemática y metaanálisis de datos de pacientes individuales. Lancet Oncol 2014; 15(11): 1254-1262.
- Brodowicz T, et al: Quimioterapia de primera línea con cisplatino y gemcitabina seguida de gemcitabina de mantenimiento o los mejores cuidados de apoyo en el cáncer de pulmón no microcítico avanzado: un ensayo de fase III. Cáncer de pulmón 2006; 52(2): 155-163.
- de Castria TB, et al: Cisplatino frente a carboplatino en combinación con fármacos de tercera generación para el cáncer de pulmón no microcítico avanzado. Cochrane Database Syst Rev 2013; 8: CD009256.
- Scagliotti G, et al: Los análisis de interacción tratamiento-histología en tres ensayos de fase III muestran la superioridad del pemetrexed en el cáncer de pulmón no microcítico no escamoso. J Thorac Oncol 2011; 6(1): 64-70.
- Paz-Ares LG, et al: PARAMOUNT: Resultados finales de supervivencia global del estudio de fase III de pemetrexed de mantenimiento frente a placebo inmediatamente después del tratamiento de inducción con pemetrexed más cisplatino para el cáncer de pulmón no microcítico no escamoso avanzado. J Clin Oncol 2013; 31(23): 2895-2902.
- Cappuzzo F, et al: Erlotinib como tratamiento de mantenimiento en el cáncer de pulmón no microcítico avanzado: un estudio de fase 3 multicéntrico, aleatorizado y controlado con placebo. Lancet Oncol 2010; 11(6): 521-529.
- Fidias PM, et al: Estudio de fase III de docetaxel inmediato comparado con docetaxel diferido tras terapia de primera línea con gemcitabina más carboplatino en cáncer de pulmón no microcítico avanzado. J Clin Oncol 2009; 27(4): 591-598.
- Soria JC, et al: Revisión sistemática y metaanálisis de ensayos aleatorizados de fase II/III que añaden bevacizumab a la quimioterapia basada en platino como tratamiento de primera línea en pacientes con cáncer de pulmón no microcítico avanzado. Ann Oncol 2013; 24(1): 20-30.
- Quoix E, et al: Quimioterapia con doblete de carboplatino y paclitaxel semanal en comparación con la monoterapia en pacientes ancianos con cáncer de pulmón no microcítico avanzado: ensayo aleatorizado de fase 3 IFCT-0501. Lancet 2011; 378(9796): 1079-1088.
- Zukin M, et al: Ensayo aleatorizado de fase III de pemetrexed como agente único frente a carboplatino y pemetrexed en pacientes con cáncer de pulmón no microcítico avanzado y estado de rendimiento del Eastern Cooperative Oncology Group de 2. J Clin Oncol 2013; 31(23): 2849-2853.
- Yang JC, et al: Afatinib frente a quimioterapia basada en cisplatino para el adenocarcinoma de pulmón con mutación EGFR positiva (LUX-Lung 3 y LUX-Lung 6): análisis de los datos de supervivencia global de dos ensayos aleatorizados de fase 3. Lancet Oncol 2015; 16(2): 141-151.
- Janne PA, et al: AZD9291 en el cáncer de pulmón no microcítico resistente a los inhibidores del EGFR. N Engl J Med 2015; 372(18): 1689-1699.
- Niederst MJ, et al: El contexto alélico de la mutación C797S adquirida tras el tratamiento con inhibidores del EGFR de tercera generación influye en la sensibilidad a las estrategias de tratamiento posteriores. Clin Cancer Res 2015; 21(17): 3924-3933.
- Solomon BJ, et al: Crizotinib de primera línea frente a quimioterapia en cáncer de pulmón ALK-positivo. N Engl J Med 2014; 371(23): 2167-2177.
- Shaw AT, et al: Ceritinib en el cáncer de pulmón no microcítico con reordenamiento ALK. N Engl J Med 2014; 370(13): 1189-1197.
- Gadgeel SM, et al: Seguridad y actividad del alectinib contra la enfermedad sistémica y las metástasis cerebrales en pacientes con cáncer de pulmón no microcítico ALK resistente al crizotinib (AF-002JG): resultados de la parte de búsqueda de dosis de un estudio de fase 1/2. Lancet Oncol 2014; 15(10): 1119-1128.
- Shaw A, et al: Actividad clínica y seguridad de PF-06463922 de un estudio de escalada de dosis en pacientes con CPNM avanzado ALK+ o ROS1+. J Clin Oncol 2015; 33(suppl; abstr 8018).
- Shaw AT, et al: Crizotinib en el cáncer de pulmón no microcítico reordenado ROS1. N Engl J Med 2014; 371(21): 1963-1971.
- Ross Camidge D, et al: Eficacia y seguridad del crizotinib en pacientes con cáncer de pulmón no microcítico (CPNM) avanzado amplificado con c-MET. J Clin Oncol 2014; 32(5s, suppl; abstr 8001).
- Paik PK, et al: Respuesta al crizotinib y al cabozantinib en pacientes con adenocarcinoma de pulmón en estadio IV con mutaciones que causan la omisión del exón 14 de MET. J Clin Oncol 2015; 33(suppl; abstr 8021).
- Mazieres J, et al: Pacientes con cáncer de pulmón con mutaciones en HER2 tratados con quimioterapia y fármacos dirigidos a HER2: resultados de la cohorte europea EUHER2. Ann Oncol 2016; 27(2): 281-186.
- Peters S, et al: Respuesta dramática inducida por vemurafenib en un adenocarcinoma de pulmón con mutación BRAF V600E. J Clin Oncol 2013; 31(20): e341-344.
- Brahmer J, et al: Nivolumab frente a docetaxel en el cáncer de pulmón no microcítico de células escamosas avanzado. N Engl J Med 2015; 373(2): 123-135.
- Borghaei H, et al: Nivolumab frente a docetaxel en el cáncer de pulmón no microcítico no escamoso avanzado. N Engl J Med 2015; 373(17): 1627-1639.
- Boolell V, et al: La evolución de las terapias en el cáncer de pulmón de células no pequeñas. Cánceres (Basilea) 2015; 7(3): 1815-1846.
InFo ONcOLOGíA & HEMATOLOGíA 2016; 4(3): 6-10