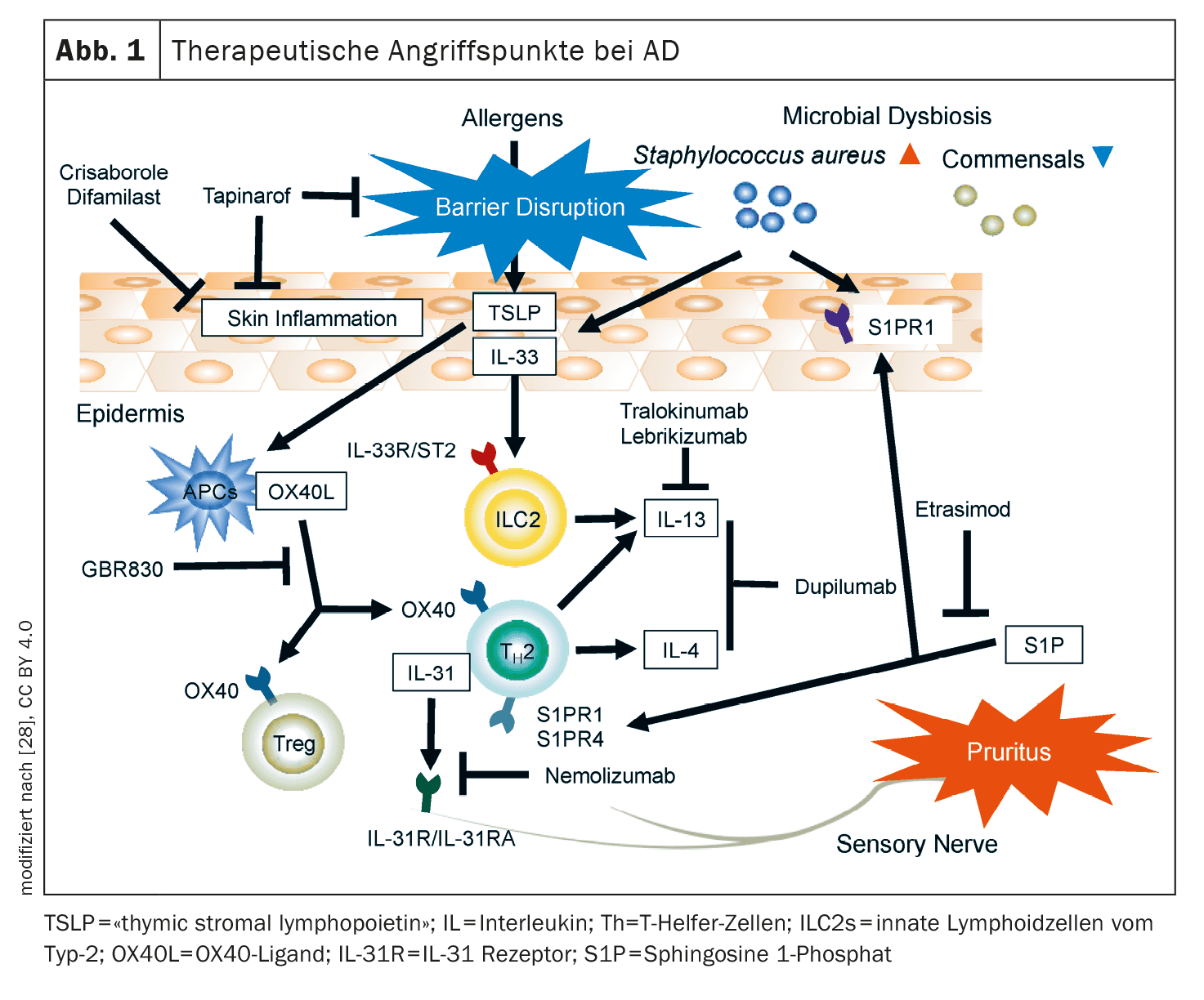
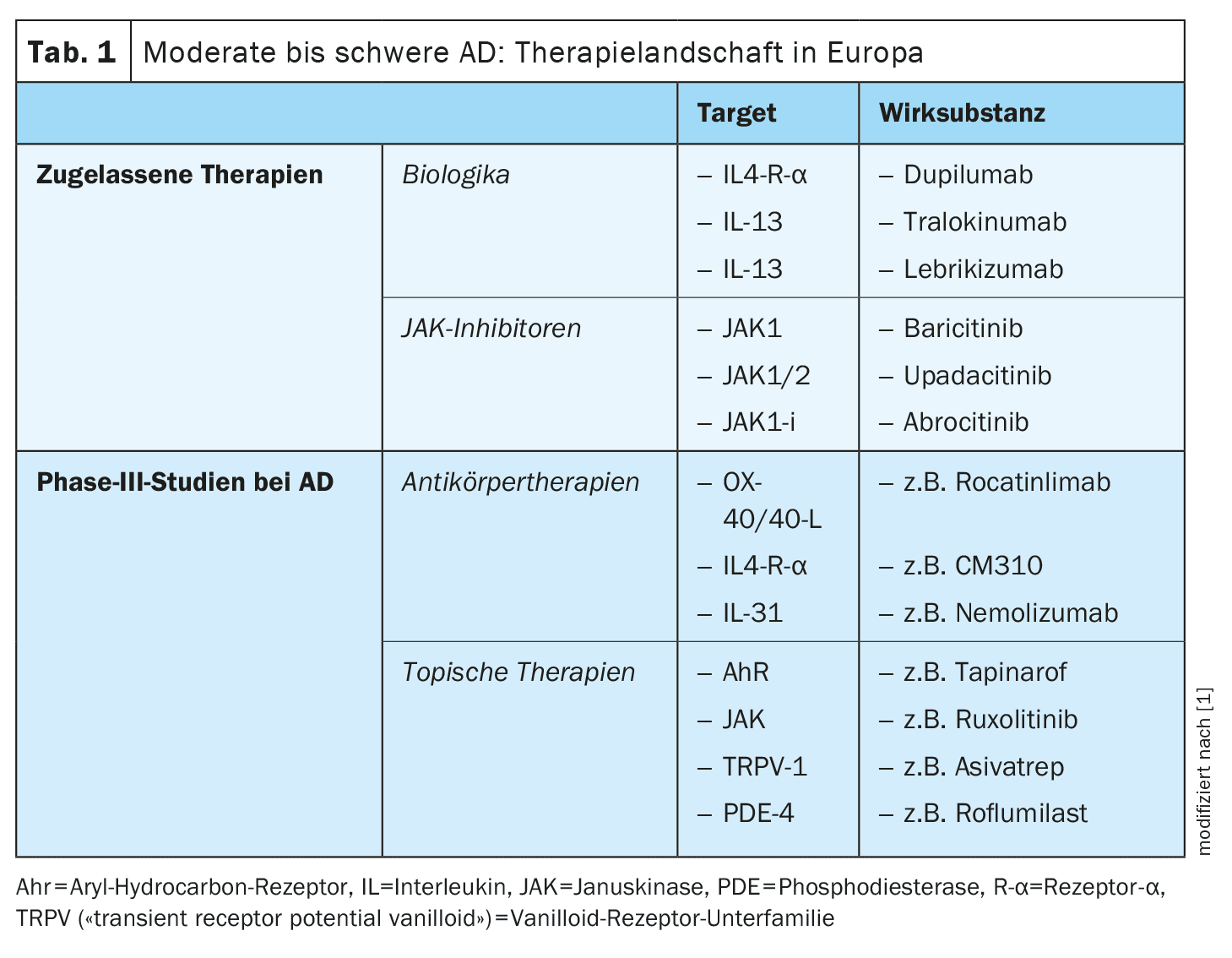
El arsenal de sustancias activas investigadas actualmente en el área de indicación de la dermatitis atópica (DA) es considerable. Además de los anticuerpos anti-OX40/OX40L, el CM310, el nemolizumab y los antagonistas del receptor 1 de la neuroquinina, también existen varias terapias antiinflamatorias tópicas, como el tapinarof, el ruxolitinib, el delgocitinib, el roflumilast, el difamilast y el asivatrep. Algunas de estas terapias innovadoras ya han sido autorizadas en algunos países.
Las opciones de tratamiento de la dermatitis atópica (DA) se han ampliado considerablemente en los últimos años, de modo que actualmente se dispone de una amplia gama de terapias tópicas y sistémicas eficaces y seguras. Las exigencias y expectativas de la terapia han aumentado: el objetivo no es sólo optimizar el perfil de riesgo-beneficio, sino también conseguir efectos del tratamiento lo más duraderos posible. Sin embargo, las “necesidades no cubiertas” también incluyen a ciertos subgrupos de pacientes que no responden adecuadamente a las opciones terapéuticas actualmente disponibles o no las toleran. Tampoco debe descuidarse el factor comodidad; el tratamiento debe ser lo más fácil posible de integrar en la vida cotidiana del paciente y ayudar a conseguir una mejora rápida y duradera de la calidad de vida. [1–3] Con el desarrollo de nuevos principios activos, dianas y formas de dosificación, se está intentando colmar estas lagunas en el tratamiento .
Nuevas terapias con anticuerpos inmunomoduladores
Entre las terapias con anticuerpos, el eje OX40/OX40L, la IL-31 y el receptor de neuroquinina-1 de las neuronas sensoriales son dianas prometedoras para la EA [1,2]. Además, se están investigando nuevos representantes de estructuras diana probadas, como el receptor IL-4-α (IL4R-α).
Eje OX40/OX40L: el OX40 se expresa en las células T de la piel lesional de la EA [4]. La unión del ligando OX40 a OX40 conduce a la diferenciación inmunitaria impulsada por T2, a la que se dirigen varios fármacos nuevos [5].
- El rocatinlimab (AMG451/KHK4083) es un anticuerpo anti-OX40L de administración subcutánea que se está investigando actualmente en ensayos de fase III en adultos con EA de moderada a grave. En un estudio de fase IIb, la dosis de 300 mg cada 2 semanas (q2w) resultó ser la más eficaz, con una reducción del EASI del 61% en la semana 16 [3]. Los acontecimientos adversos ( AA) más comunes, que se produjeron con mayor frecuencia que con el placebo, fueron pirexia (17%), nasofaringitis (14%) y escalofríos (11%) [6]. Los análisis del proteoma mostraron que los mediadores asociados a Th2/Th22 y al prurito disminuyeron con rocatinlimab en la semana 16, acompañados de una regulación a la baja de los genes asociados a Th2, Th1/17 y Th22 en la semana 52.
- Otros inhibidores de la OX-40: actualmente en fase de desarrollo para la EA son el GBR830 (anti-OX40), el telazorlimab (ISB830) y el amlitelimab (KY1005; anti-OX40L) [7].
IL-4Rα: Además del anticuerpo IgG4 dupilumab, ya aprobado, que se une a la IL-4Rα e inhibe así la vía de señalización de la IL-4 y la IL-13, actualmente se están desarrollando otros principios activos.
- CBP-201: Se trata de un inhibidor de la IL-4Rα que se está investigando actualmente en dos estudios de fase II (NCT04444752, NCT05017480) y ha obtenido resultados prometedores [8]. Con el CBP-201 se logró un cambio medio en las puntuaciones del EASI del -63,0% (cada 2 semanas, q2w) y del -65,4% (cada 4 semanas, q4w), en comparación con el -40,7% en el grupo placebo [8].
- CM310: Este anticuerpo anti-IL-4Rα se está investigando actualmente en estudios de fase II (NCT04805411) y de fase III (NCT05265923, NCT04893707) [8].
IL-31: Se ha demostrado que esta citocina es extremadamente importante en la patogénesis del prurito y los niveles séricos de IL-31 se correlacionan con la gravedad de la EA [9]. La IL-31 está implicada en la alteración de la barrera epidérmica típica de la EA y activa las neuronas pruriginosas, que liberan neuropéptidos que impulsan la inflamación local en la piel atrayendo a las células Th2.
La cadena α del receptor de la IL-31 (IL-31Rα) es una importante diana terapéutica antagonizada por el nemolizumab [10,11]. En EE.UU., este biológico está aprobado para el tratamiento del prurigo nodular y en Japón también para el prurito asociado a la EA en pacientes de edad ≥13 años [10,12].
- Nemolizumab: Con nemolizumab 60 mg (q4w) como complemento del tratamiento tópico estándar, el 66% consiguió una reducción del prurito y el 78% una reducción del EASI en la semana 68 [10]. Los EA más frecuentes fueron nasofaringitis (33,9%) y EA (25,2%) [11]. Actualmente se están llevando a cabo ensayos de fase III de nemolizumab y ensayos de fase II en niños (de 2 a 11 años) con EA de moderada a grave.
La sustancia P (SP) y el receptor de neuroquinina-1 (Nκ1R): Se sabe que estas taquiquininas están implicadas en la transmisión periférica y central del prurito independiente de la histamina y que los pacientes con EA presentan niveles elevados de SP en la piel lesional y el suero [13,14]. Las Nκ1R se localizan principalmente en el ganglio de la raíz dorsal y en el asta dorsal de la médula espinal.
- Todavía no está del todo claro si los antagonistas Nκ1R son eficaces en la EA, sobre todo porque el aprepitant con terapia tópica estándar concomitante no produjo una mejora significativa del prurito en la EA en una comparación con placebo. En cambio, el serlopitant redujo significativamente el prurito crónico en la NP [13,15]. Aún no se han publicado datos de estudios de fase III sobre el serlopitant y el tradipitant con respecto al prurito en la EA [14].
Nuevas sustancias tópicas para la terapia antiinflamatoria
Además de la terapéutica sistémica administrada por vía subcutánea y oral, las terapias antiinflamatorias tópicas también desempeñan un papel importante, sobre todo para los pacientes con EA con una superficie corporal (BSA) limitada del 10%. Actualmente se encuentran en una fase avanzada de desarrollo los agentes dirigidos contra los receptores JAK y TRPV (“vanilloide potencial receptor transitorio”) , así como los agonistas del receptor de hidrocarburos de arilo (AhR) [16].
Inhibidores tópicos de la JAK: En comparación con la aplicación sistémica de JAK-i, la aplicación tópica alberga muchos menos riesgos de efectos secundarios.
- Ruxolitinib: El ruxolitinib en crema inhibe la JAK1/2 y fue aprobado por la Administración de Alimentos y Medicamentos de EE.UU. (FDA) en 2021 para el tratamiento de la EA de leve a moderada en personas ≥12 años [17]. En el estudio pertinente para la aprobación, también se logró una buena eficacia en lo que respecta al prurito y la tolerabilidad también resultó buena. Se notificó nasofaringitis como el EA más frecuente [17].
- Delgocitinib: Este JAK-i tópico bloquea todas las moléculas JAK y fue aprobado para el tratamiento de la EA en Japón en 2020 . En un estudio de fase III, un tratamiento de cuatro semanas con crema de delgocitinib al 0,5% produjo una mejora de la inflamación local de alrededor del 45%. [19] Los efectos secundarios más frecuentes fueron foliculitis (2,4%), acné (2,2%) o irritación (1,8%) en el lugar de aplicación [18].
- Actualmente se están investigando otros JAK-i tópicos en ensayos clínicos: [20] Brepocitinib (IIb), ATI-1777, Jaktinib y SHR0302 (Fase II/III) .
AhR tópicos: Los receptores de hidrocarburos de arilo (AhR) se expresan en todas las células de la piel, incluidos los queratinocitos y las células dendríticas, pueden ser activados por numerosos metabolitos exógenos y endógenos y median en la diferenciación epidérmica [22].
- Tapinarof crema 1%: [23] Se trata de un agonista AhR que fue aprobado por la FDA en 2022 para el tratamiento de la psoriasis en placas . Tapinarof modula la expresión génica activando las vías de señalización AhR, lo que da lugar a una regulación a la baja de la inflamación de tipo 2 (IL-4, IL-13), normaliza la barrera cutánea y contribuye a reducir el estrés oxidativo. En un estudio de fase II aleatorizado, doble ciego, de 12 semanas de duración, los pacientes adolescentes y adultos con DA tratados con crema de tapinarof al 0,5% o al 1% frente a un preparado vehicular mostraron una buena mejoría de las lesiones eccematosas y el picor [24]. Los EA notificados fueron nasofaringitis, infecciones de las vías respiratorias superiores, empeoramiento de la DA y foliculitis [24]. Actualmente se están llevando a cabo estudios de fase III sobre tapinarof [22].
La fosfodiesterasa-4 (PDE4)-i tópica: crisaborol, difamilast y roflumilast inhiben la liberación de ciertas citoquinas implicadas en el proceso inflamatorio y se ha demostrado que mejoran la función de barrera de la piel [25–27]. La inhibición de la PDE-4 provoca un aumento del AMPc, lo que conduce a una regulación a la baja del NFκB, un importante modulador de la producción de citocinas (por ejemplo, IL-4, IL-5, IL-10).
- Crisaborol: Este inhibidor tópico de la PDE-4 ha sido autorizado en EE.UU. y la UE, pero hasta ahora sólo ha estado disponible en el mercado europeo de forma limitada.
- Roflumilast y difamilast: Estos representantes de los inhibidores tópicos de la PDE-4 están siendo investigados en la actualidad y pronto podrían estar disponibles para el tratamiento de la EA de leve a moderada [17,22].
Antagonistas tópicos del TRPV-1: El TRPV (“transient receptor potential vanilloid”)-1, es decir, una subfamilia de receptores vanilloides, se encuentra en los queratinocitos, las células dendríticas y las neuronas sensoriales y está sobreexpresado en la piel lesional de la EA. El TRPV-1 modula los procesos inflamatorios, así como el picor dependiente e independiente de la histamina, al desencadenar la liberación de neuropéptidos centrales como la sustancia P y el CGRP (péptido relacionado con el gen de la calcitonina).
- Asivatrep: Este antagonista selectivo del TRPV-1 produjo mejoras en las lesiones eccematosas y el prurito en un estudio aleatorizado de fase III controlado con vehículo en pacientes ≥12 años con EA de leve a moderada [21].
Literatura:
- Müller S, Maintz L, Bieber T: Treatment of atopic dermatitis: Recently approved drugs and advanced clinical development programs. Allergy 2024; 79(6): 1501–1515.
- Buhl T, Werfel T: [Atopische Dermatitis – Perspektiven und unerfüllte medizinische Bedarfe]. JDDG 2023; 21(4): 349–354.
- Lé AM, Torres T: OX40-OX40L Inhibition for the Treatment of Atopic Dermatitis-Focus on Rocatinlimab and Amlitelimab. Pharmaceutics 2022 Dec 8; 14(12): 2753.
- Nakagawa H, et al.: Safety, tolerability and efficacy of repeated intravenous infusions of KHK4083, a fully human anti-OX40 monoclonal antibody, in Japanese patients with moderate to severe atopic dermatitis. J Dermatol Sci 2020; 99: 82–89.
- Elsner JS, et al.: The OX40 Axis is associated with both systemic and local involvement in atopic dermatitis. Acta Derm Venereol 2020; 100: adv00099.
- Guttman-Yassky E, et al.: An anti-OX40 antibody to treat moderate-to-severe atopic dermatitis: a multicentre, double-blind, placebo-controlled phase 2b study. Lancet 2022; 401(10372): 204–214.
- Clinicaltrials, https://clinicaltrials.gov, estado 2022.
- Facheris P, et al.: The translational revolution in atopic dermatitis: the paradigm shift from pathogenesis to treatment. Cell Mol Immunol 2023; 20(5): 448–474.
- Datsi A, et al.: Interleukin-31: the «itchy» cytokine in inflammation and therapy. Allergy 2021; 76: 2982–2997.
- Kabashima K, et al.: Nemolizumab plus topical agents in patients with atopic dermatitis (AD) and moderate-to-severe pruritus provide improvement in pruritus and signs of AD for up to 68 weeks: results from two phase III, long-term studies. Br J Dermatol 2022; 186: 642–651.
- Kabashima K, et al.: Trial of Nemolizumab and topical agents for atopic dermatitis with pruritus. N Engl J Med 2020; 383: 141–150.
- Keam SJ: Nemolizumab: First Approval. Drugs. 2022; 82: 1143–1150.
- Ständer S, et al.: Serlopitant reduced pruritus in patients with prurigo nodularis in a phase 2, randomized, placebo-controlled trial. JAAD 2019; 80: 1395–1402.
- Welsh SE, et al.: Neurokinin-1 receptor antagonist tradipitant has mixed effects on itch in atopic dermatitis: results from EPIONE, a randomized clinical trial. JEADV 2021; 35: e338–e340.
- Yosipovitch G, et al.: Serlopitant for the treatment of chronic pruritus: results of a randomized, multicenter, placebo-controlled phase 2 clinical trial. JAAD 2018; 78: 882–891.e10.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Kleinman E, et al.: What’s new in topicals for atopic dermatitis. Am J Clin Dermatol 2022; 23: 595–603.
- Chovatiya R, Paller AS: JAK inhibitors in the treatment of atopic dermatitis. JACI 2021; 148: 927–940.
- Nakagawa H, et al.: Delgocitinib ointment, a topical Janus kinase inhibitor, in adult patients with moderate to severe atopic dermatitis: A phase 3, randomized, double-blind, vehicle-controlled study and an open-label, long-term extension study. JAAD 2020; 82(4): 823–831.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Park CW, et al.: Asivatrep, a TRPV1 antagonist, for the topical treatment of atopic dermatitis: phase 3, randomized, vehicle-controlled study (CAPTAIN-AD). JACI 2022; 149: 1340–1347.e4.
- Freitas E, Gooderham M, Torres T: New topical therapies in development for atopic dermatitis. Drugs 2022; 82: 843–853.
- Keam SJ: Tapinarof cream 1%: first approval. Drugs 2022; 82: 1221–1228.
- Paller AS, et al.: Efficacy and patient-reported outcomes from a phase 2b, randomized clinical trial of tapinarof cream for the treatment of adolescents and adults with atopic dermatitis. JAAD 2021; 84: 632–638.
- Zebda R, Paller AS. Phosphodiesterase 4 inhibitors. JAAD 2018; 78(3 Suppl 1): 43–S52,
doi: 10.1016/j.jaad.2017.11.056. - Schlessinger J, et al: Safety, effectiveness, and pharmacokinetics of Crisaborole in infants aged 3 to <24 months with mild-to-moderate atopic dermatitis: A phase IV open-label study (CrisADe CARE 1); Am J Clin Dermatol 2020; 21(2): 275–284.
- Saeki H, et al.: Difamilast ointment in adult patients with atopic dermatitis: a phase 3 randomized, double-blind, vehicle-controlled trial. JAAD 2022; 86(3): 607–614, doi: 10.1016/j.jaad.2021.10.027
- Yamamura K, Nakahara T: The Dawn of a New Era in Atopic Dermatitis Treatment. Journal of Clinical Medicine 2022; 11(20): 6145. www.mdpi.com/2077-0383/11/20/6145, (última consulta: 04.12.2024).
DERMATOLOGIE PRAXIS 2024; 34(6): 22–24