Los trastornos respiratorios relacionados con el sueño son frecuentes. La apnea obstructiva del sueño (AOS) tiene el carácter de una enfermedad muy extendida. La prevalencia de la apnea obstructiva del sueño no deja de aumentar en los países industrializados occidentales debido a la creciente prevalencia de la obesidad, el envejecimiento y el uso generalizado de métodos de diagnóstico. El 40% de la población padece apnea obstructiva del sueño con un Índice de Apnea Hipopnea (IAH) >5, donde el IAH describe la aparición de eventos respiratorios por hora de sueño.
Los trastornos respiratorios relacionados con el sueño son frecuentes. La apnea obstructiva del sueño (AOS) tiene el carácter de una enfermedad muy extendida. La prevalencia de la apnea obstructiva del sueño no deja de aumentar en los países industrializados occidentales debido a la creciente prevalencia de la obesidad, el envejecimiento y el uso generalizado de métodos de diagnóstico. El 40% de la población alemana padece apnea obstructiva del sueño con un índice de apnea hipopnea (IAH) >5, donde el IAH describe la aparición de eventos respiratorios por hora de sueño.
La enfermedad es más común en hombres y en personas mayores de 60 años. Según los informes, el síndrome de AOS, la combinación de AOS y somnolencia diurna concomitante, tiene una prevalencia del 5% de la población alemana (no se dispone de estudios actuales de Suiza) [1]. Los trastornos respiratorios relacionados con el sueño no tratados provocan complicaciones cardiovasculares, somnolencia diurna pronunciada y, por tanto, un mayor riesgo de accidentes. La función cognitiva de la persona afectada también puede verse afectada.
Los trastornos respiratorios del sueño se dividen en cuatro grandes grupos según el ICSD-3: SA obstructiva, SA central, hipoxemia relacionada con el sueño, hipoventilación relacionada con el sueño [2]. En la AOS se produce un colapso repetitivo de las vías respiratorias superiores. Debido a la disminución del tono muscular, se produce con mayor frecuencia en el sueño profundo y REM. Si se produce un colapso de las vías respiratorias superiores en forma de apnea, la persona afectada intenta luchar contra esta apnea con un mayor esfuerzo respiratorio. Este aumento del esfuerzo va seguido de una reacción de excitación nerviosa central, la llamada excitación. Si el enfermo consigue reabrir las vías respiratorias, se produce un fuerte ronquido irregular. La apnea central del sueño está causada por un trastorno en la regulación central de la respiración. La hipoxemia y la hipoventilación relacionadas con el sueño son el resultado de una reducción persistente de la actividad respiratoria. Todas ellas tienen en común la alteración de la arquitectura normal del sueño, es decir, el sueño se ve constantemente interrumpido por reacciones de despertador, la proporción de sueño profundo y REM disminuye, lo que da lugar a un sueño no reparador con el consiguiente cansancio o somnolencia diurnos.
Síntomas y diagnóstico
Las pausas respiratorias, los ronquidos y la somnolencia diurna se señalan como síntomas frecuentes de los trastornos respiratorios relacionados con el sueño; en este caso, es especialmente necesario obtener información de otros pacientes, ya que los afectados no suelen comunicar ninguna queja subjetiva. Las quejas de insomnio están indicadas por la fragmentación de la arquitectura del sueño. En los casos de apnea pronunciada, se describe un despertar con falta de aire. Pueden utilizarse cuestionarios para evaluar la somnolencia diurna resultante de los trastornos respiratorios del sueño (SAHS). La escala de somnolencia de Epworth se utiliza a menudo con este fin. Aquí se pregunta a los pacientes sobre la probabilidad de que se queden dormidos en ocho situaciones cotidianas típicas. Los resultados individuales se suman para obtener un valor total entre cero y 24. Un valor superior a diez se considera patológico. El examen clínico debe incluir una inspección de las vías respiratorias superiores. Deben examinarse la cavidad nasal, la nasofaringe, la cavidad oral y la faringe profunda y la laringe. En este contexto, la obstrucción anatómica en la zona de la cavidad oral, especialmente la hipertrofia de las amígdalas palatinas y la base de la lengua, desempeñan un papel especial en el desarrollo de los trastornos respiratorios del sueño en el sentido de AOS.
También debe evaluarse la posición del maxilar superior en relación con el inferior y el estado de los dientes. Tanto la poligrafía cardiorrespiratoria como la polisomnografía están disponibles como herramientas de diagnóstico. Como procedimiento de diagnóstico básico, la poligrafía se realiza inicialmente de forma ambulatoria, es decir, el paciente puede dormir con el sistema de diagnóstico en su entorno familiar en casa. El dispositivo PG es un aparato de medición portátil que mide o registra el flujo respiratorio nasal, las excursiones respiratorias del tórax y el abdomen, la frecuencia cardiaca, los ronquidos, la saturación de oxígeno y la posición del paciente. Los datos se registran continuamente durante al menos 6 horas y después se procesan o sincronizan con un programa informático para que el médico que le atienda pueda hacer una evaluación individual de toda la noche. Si no es posible diagnosticar un trastorno respiratorio del sueño durante una poligrafía cardiorrespiratoria ambulatoria, el paciente afectado debe ser remitido a un laboratorio del sueño para un diagnóstico más exhaustivo, en este caso una polisomnografía.
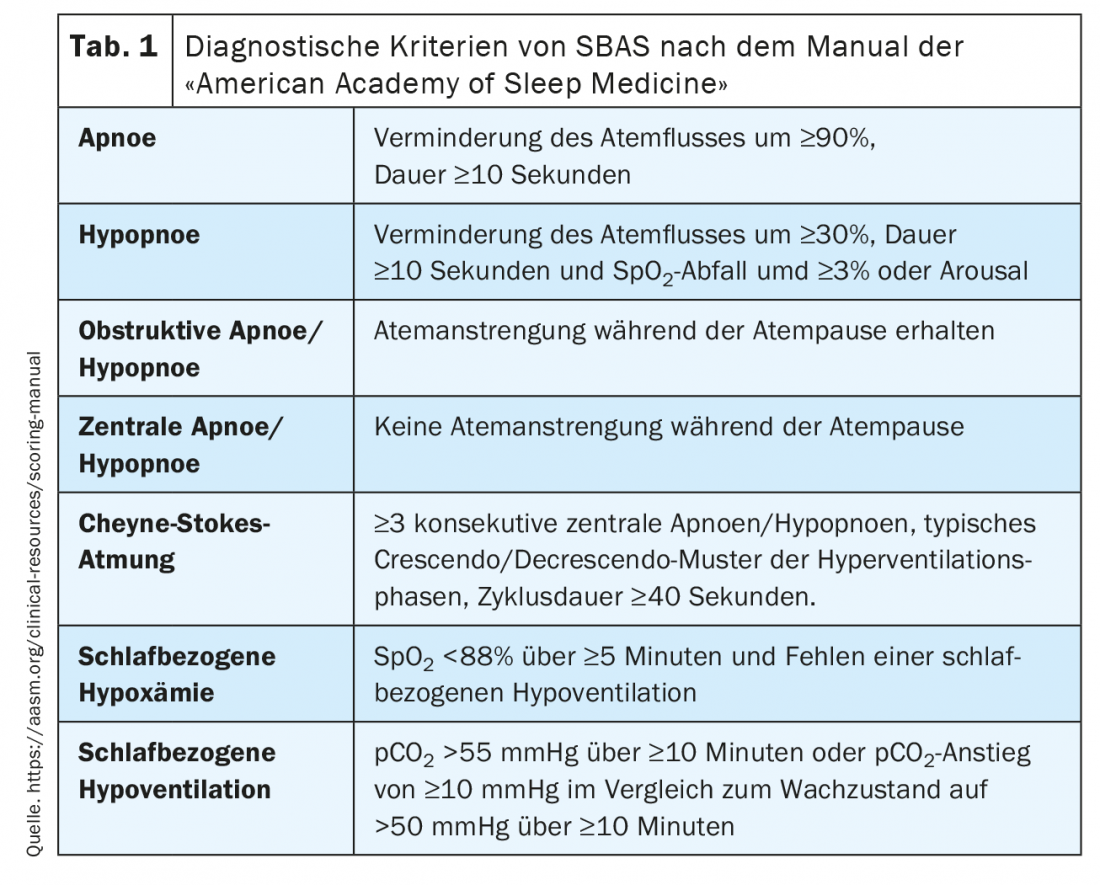
Los criterios diagnósticos del SBAS en el contexto del PG/PSG se definen según el manual de la Academia Americana de Medicina del Sueño [3] y se resumen en la Tabla 1 .
Apnea obstructiva del sueño
La AOS es el resultado de la obstrucción de las vías respiratorias superiores en la región (oro)faríngea posterior durante el sueño. Además de un paladar blando pronunciado con arcos palatinos profundos y una úvula posiblemente ensanchada y alargada, la hipertrofia de las amígdalas palatinas o la hipertrofia de la base de la lengua pueden ser la causa. Del mismo modo, se producen malposiciones mandibulares o factores no anatómicos como la debilidad del músculo geniogloso, que tiene una función dilatadora de la porción faríngea de las vías respiratorias superiores. El estrechamiento de las vías respiratorias se asocia con mayor frecuencia a la obesidad, con un mayor almacenamiento de grasa en las paredes laterales de la faringe. La obesidad es el principal factor de riesgo de la AOS junto con el aumento de la edad y el sexo masculino. En consecuencia, los pacientes con síndrome metabólico se ven afectados con especial frecuencia por la AOS [4]. El SAOS es la causa más común de hipertensión arterial secundaria e influye en el estado metabólico diabético al aumentar la resistencia a la insulina. La relación entre la hiperlipidemia y la AOS aún no se ha establecido de forma concluyente. En general, el riesgo cardiovascular aumenta en los pacientes con AOS no tratados [5].
Los pacientes con SAOS grave, en particular, desarrollan hipertensión arterial con no-dipping (falta de reducción de la presión arterial durante la noche). Incluso los pacientes que sólo presentan obstrucción de las vías respiratorias superiores en el sueño REM debido a la relajación muscular que allí se produce muestran la sintomatología de la hipertensión arterial (6). Existe una estrecha asociación de la AOS no tratada con las arritmias cardiacas, especialmente la fibrilación auricular [7], con enfermedades cardiacas como la cardiopatía coronaria y el infarto de miocardio [8], y con la aparición de ictus [9]. Si existe una somnolencia diurna excesiva debida a la AOS, también cabe suponer un mayor riesgo cardiovascular [10]. Debido a la posible aparición de somnolencia diurna hasta somnolencia diurna excesiva en el contexto de la AOS, el riesgo de accidente de los pacientes afectados es especialmente elevado, sobre todo si se ejercen profesiones con actividades de control y vigilancia. El médico no está obligado a informar de ello, pero es obligatorio informar a la persona afectada sobre esta circunstancia; la información facilitada debe documentarse por escrito y ser refrendada por el paciente.
La realización de una poligrafía cardiorrespiratoria permite determinar la gravedad de la AOS. Para ello, se determina el índice de apnea-hipopnea (IAH) de la persona afectada. El IAH incluye el número de apneas e hipopneas por hora de sueño. Los hallazgos leves corresponden a un IAH de 5-15, los moderados a un IAH de 15-30/h y los graves a un IAH superior a 30/h.
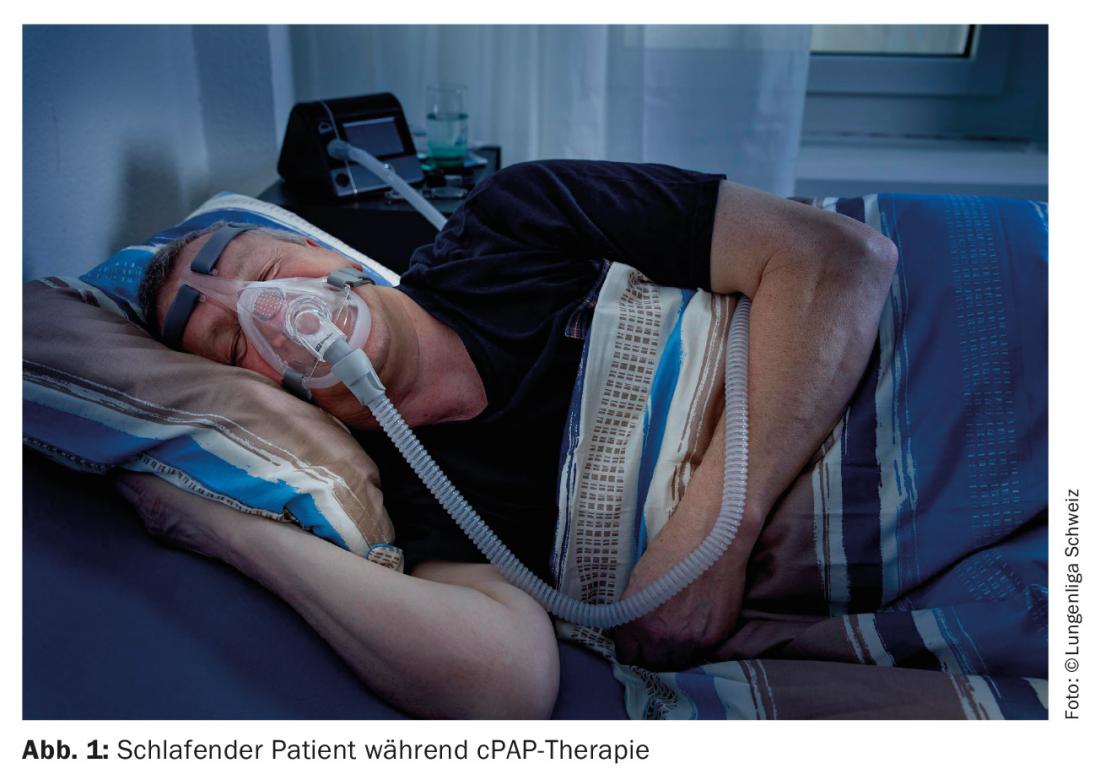
Terapia cPAP: El patrón oro de la terapia para la AOS es la ferulización neumática continua de las vías respiratorias superiores mediante presión positiva en las vías respiratorias, aplicada a través de una mascarilla nariz/boca/nariz (Fig. 1). El tratamiento más común es la terapia de presión positiva continua en las vías respiratorias (cPAP). La ferulización neumática elimina la obstrucción de las vías respiratorias superiores y, por tanto, idealmente, todas las apneas e hipopneas y, por tanto, también la hipoxia nocturna. Al eliminar los despertares inducidos por la hipoxia, se mejora la arquitectura del sueño y, por tanto, el descanso, lo que conlleva una reducción de la fatiga diurna que lo acompaña. Como efecto secundario, se eliminan significativamente los ronquidos, eliminando lo que a menudo el compañero de cama cita como socialmente molesto, lo que aumenta el cumplimiento de la terapia cPAP. Al mejorar la función endotelial [10] y reducir la presión arterial [11], se minimizan los factores de riesgo cardiovascular [12]. La terapia hiperbárica nocturna provoca efectos secundarios indeseables en bastantes pacientes.
A menudo se queja de sequedad de las mucosas de las vías respiratorias superiores por la mañana. Los humidificadores de aire caliente, que hoy en día están integrados de forma permanente en la mayoría de los dispositivos CPAP y pueden ser ajustados individualmente por el paciente, pueden aportar un remedio en este caso. Con la misma frecuencia, se describe obstrucción nasal durante la terapia, lo que no pocas veces lleva a interrumpirla por la noche. Debe comprobarse el ajuste de la mascarilla y cambiarla por otro modelo si es necesario. En ocasiones, puede ser útil reducir ligeramente la sobrepresión positiva del tratamiento, sobre todo para aliviar las vías respiratorias nasales. La reducción de la presión de la terapia debe controlarse al menos mediante poligrafía cardiorrespiratoria durante el curso de la terapia; no debe perjudicar significativamente la suficiencia del tratamiento.
Los pacientes afectados suelen utilizar por su cuenta congestivos nasales como gotas nasales o sprays que contienen xilometazolina para evitar que la nariz se hinche debido al aumento del flujo sanguíneo en el cornete inferior. Se sabe que se produce una habituación, que conduce gradualmente a una mayor frecuencia de uso de las gotas.
pulverizadores. Para no poner en peligro la terapia cPAP, debe considerarse definitivamente la posibilidad de aplicar medidas quirúrgicas en el cornete inferior. La conchotomía asistida por radiofrecuencia, la reducción del cornete inferior, hace que los tratamientos sean respetuosos con los tejidos y tengan un gran éxito. A pesar de la multitud de opciones para optimizar la terapia con cPAP, el cumplimiento del tratamiento a largo plazo es sólo del 60-70%. En este contexto, es útil vincular a los pacientes a grupos de autoayuda, que pueden mejorar significativamente la aceptación del tratamiento entre los afectados gracias al intercambio regular entre ellos.
Existen algunas alternativas a la terapia cPAP en el tratamiento de la AOS, pero su eficacia comparativa es reducida. Las más utilizadas son las férulas de avance mandibular (SAF), cuya comodidad ha mejorado considerablemente en los últimos años gracias al uso de nuevos materiales y métodos de ajuste. Al avanzar la mandíbula, se reduce la obstrucción orofaríngea, especialmente en la región de la base de la lengua. El requisito previo para la colocación de un SAI es un estado dental suficiente, una protrusión suficiente del maxilar inferior y la ausencia de enfermedades de la articulación temporomandibular. Debido a las mejoras técnicas del SAI en los últimos años, este tratamiento se considera ahora equivalente a la terapia cPAP para pacientes con SAOS de leve a moderada si se cumplen los requisitos anatómico-funcionales antes mencionados en la persona afectada.
En la AOS grave, el SAI sólo debe utilizarse tras el fracaso de la terapia inicial con cPAP. Los efectos secundarios típicos del tratamiento con SAI son molestias en la articulación de la mandíbula, por lo que se recomiendan revisiones dentales u ortodóncicas periódicas. En la AOS dependiente de la posición supina, a menudo en combinación con la AOS de grado leve, puede ser apropiado el uso de un chaleco de prevención supina. No es raro que a la gente le resulte incómodo llevar estas ayudas por la noche, por lo que el cumplimiento a largo plazo tiende a ser bajo. Las medidas quirúrgicas como alternativa a la terapia cPAP incluyen la uvulopalatofaringoplastia en combinación con la amigdalectomía bds. (TE-UPPP) [13], el avance maxilomandibular [14] y la estimulación del nervio hipogloso (HGNS). [15] se tienen en cuenta. La indicación de uno de estos procedimientos quirúrgicos requiere una selección precisa del paciente con respecto a la anatomía y la función de las vías respiratorias superiores. La indicación de la UPPP-TE requiere la presencia de hipertrofia de la amígdala palatina bds., que también se encuentra en la zona distal a nivel de la base de la lengua, así como un palmeo pronunciado, es decir, una bipedestación profunda del paladar blando con una úvula hipertrófica.
El procedimiento se caracteriza por un alto grado de invasividad; las posibles complicaciones no sólo surgen en el postoperatorio inmediato, sino que también pueden provocar molestias a largo plazo debido al profundo cambio en la estructura anatómica de la orofaringe. También puede observarse que el éxito terapéutico inicial disminuye con el tiempo, por lo que la UPPP-TE sólo debe realizarse tras una indicación muy estricta y una selección muy cuidadosa de los pacientes antes de la operación. En presencia de malposición mandibular en pacientes con SAOS, puede plantearse un avance maxilomandibular, mediante el cual se realiza una osteotomía del maxilar y la mandíbula para avanzarlos y eliminar así la obstrucción orofaríngea -especialmente del espacio posterior de las vías respiratorias- de forma muy eficaz.
En principio, los pacientes sin malposiciones esqueléticas del maxilar superior/inferior también son aptos para este procedimiento, pero en este caso también debe tenerse en cuenta la naturaleza altamente invasiva del procedimiento y la alteración externa de la región maxilomandibular de la cara. La HGNS es otra alternativa quirúrgica para el tratamiento de la AOS. El agregado de marcapasos se implanta de forma análoga a los marcapasos cardíacos conocidos, el electrodo de estimulación del nervio hipogloso se coloca en el extremo distal del nervio y otro electrodo para evaluar la respiración se inserta en un espacio intercostal. Como en los demás procedimientos quirúrgicos, es necesario un diagnóstico preoperatorio preciso. En particular, se recomienda un examen endoscópico de las vías respiratorias superiores durante el sueño inducido por fármacos para descartar una obstrucción concéntrica a nivel de la orofaringe.
Apnea central del sueño
La apnea central del sueño (AAC) es menos frecuente que la AOS y se caracteriza por una falta de esfuerzo respiratorio durante la pausa respiratoria, debido a una disfunción del impulso nervioso central que controla la respiración. Además de la aparición idiopática, la ZSA se produce en el contexto de patrones de enfermedades neurológicas debidas a lesiones del centro respiratorio situado en la médula oblonga. Los medicamentos depresores respiratorios, como el consumo de opiáceos, también pueden causar ZSA. Sin embargo, el subtipo más común es la respiración de Cheyne-Stokes, que se da hasta en la mitad de los pacientes con insuficiencia cardiaca sistólica grave [16]. Característicamente, se producen episodios de hiperventilación crescendo-decrescendo entre apneas centrales. Los factores de riesgo son el sexo masculino, la edad avanzada, la hipocapnia y la presencia de fibrilación auricular [17]. Debido a la hipoxia recurrente y a la consiguiente activación del sistema nervioso simpático, en los pacientes afectados se producen con frecuencia arritmias cardiacas malignas, que reducen en consecuencia la supervivencia global de este grupo de pacientes [18].
Además del tratamiento de la respectiva enfermedad subyacente, es posible un enfoque de tratamiento basado en aparatos, como en el tratamiento de la AOS. La terapia cPAP es menos eficaz que en la AOS, el tratamiento basado en aparatos puede ampliarse mediante el uso de dispositivos biPAP-ST, por los que estos dispositivos generan un nivel de presión diferente durante la inspiración y la espiración y se almacena una frecuencia respiratoria mínima; si no se alcanza esta frecuencia mínima, los dispositivos activan la siguiente respiración. La servoventilación adaptativa (ASV) es una forma especial utilizada en el tratamiento de la respiración Cheyne-Stokes. La ecocardiografía para determinar la fracción de eyección del ventrículo izquierdo (FEVI) es obligatoria antes de iniciar la ASV, ya que ésta sólo debe utilizarse en pacientes que tengan una FEVI >45% [19]. La estimulación frénica transvenosa [20] es otro procedimiento para tratar la ZSA. De forma análoga al HGNS, se implanta un marcapasos que estimula el nervio frénico mediante un electrodo; la respiración se detecta mediante otro electrodo en la vena ácigos.
Hipoxemia e hipoventilación relacionadas con el sueño
La hipoxemia y la hipoventilación relacionadas con el sueño se caracterizan por periodos prolongados de reducción ventilatoria durante el sueño, que se producen principalmente en las fases REM con desaturaciones prolongadas de oxígeno (hipoxemia SB) y una hipercapnia acompañante (hipoventilación SB) debida a una sobrecarga simultánea de la bomba respiratoria. Es típico el dolor de cabeza matutino debido a la hipercapnia, acompañado de mareos, problemas de concentración y fatiga diurna. Además de la EPOC, las enfermedades neuromusculares y las deformidades torácicas desempeñan un papel importante en el desarrollo de la enfermedad. Una forma especial es el síndrome de hipoventilación por obesidad (SHO), que se define por una hipercapnia de más de 45 mmg/Hg de pCO2 durante el día y un IMC superior a 30. Muchos pacientes presentan AOS concomitante.
Además del tratamiento de la enfermedad subyacente, el dispositivo más utilizado para el tratamiento es un dispositivo biPAP-ST. Si la causa es una EPOC clínicamente relevante, suele ser necesario un tratamiento con ventilación domiciliaria no invasiva (VNI) [21] y un tratamiento con oxígeno a largo plazo durante al menos 16 horas al día. Al igual que ocurre con el tratamiento de la AOS mediante CPAP, el éxito terapéutico a largo plazo de las opciones de tratamiento mencionadas se ve limitado por la falta de cumplimiento por parte de los pacientes.
Mensajes para llevarse a casa
- La apnea obstructiva del sueño (AOS), la apnea central del sueño (ACS) y la hipoxemia e hipoventilación relacionadas con el sueño pertenecen a los trastornos respiratorios relacionados con el sueño (TRS).
- Los ronquidos excesivos combinados con pausas respiratorias y la consiguiente somnolencia o sopor diurno son síntomas típicos del SAOS, que es el SBAS más frecuente.
- La insuficiencia cardíaca puede provocar un patrón respiratorio nocturno típico, la respiración de Cheyne-Stokes, que es una forma de ZSA.
- La hipoxemia y la hipoventilación relacionadas con el sueño se producen con insuficiencia respiratoria, agotamiento de la bomba respiratoria o deterioro de la función pulmonar.
- Además de la historia clínica y el examen clínico, la poligrafía cardiorrespiratoria o polisomnografía constituye el núcleo del diagnóstico.
Literatura:
- Fietze I, Laharnar N, Obst A, et al: Prevalence and association analysis of obstructive sleep apnea with gender and age differences – Results of SHIP Trend. J Sleep Res 2019; 28(5): e12770; doi: 10.1111/jsr12770; Epub 2018 oct 1.
- Stuck BA, Weeß HG: The new “International Classification of Sleep Disorders” – A critical appraisal of the diagnostic criteria for sleep-related breathing disorders. Somnología 2015; 19: 126-132.
- Rodenbeck A: Manual de la Academia Americana de Medicina del Sueño. Visión general de la actualización de la versión 2.0. Somnología 2013; 17: 122-130.
- Schulz R, Eisele HJ, Reichenberger F, Seeger W: Apnea obstructiva del sueño y síndrome metabólico. Neumología 2008; 62(2): 88-91.
- Schulz R, Eisele HJ, Weissmann N, Seeger W: Apnea obstructiva del sueño: un importante factor de riesgo cardiovascular. Deutsches Ärzteblatt 2006; 103: 775-781.
- Aurora RN, Crainiceanu C, Gottlieb DJ, et al: Apnea obstructiva del sueño durante el sueño REM y enfermedad cardiovascular. AM J Respir Crit Care Med 2018; 197(5): 653-660; doi: 10.1164/rccm.201706-1112OC.
- Gami AS, Pressman G, Caples SM et al: Asociación de fibrilación auricular y apnea obstructiva del sueño. Circulation 2004; 110(4): 364-367; doi: 10.1161/01.CIR.0000136587.68725.8E; Epub 2004 jul12.
- Gottlieb DJ, Yenokyan G, Newman AB, et al: Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure: the sleep heart health study. Circulation 2010; 122(4): 352-360; doi 10.1161/CIRCULATIONHA.109.901801; Epub 2010 Jul 12.
- Arzt M, Young T, Finn L, et al: Asociación de los trastornos respiratorios del sueño y la aparición de ictus. Am J Respir Crit Care Med 2005; 172(11): 1447-1451; doi: 10.1164/rccm.200505-7020C; Epub 2005 Sept 1.
- Mazzotti DR, Keenan BT, Lim DC, et al: Los subtipos de síntomas de la apnea obstructiva del sueño predicen la incidencia de resultados cardiovasculares. Am J Respir Crit Care Med 2019; 200(4): 493-506; doi: 10.1164/rccm.201808-1509OC.
- Becker HF, Jerrentrup A, Ploch T, et al: Efecto del tratamiento nasal con presión positiva continua en las vías respiratorias sobre la presión arterial en pacientes con apnea obstructiva del sueño. Circulation 2003; 107(1): 68-73; doi: 10.1161/01.cir.0000042706.47107.7a.
- McEvoy RD, Antic NA, Heeley E, et al: CPAP para la prevención de eventos cardiovasculares en la apnea obstructiva del sueño. N Engl J Med 2016; 375(10): 919-931; doi: 10.1056/NEJMoa1606599.
- Fujita S, Conway WA, Zorick F, Roth T: Corrección quirúrgica de las anomalías anatómicas en el síndrome de apnea obstructiva del sueño: uvulopalatofaringoplastia. Otolaryngol Head Neck Surg 1981; 89: 923-934.
- Hochban W, Brandenburg U, Peter JH.: Tratamiento quirúrgico de la apnea obstructiva del sueño mediante avance maxilomandibular. Sueño 1994; 17: 624-629.
- Strollo PJ Jr, Soose RJ, Maurer JT, et al: Estimulación de las vías respiratorias superiores para la apnea obstructiva del sueño. N Engl J Med 2014; 370(2): 139-149; doi: 10.1056/NEJMoa1308659.
- Schulz R, Blau A, Börgel J et al: Apnea del sueño en la insuficiencia cardiaca. Eur Respir J 2007; 29(6): 1201-1205; doi: 10.1183/09031036.00037106.
- Sin DD, Fitzgerald F, Parker JD, et al: Factores de riesgo de la apnea central y obstructiva del sueño en 450 hombres y mujeres con insuficiencia cardiaca congestiva. Am J Respir Crit Care Med 1999; 160(4): 1101-1106; doi: 10.1164/ajrccm.160.4.9903020.
- Hanly PJ, Zuberi-Khokhar NS: Mayor mortalidad asociada a la respiración Cheyne-Stokes en pacientes con insuficiencia cardiaca congestiva. Am J Respir Crit Care Med 1996; 153(1): 272-276; doi: 10.1164/ajrccm.153.1.8542128.
- Cowie MR, Woehrle H, Wegscheider K, et al: Servoventilación adaptativa para la apnea central del sueño en la insuficiencia cardiaca sistólica. N Engl J Med 2015; 373(12): 1095-1105; doi: 10.1056/NEJMoa1506459.
- Ponikowski P, Javaheri S, Michalkiewicz D, et al: Estimulación transvenosa del nervio frénico para el tratamiento de la apnea central del sueño en la insuficiencia cardiaca. Eur Heart J 2012; 33(7): 889-894; doi: 10.1093/eurheartj/ehr298.
- Köhnlein T, Windisch W, Köhler D, et al: Ventilación con presión positiva no invasiva para el tratamiento de la enfermedad pulmonar obstructiva crónica grave estable: un ensayo clínico prospectivo, multicéntrico, aleatorizado y controlado. Lancet Respir Med 2014; 2(9): 698-705; doi: 10.1016/S2213-2600(14)70153-5.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2021; 3(3): 11-15.