El carcinoma hepatocelular (CHC) es el tumor primario de células hepáticas más frecuente y, con su resistencia intrínseca a los agentes quimioterapéuticos clásicos, supone un reto en el tratamiento sistémico. El clínico responsable no debe limitarse a valorar la situación del tumor con un posible efecto terapéutico, sino que se requiere un cuidadoso equilibrio entre los beneficios del tratamiento y el riesgo de descompensación hepática.
El carcinoma hepatocelular (CHC) es el tumor primario de células hepáticas más frecuente y, con su resistencia intrínseca a los agentes quimioterapéuticos clásicos, representa un reto en el tratamiento sistémico [1]. Además de las opciones terapéuticas hasta ahora numéricamente limitadas en el tratamiento sistémico, la enfermedad hepática avanzada también es predominantemente decisiva para el pronóstico. No sólo influyen los factores de riesgo conocidos de la cirrosis hepática, como las hepatitis víricas VHB o VHC, sino también el alcohol. A veces el hígado graso, que va en aumento en nuestra región, así como el hígado graso no alcohólico (HGNA) no son sólo un factor de riesgo de CHC. Más bien, la reducción del rendimiento hepático asociada a ésta es también un factor pronóstico en el tratamiento del CHC [2]. Por lo tanto, el clínico responsable no sólo debe evaluar la situación del tumor con un posible efecto terapéutico, sino que se requiere un cuidadoso equilibrio entre los beneficios del tratamiento y el riesgo de descompensación hepática. Los tratamientos curativos se reservan para los estadios tempranos del CHC según la clasificación del cáncer de hígado de la Clínica de Barcelona (BCLC) para BCLC 0/A e incluyen la cirugía, las técnicas ablativas locales o el trasplante de hígado. El riesgo de recurrencia tras la cirugía o la ablación en el hígado previamente dañado es bastante elevado, del 65 al 85%, según los estudios, y es precisamente en esta situación en la que se están investigando actualmente diferentes opciones de tratamiento en estudios clínicamente controlados [3]. Para los pacientes con CHC “intermedio” o “avanzado”, la especificación terapéutica es paliativa. La radioembolización transarterial (TARE) es una aplicación que se utiliza a menudo para el estadio BCLC-B. También en este caso existe un alto riesgo de recidiva o de desarrollo de focos de CHC de novo en el hígado previamente dañado. Así pues, este campo terapéutico con buena función hepática preservada es también un campo de interés actual de los tratamientos sistémicos adyuvantes. Tras la muy limitada elección de opciones de sistemas para el CHC en BCLC-C durante mucho tiempo con los inhibidores multicinasa (MKI) sorafenib en primera línea [4] y regorafenib en segunda línea [5], los tratamientos para el CHC también se ampliaron en los últimos 3,5 años con terapias combinadas de anticuerpos vasculares más inhibidores de puntos de control inmunitarios (ICI) ([6,7]. Además, en el campo del CHC “avanzado” (CHCa), existe actualmente un vivo interés de estudio en nuevas combinaciones, a veces MKI más ICI. Estos resultados se esperan con impaciencia, ya que no sólo se están investigando estas combinaciones en el tratamiento de primera línea, sino que también se están utilizando algunas combinaciones terapéuticas tras una inmunoterapia previa. Ya a finales de 2021, se demostró en el Simposio virtual ESMO Asia una combinación de cabozantinib más atezolizumab en aHCC de primera línea con el ensayo COSMIC-312. A principios de 2022, se presentó un estudio positivo con una combinación ICI en el Simposio virtual ASCO GI con el estudio HIMALAYA. A continuación me gustaría presentar estos datos, así como las perspectivas de estudios posteriores sobre terapias combinadas, en una visión general simplificada.
Terapias combinadas en aHCC
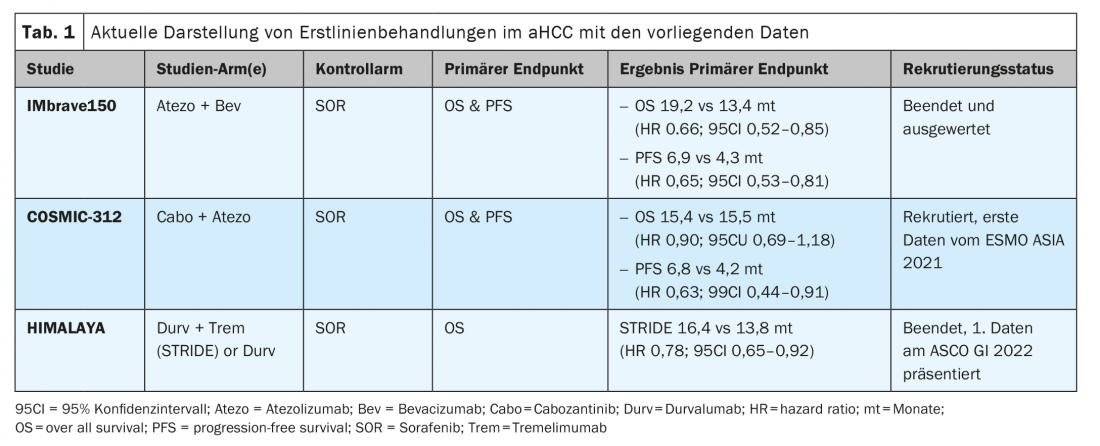
Estudio IMbrave 150 – más resultados a largo plazo a partir de ASCO 2021: Con el estudio IMbrave 150, se logró un nuevo estándar terapéutico mundial en el tratamiento de primera línea del CHCCa en estadio BCLC C, así como con el uso temprano en estadio BCLC B a partir de 2019. [7] Menos de un año después, el 16 de noviembre de 2020, SwissMedic también concedió la aprobación para esta combinación en el tratamiento de primera línea de atezolizumab más bevacizumab en Suiza. Esta combinación logró una mejora significativa de la mOS y la mPFS en comparación con el sorafenib. En la ASCO GI 2021 virtual se presentaron los datos actuales con intervalos de seguimiento más largos [8]. Los beneficios de supervivencia significativos preestablecidos en la mOS (19,2 frente a 13,4 meses; HR 0,66; p=0,0009) y también en la mPFS (6,9 frente a 4,3 meses; HR 0,65; p=0,0001) se confirmaron durante el periodo de observación más prolongado de más de 18 meses. También se ha conseguido una reducción de la tasa de mortalidad del 34% y un beneficio en la supervivencia global de 5,8 meses en comparación con el sorafenib, además de una mejora y estabilización de la calidad de vida [6,9].
Estudio COSMIC-312 – conclusiones de ESMO Asia 2021: Las nuevas e interesantes combinaciones consisten en inhibidores de la multicinasa (MKI) e inhibidores de los puntos de control (ICI). El sorafenib, el cabozantinib o el lenvatinib en combinación con inhibidores de la PD-1 se están evaluando actualmente en brazos de ensayo en aHCC. El ensayo COSMIC-312 (NCT03755791) se ha diseñado en 3 brazos para el tratamiento de primera línea del aHCC. Lo interesante aquí es que ya se pueden incluir las etapas BCLC-B. Un brazo de estudio con cabozantinib en monoterapia (Cabo) y otro brazo de estudio en la combinación de cabozantinib más atezolizumab (Cabo-Atezo) se están comparando frente al brazo estándar de sorafenib para el criterio de valoración dual de mOS y SLP. Los primeros resultados del estudio de 837 pacientes aleatorizados en el ensayo global se demostraron en ESMO Asia 2021 [10]. El grupo de Cabo-Atezo cumplió el criterio de valoración de SLP en comparación con el sorafenib, pero no hubo diferencias en la supervivencia global en los dos brazos con idéntica curva de progresión (tabla 1) . Los datos de SLP de Cabo Mono también fueron significativamente superiores a los de sorafenib, pero aún no se han demostrado los datos de SG. Curiosamente, el CHC asociado a la hepatitis B (VHB) se beneficia especialmente de la combinación Cabo-Atezo, con una SLP HR de 0,49 (IC 95%: 0,29-0,73). Este subgrupo VHB obtuvo un beneficio en la SG con un CRI de 0,53 (IC del 95%: 0,33-0,87). La afectación extrahepática (EHD) y la invasión macrovascular (MVI) también indicaron un beneficio en la SLP para la terapia combinada Cabo-Atezo en el análisis de subgrupos (HR 0,57; IC del 95%: 0,41-0,78). Por el contrario, el CHC no asociado a virus y/o el CHC asociado a la hepatitis C (VHC) no parecen beneficiarse de la combinación. En concreto, los asiáticos se beneficiaron más de la combinación que los pacientes de CHC no asiáticos, por lo que sigue sin estar claro si la infección por VHB o la etnia son factores de confusión en el análisis. Los autores concluyeron con cautela que la combinación representa una nueva opción en el tratamiento del CHC. No obstante, habrá que esperar a los análisis definitivos.
ORIENT-32 – Datos de ESMO 20 21: En ESMO 2021, se demostraron los resultados del ensayo ORIENT-32, otra combinación con sintilimab (Sin) y bevacizumab (Bev) frente a sorafenib [11]. En la población sólo china, la combinación Sin + Bev mostró beneficios significativos del tratamiento en términos de SG (NR frente a 10,4 meses) y SLPm (4,6 frente a 2,8 meses). Las tasas de efectos secundarios de IMbrave y ORIENT-32 fueron menores en comparación con sorafenib y fueron coherentes con el perfil típico de efectos secundarios de aVGFR e IO.
Estudio HIMALAYA – combinación de inhibidores de los puntos de control inmunitarios en el CHCCa de primera línea: Las terapias combinadas con ICI también se están estudiando de forma más intensiva en el CHCCa. Por ejemplo, la combinación de nivolumab más tremelimumab (Trem) en el CHCa tras una terapia previa con sorafenib ya fue aprobada por la FDA en 2019. Otra combinación de ICI aprobada por la FDA desde enero de 2021 es devaruzumab más tremelimumab. Ambas combinaciones son aplicables en la terapia de segunda línea, pero no cuentan con el apoyo de la EMA ni de Swissmedic. Ahora, el ensayo HIMALAYA (NCT03298451) se presentó recientemente en ASCO GI 2022 con datos iniciales. El estudio, ahora de 3 brazos, con el brazo STRIDE (tremelimumab más durvalumab) o durvalumab mono (Durv) se comparó con el sorafenib como brazo estándar. El criterio de valoración primario, la SG, fue significativamente superior en el brazo STRIDE, con 16,4 meses, en comparación con el brazo de sorafenib, también muy bueno, con 13,8 meses (HR 0,78; p=0,0035). No hubo diferencias en la SLP, pero sí una impresionante mediana de la DoR (duración de la respuesta) de 22,34 meses y un 65,8% de la población de pacientes con una respuesta Trem+Durv en el punto temporal de 12 meses. Estos resultados son muy interesantes para la combinación de inhibidores de puntos de control y, en los análisis de subgrupos realizados hasta ahora, casi todos los grupos se mostraron a favor de utilizar esta combinación. La gran discusión sobre la población adecuada en comparación con el nuevo SoC (estándar de cuidados) atezolizumab más bevacizumab está dada y no es fácil de responder. En mi opinión, no existen biomarcadores claros para la selección o asignación a una de las dos combinaciones.
Estudios actualmente en reclutamiento y previstos en un futuro próximo
CheckMate 9DW: Este ensayo de fase 3, NCT04039607, compara la combinación de nivolumab (Nivo) más ipilimumab (Ipi) frente a sorafenib en el contexto de primera línea en los estadios BCLC-B y BCLC-C de 728 aHCC planificados. El criterio de valoración primario es la SG y el ensayo está actualmente abierto pero sin reclutamiento debido a la pandemia COVID 19 (a 28 de enero de 2022 clinicaltrials.gov).
LEAP-002: Este ensayo de fase 3 (NCT03713593) está comparando el lenvatinib SoC frente a la combinación lenvatinib más pembrolizumab. Como resultado primario, se comparará la SLP así como la SG de ambos grupos. Este estudio también está activo, pero actualmente no se está llevando a cabo ningún reclutamiento (a 28 de diciembre de 2021 clinicaltrials.gov).
Estudios adyuvantes de reclutamiento
En la actualidad no sólo se investiga intensamente el efecto de las inmunoterapias en el campo del aHCC, sino también en los estadios locales tras la cirugía o la ablación. En cada caso se utiliza una terapia placebo como grupo de control. El pembrolizumab se está investigando como monoterapia en el estudio Keynote-937 (NCT03867084), el toripalimab en el estudio JUPITER-04 (NCT03859128) o el nivolumab en el CheckMate 9Dx (NCT03383458) como terapia adyuvante. El ensayo EMERALD-2 (NCT03847428) se centra en el durvalumab o la combinación de durvalumab más bevacizumab en la configuración adyuvante. El ensayo ImBrave050 (NCT04102098) también está investigando la combinación de atezolizumab más bevacizumab en pacientes con CHC de alto riesgo frente a placebo tras cirugía o ablación. Estos resultados se esperan con impaciencia en general, ya que los resultados positivos de los estudios desplazan el uso de la ICI a una línea temprana. Así pues, en el futuro, no sólo la expansión de la ICI con distintas combinaciones en el aHCC dará lugar a una intensificación del debate sobre su colocación en las directrices, sino también la secuencia en caso de recidiva tras la cirugía o la ablación, si se utilizó la ICI en este caso.
Perspectivas y “necesidades insatisfechas
Los ensayos presentados se esperan con impaciencia en los estadios local y localmente avanzado BCLC-B del CHC y, si se cumplen los criterios de valoración, establecerán un nuevo estándar de tratamiento. También en el aHCC con estadios BCLC B o C se esperan actualmente muchas perspectivas de estudio con señales positivas. Así, podemos esperar una variedad de nuevas combinaciones terapéuticas en un futuro próximo. Además de esta perspectiva positiva, también existen cuestiones directas e indirectas con requisitos actualmente (aún) sin resolver. Esto se refiere, por una parte, a la secuencia terapéutica óptima de un paciente con CHC y, por otra, a la cuestión de las diferentes terapias en función de la hepatopatía subyacente. Por el contrario, la cuestión de los biomarcadores adecuados para el pronóstico y la predicción sigue sin resolverse satisfactoriamente y es también un punto de vista de las preguntas de investigación actuales. En particular, el análisis de la resistencia instrínseca o adquirida a la terapia ICI (inhibición del punto de control inmunitario) desempeña un papel central. Para la aplicación clínica, la seguridad y la eficacia de las terapias en los pacientes con CHILD-Pugh B, así como en los pacientes postrasplante, también desempeñan un papel importante, ya que esto no se incluyó en los estudios anteriores. De estas cuestiones abiertas surge la necesidad de desarrollar y definir puntuaciones clínicas y diagnósticas para seleccionar a los pacientes óptimos para la mejor terapia combinada posible.
Mensajes para llevarse a casa
- El campo de tratamiento dentro del CHC estadio C del BCLC se ha ampliado enormemente, incluyendo una combinación de atezolizumab más bevacizumab aprobada actualmente en Suiza.
- La función hepática y una buena puntuación Child-Pugh son cruciales para el uso de terapias sistémicas en el CHC.
- Los pacientes con CHC deben ser evaluados conjuntamente por un hepatólogo y un oncólogo médico en una fase temprana, de modo que también se evalúe la función hepática para una terapia sistémica.
- El campo del tratamiento del CHC también se está ampliando en las primeras fases del BCLC. Si es posible, los pacientes deben ser incluidos en los estudios.
Literatura:
- Fulgenzi CAM, et al; Inmunoterapia en el carcinoma hepatocelular. Curr Treat Options Oncol 2021, 22(10): 87.
- Galati G, et al.: Opciones terapéuticas actuales para el CHC: de la farmacocinética a la eficacia y los efectos adversos en la cirrosis hepática. Curr Drug Metab 2020, 21(11): 866-884.
- Llovet JM, et al: Terapias locorregionales en la era de los tratamientos moleculares e inmunológicos para el carcinoma hepatocelular. Nat Rev Gastroenterol Hepatol 2021, 18(5): 293-313.
- Llovet JM, et al: Sorafenib en el carcinoma hepatocelular avanzado. N Engl J Med 2008, 359(4): 378-390.
- Bruix J, et al: Regorafenib para pacientes con carcinoma hepatocelular que progresaron con el tratamiento con sorafenib (RESORCE): un ensayo aleatorizado, doble ciego, controlado con placebo, de fase 3. Lancet 2017, 389(10064): 56-66.
- Casak SJ, et al: Resumen de la aprobación de la FDA: Atezolizumab más bevacizumab para el tratamiento de pacientes con carcinoma hepatocelular avanzado irresecable o metastásico. Clin Cancer Res 2021. 27(7): 1836-1841.
- Finn RS, et al: Atezolizumab más bevacizumab en el carcinoma hepatocelular irresecable. N Engl J Med 2020, 382(20): 1894-1905.
- Finn R, QS, Ikeda M, et al.: IMbrave150: datos actualizados de supervivencia global de un estudio global, aleatorizado y abierto de fase III de atezolizumab + bevacizumab frente a sorafenib en pacientes con carcinoma hepatocelular irresecable. Revista de Oncología Clínica 39, nº 3_suppl (20 de enero de 2021) 267-267, 2021.
- Gordan JD, et al: Terapia sistémica para el carcinoma hepatocelular avanzado: Directriz de la ASCO. J Clin Oncol 2020, 38(36): 4317-4345.
- Kelley RK, et al: VP10-2021: Cabozantinib (C) más atezolizumab (A) frente a sorafenib (S) como tratamiento sistémico de primera línea para el carcinoma hepatocelular avanzado (aHCC): Resultados del ensayo aleatorizado de fase III COSMIC-312. Anales de Oncología 2021 RESUMEN PLENARIO VIRTUAL ESMO VOLUMEN 33, NÚMERO 1, P114-116.
- Ren Z, et al: Sintilimab más un biosimilar de bevacizumab (IBI305) frente a sorafenib en el carcinoma hepatocelular irresecable (ORIENT-32): un estudio aleatorizado, abierto, de fase 2-3. Lancet Oncol 2021, 22(7): 977-990.
InFo ONcOLOGíA & HEMATOLOGíA 2022; 10(2): 6-8











