Les crises symptomatiques aiguës après un AVC ne nécessitent généralement pas de traitement à long terme et le délai actuellement recommandé dans les lignes directrices pour distinguer l’épilepsie après un AVC est de 7 jours. Pour évaluer plus précisément le risque de récurrence des crises d’épilepsie après un AVC, des outils validés, tels que le modèle SeLECT, ont été développés et sont disponibles sous forme numérique pour une utilisation au chevet du patient.
Vous pouvez passer le test de FMC sur notre plateforme d’apprentissage après avoir consulté le matériel recommandé. Pour ce faire, veuillez cliquer sur le bouton suivant :
En Europe, une personne sur 20 est victime d’une crise d’épilepsie au cours de sa vie. Les crises d’épilepsie sont donc l’une des maladies neurologiques les plus courantes. Les premières crises sont particulièrement fréquentes chez les nourrissons et les enfants, tandis que l’on observe un plateau d’incidence chez les jeunes adultes. Cependant, les crises d’épilepsie sont encore plus fréquentes après l’âge de 55 ans et leur incidence ne cesse d’augmenter. Cela s’explique par le vieillissement du cerveau et l’accumulation de diverses maladies cérébrales.
L’accident vasculaire cérébral est la cause la plus fréquente d’épilepsie avec une première manifestation à l’âge adulte en Europe. Chez les plus de 65 ans, la moitié des épilepsies sont dues à des maladies cérébrovasculaires. Les crises après un accident vasculaire cérébral ne sont pas seulement fréquentes, elles sont également pertinentes. Elles sont associées à une mortalité plus élevée, à un handicap et à un risque de déficits cognitifs supplémentaires [1].
Approche pratique
Si un événement suspect survient après un accident vasculaire cérébral, trois questions doivent être abordées en premier lieu :
- S’agit-il d’une crise d’épilepsie ?
- Existe-t-il une épilepsie ?
- Quel est le traitement adéquat dans cette situation ?
1. s’agit-il d’une crise d’épilepsie ?
Les principaux diagnostics différentiels (mimiques) des crises d’épilepsie dans ce groupe d’âge sont les accidents ischémiques transitoires (AIT), les épisodes neurologiques focaux transitoires d’angiopathie amyloïde (TFNE, également appelés spells amyloïdes ), les syncopes et autres phénomènes autonomes. Les crises fonctionnelles ou dissociatives et les migraines sont moins fréquentes dans ce groupe d’âge.
Les crises d’épilepsie sont généralement de courts épisodes d’environ 30 secondes à 2 minutes, souvent accompagnés de symptômes positifs tels que des auras visuelles, des paresthésies de fourmillements, des myoclonies ou d’autres phénomènes moteurs. En revanche, dans les AIT et les TFNE, ce sont les déficits neurologiques, tels que la parésie, la perte du champ visuel ou les troubles du langage, qui sont au premier plan. Les troubles de la conscience sont typiques des crises d’épilepsie, mais sont rarement présents dans les diagnostics différentiels mentionnés. Une durée supérieure à 15 minutes n’est pas caractéristique des crises d’épilepsie et évoque plutôt des AIT, des TFNE ou d’autres maladies neurologiques, telles qu’une aura migraineuse.
Il convient toutefois de noter que les crises d’épilepsie chez les personnes âgées sont souvent oligosymptomatiques. Une manifestation typique est une crise focale non consciente, caractérisée par un arrêt et un regard fixe. Une telle crise peut facilement passer inaperçue et nécessite une observation minutieuse ainsi qu’une approche ciblée de la personne concernée pendant la crise. Elle est souvent suivie de troubles post-traumatiques tels que la confusion.
La délimitation diagnostique est généralement basée sur une anamnèse approfondie et une observation par un tiers, mais elle est souvent difficile. La détection de modifications typiques de l’épilepsie dans l’EEG interictal, l’enregistrement d’un EEG vidéo ictal et la délimitation des diagnostics différentiels par l’imagerie par résonance magnétique peuvent être utiles. La sensibilité d’un bref EEG interictal de routine pour la détection de potentiels typiques de l’épilepsie n’est que de 20 à 30 % et ne suffit pas à exclure une épilepsie en cas de résultats négatifs. La sensibilité peut être augmentée jusqu’à 70% par un enregistrement précoce, des EEG répétés et la réalisation d’un EEG de longue durée pendant la nuit.
2. existe-t-il une épilepsie ?
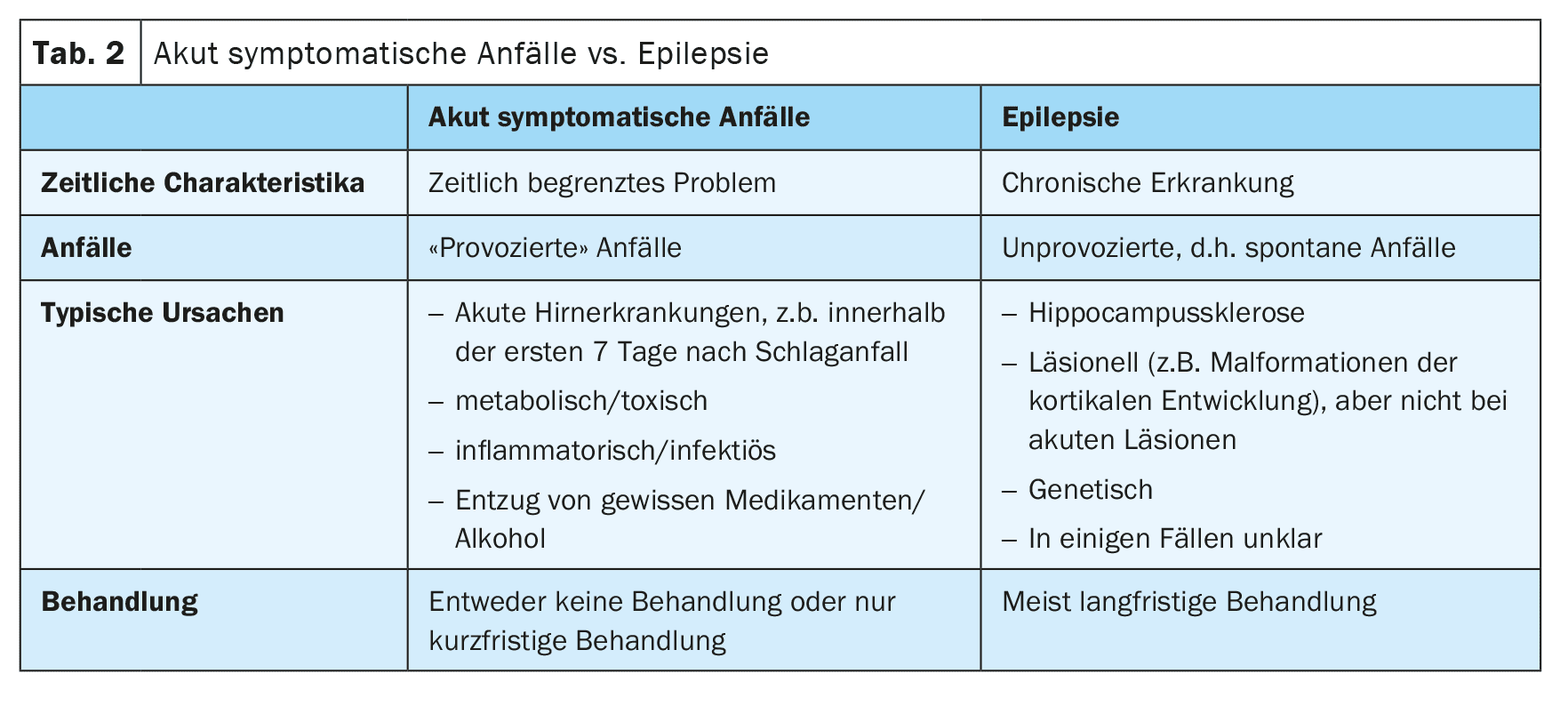
S’il est clair qu’il s’agit d’une crise d’épilepsie, il faut déterminer s’il s’agit d’une crise provoquée ou non provoquée (tableau 1). Le principe suivant s’applique : “Tout le monde avec une épilepsie a des crises, mais tout le monde avec des crises n’a pas une épilepsie”.
Dans le cas des crises provoquées, nous parlons aujourd’hui de “crises symptomatiques aiguës” [2]. Celles-ci surviennent dans un contexte temporel étroit avec une maladie cérébrale ou un trouble métabolique, toxique ou inflammatoire. Les crises d’épilepsie qui surviennent dans les 7 jours suivant un AVC sont considérées comme symptomatiques aiguës. Cela s’explique par le fait que ces crises sont déclenchées par des changements toxiques et inflammatoires aigus dans le cadre de l’AVC et ne sont pas l’expression d’une épilepsie sous-jacente. En conséquence, le risque de crises ultérieures non provoquées est plutôt faible. Cependant, la limite de 7 jours n’est pas bien établie et des données récentes, non encore publiées, indiquent que les crises survenant au cours du premier mois sont également associées à un faible risque de crises ultérieures non provoquées et pourraient donc également être considérées comme symptomatiques aiguës (tableau 2).
En revanche, les crises qui surviennent plus tard après un AVC sont considérées comme non provoquées si elles ne sont pas déclenchées par d’autres facteurs, tels que l’hyponatrémie. Si une crise non provoquée est supposée avoir été causée par l’AVC sous-jacent, c’est-à-dire qu’elle présente une sémiologie appropriée, on peut s’attendre à un risque élevé de récidive, supérieur à 60%, de nouvelles crises non provoquées au cours des 10 années suivantes. C’est pourquoi les directives actuelles permettent de poser le diagnostic d’épilepsie structurelle dès la première crise d’épilepsie non provoquée après un AVC [3].
3. quel est le traitement adéquat dans cette situation ?
La distinction entre les crises symptomatiques aiguës et l’épilepsie structurelle est cruciale, car les approches thérapeutiques sont très différentes. Une présentation détaillée du traitement de ces deux entités sera faite plus loin dans cet article.
En résumé, les lignes directrices ne recommandent aucun traitement ou seulement un traitement à court terme pour les crises symptomatiques aiguës, alors que l’épilepsie nécessite généralement un traitement à long terme (figure 1) [4]. Si un traitement est initié après une crise symptomatique aiguë, il doit être relativement agressif et utiliser un produit à action rapide. Cela s’explique par le fait que le risque de crises est le plus élevé dans les premiers jours suivant un AVC et qu’il diminue ensuite rapidement. En revanche, le traitement de l’épilepsie chez les personnes âgées se fait selon le principe start low, go slow, car avec l’âge, la clairance des antiépileptiques (ASM) est réduite.
Risques après une crise symptomatique aiguë
Environ 40% à 50% des premières crises d’épilepsie sont symptomatiques aiguës. Les maladies cérébrovasculaires sont l’une des causes les plus fréquentes de crises aiguës symptomatiques, en particulier chez les personnes âgées. Les crises sont particulièrement fréquentes chez les patients traités en unités de soins intensifs à la suite d’un accident vasculaire cérébral, et environ 20 à 30% de ces patients subissent des crises. Cependant, nombre de ces crises sont non convulsives, ne présentent que des symptômes mineurs ou sont complètement subcliniques.
Si un monitoring EEG continu est effectué, davantage de crises peuvent être détectées. Dans une étude prospective menée après une hémorragie intracérébrale, des crises subcliniques ont été détectées chez près de la moitié des patients [5]. Il n’est pas clair si les crises subcliniques ont une signification similaire à celle des crises cliniques. Cependant, il existe des preuves que les crises subcliniques sont associées à un risque aussi élevé de développement ultérieur de l’épilepsie et à un mauvais résultat que les crises cliniques. Par conséquent, le traitement des crises subcliniques devrait probablement être similaire au traitement des crises cliniques.
Risque de développer une épilepsie : les crises symptomatiques aiguës ne sont pas synonymes d’épilepsie, car elles sont déclenchées par une lésion cérébrale aiguë. Elles indiquent toutefois que la personne concernée peut avoir un seuil de convulsion bas et que l’attaque a activé un réseau potentiellement épileptique qui peut contribuer ultérieurement au développement de l’épilepsie. Les crises aiguës symptomatiques constituent donc le principal facteur de risque de développement de l’épilepsie après un AVC.
Chez les personnes ayant subi une crise symptomatique aiguë, le risque de développer une épilepsie ultérieure est d’environ 20 à 40%. Le risque le plus élevé, supérieur à 80%, est observé chez les patients qui ont eu un état de mal épileptique aigu symptomatique. Un risque accru d’environ 60-70% existe probablement aussi chez les patients ayant eu une crise tonico-clonique aiguë symptomatique le jour de l’AVC.
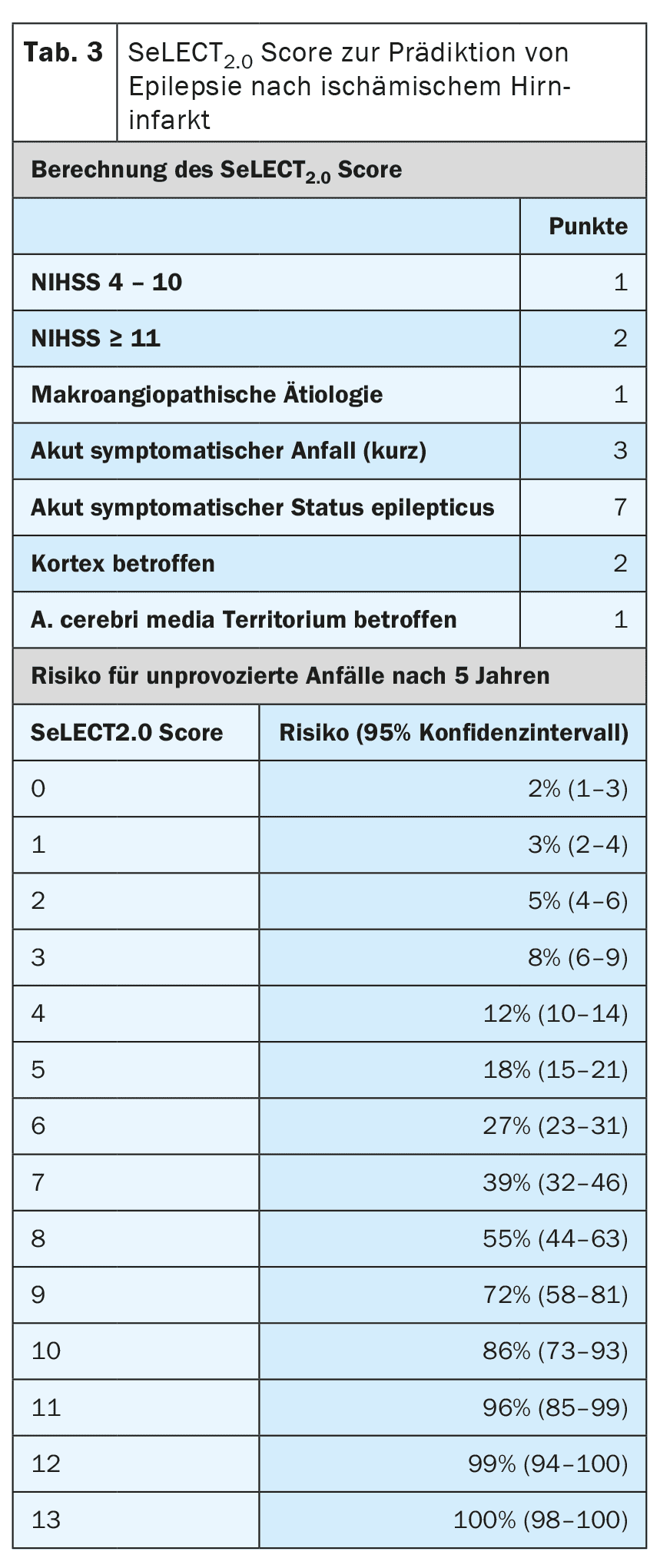
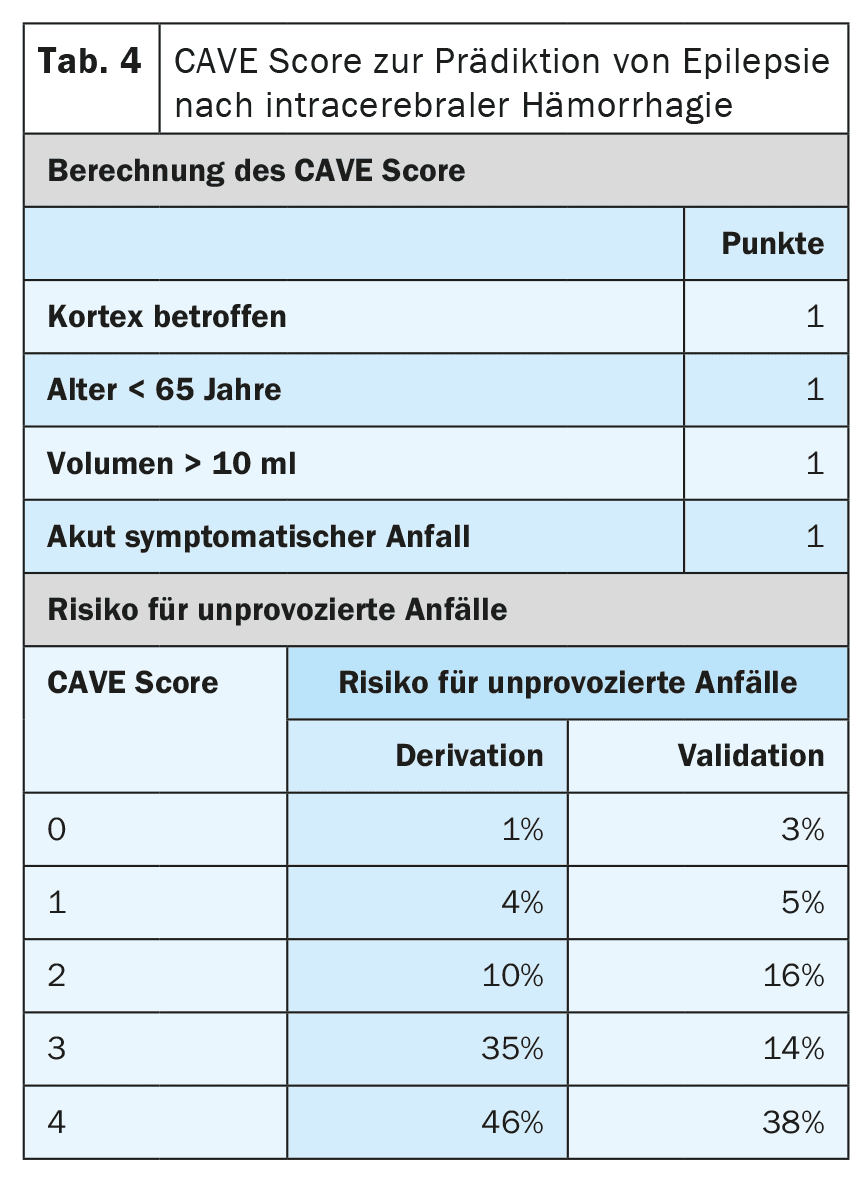
Le type, la localisation, la gravité et l’étiologie de l’infarctus sont d’autres facteurs de risque de développer une épilepsie après un AVC. Il existe désormais des modèles prédictifs très bien validés qui permettent de prédire le risque avec une grande précision. Le modèle SeLECT (tableau 3) [6,7] est recommandé pour les infarctus cérébraux ischémiques et le modèle CAVE (tableau 4) pour les infarctus hémorragiques [8]. Pour le modèle SeLECT, une application pour smartphone est disponible sous le nom de SeLECT Score , qui facilite le calcul au chevet du patient.
Influence sur le résultat : les crises après un AVC sont associées à un résultat moins bon, y compris une mortalité plus élevée, un handicap plus important et un risque accru de troubles cognitifs, y compris de démence [20]. Ces effets sont nettement plus marqués pour les crises symptomatiques aiguës par rapport aux crises non provoquées survenant plus tard. L’issue la plus défavorable est celle d’un état de mal épileptique aigu symptomatique, qui multiplie par dix le risque de mortalité. Cependant, dans la plupart des cas, la raison du décès en cas d’état de mal épileptique aigu symptomatique est le retrait du traitement ou une approche palliative.
Il est important de souligner que ces liens représentent une association et pas nécessairement un lien de causalité. En d’autres termes, les crises après un AVC sont un indicateur d’une lésion cérébrale particulièrement grave due à l’infarctus. Il n’est pas certain qu’un traitement supprimant les crises améliore le résultat. La plupart des études indiquent plutôt que l’outcome n’est pas amélioré.
Traitement des crises symptomatiques aiguës
Il existe peu de preuves robustes concernant le traitement des crises symptomatiques aiguës, mais beaucoup d’incertitudes et de malentendus. La ligne directrice actuelle de la DGN recommande en premier lieu de ne pas traiter les crises aiguës symptomatiques [4]. La raison principale de cette recommandation est d’éviter un surtraitement fréquent. Si, après évaluation individuelle, un traitement devait tout de même être entrepris, il ne devrait l’être qu’à court terme et pendant la phase aiguë, c’est-à-dire dans les 7 à 14 jours suivant l’AVC. Il est en outre recommandé d’utiliser des modèles pronostiques tels que le score SeLECT ou CAVE pour l’évaluation individuelle.
Cependant, la réalité s’écarte considérablement des recommandations des lignes directrices. Les registres pronostiques allemands et américains ainsi que les enquêtes internationales montrent que 9 patients sur 10 souffrant de crises symptomatiques aiguës sont traités par des ASM. Environ la moitié de ces patients reçoivent un traitement de plusieurs mois et jusqu’à un tiers sont traités par ASM à long terme. Ces données proviennent en grande partie de centres spécialisés, de sorte que les chiffres réels dans la population générale sont peut-être encore plus élevés. Il existe donc un écart significatif entre les recommandations des lignes directrices et la pratique clinique.
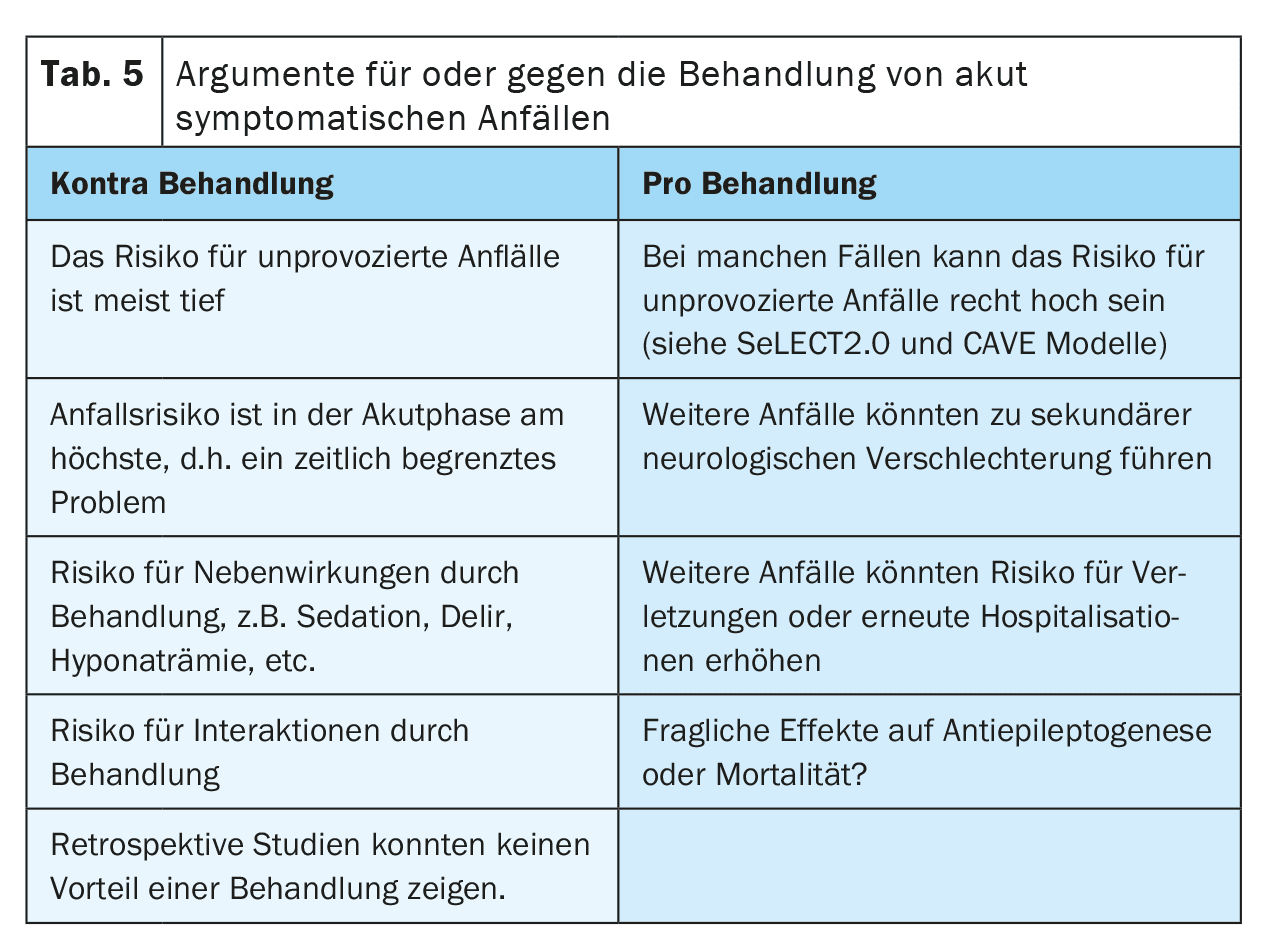
Certains arguments peuvent être avancés pour ou contre le traitement des crises symptomatiques aiguës par des ASM (tableau 5). Les arguments en faveur du traitement sont la crainte de nouvelles crises qui pourraient entraîner des chutes ou des blessures, ou qui pourraient être pénibles pour les patients. On se demande également si les crises pourraient provoquer une aggravation secondaire après un AVC en raison de l’augmentation temporaire des besoins de perfusion et de métabolisme. Ceci est particulièrement pertinent chez les patients présentant des sténoses vasculaires de haut niveau, des vasospasmes, une pression intracrânienne élevée ou après une intervention neurochirurgicale.
D’autre part, le traitement par ASM peut également avoir des effets secondaires. Par exemple, les effets secondaires psychiatriques pourraient réduire la motivation pour la neuroréhabilitation et ainsi compromettre la récupération après l’AVC. Les interactions avec d’autres médicaments, tels que les anticoagulants, les antihypertenseurs ou les hypocholestérolémiants, pourraient réduire l’efficacité du traitement et donc augmenter le risque de récidive d’événements cérébrovasculaires, en particulier avec les ASM inducteurs enzymatiques. On ne sait pas encore s’il existe une interaction pertinente entre les anticoagulants oraux directs et les ASM, car les résultats des études sont contradictoires. Un traitement à long terme avec des ASM peut également augmenter la stigmatisation et le coût pour les patients.
La question de savoir si un traitement suppressif des crises symptomatiques aiguës après un AVC pourrait avoir un effet neuroprotecteur ou antiépileptique est encore à l’étude. Il n’existe pas encore de preuves concluantes.
De notre point de vue, il est recommandé de procéder à une évaluation individuelle. Nous suivons à cet égard le concept “The Good, The Bad, and The Ugly”.
“The Good” : les crises aiguës symptomatiques de bon pronostic et à faible risque sont celles qui ne s’accompagnent pas de troubles graves de la conscience ou de phénomènes moteurs marqués et qui surviennent chez des patients peu affectés par l’AVC et ne présentant pas de sténose vasculaire de haut grade. Si ces crises ne surviennent qu’une seule fois ou rarement, nous pensons qu’il n’est pas nécessaire de recourir à un traitement suppressif des crises.
“The Bad” : lorsque les crises symptomatiques aiguës sont associées à un risque de blessure ou de détérioration neurologique, par exemple en cas de sténose de haut niveau, de vasospasme ou d’augmentation de la pression intracrânienne, un traitement suppressif des crises à court terme doit être envisagé. Dans ces cas, il est recommandé d’utiliser des ASM qui peuvent être administrés rapidement et qui ont un profil d’interaction et d’effets secondaires favorable. Le lévétiracétam est le plus souvent utilisé en pratique (dans >90% des cas) [21]. Le deuxième choix le plus fréquent est le lacosamide. L’acide valproïque est également utilisé assez fréquemment, mais il présente selon nous un profil un peu plus problématique et devrait plutôt être considéré comme un traitement de deuxième intention.
Dans ces cas, nous recommandons que le traitement soit de courte durée, idéalement de 7 à 14 jours. En pratique, dans certains centres, un tel traitement est toutefois poursuivi pendant 3 mois, à l’issue desquels une consultation ambulatoire, incluant un EEG, permet de décider de l’arrêt du traitement.
“The Ugly” : L’état de mal épileptique aigu symptomatique présente un risque élevé (>80%) d’épilepsie ultérieure, un mauvais résultat et une mortalité élevée [18]. Dans ces cas, un traitement de suppression des crises est toujours nécessaire. En raison du risque élevé de développer une épilepsie ultérieure, un traitement suppresseur de crises à long terme peut également être envisagé. Au minimum, des contrôles neurologiques réguliers devraient être planifiés.
Outre l’état de mal épileptique aigu symptomatique, il existe d’autres situations présentant un risque élevé (>60%) d’épilepsie post-accidentelle ultérieure. Il s’agit notamment des crises tonico-cloniques symptomatiques aiguës survenant le même jour que l’AVC, ainsi que de certaines situations à haut risque, telles que l’apparition de modifications typiques de l’épilepsie dans l’EEG précoce. Pour une stratification précise du risque, il convient d’utiliser des modèles de pronostic courants tels que SeLECT ou CAVE. Si ces modèles prédisent un risque de plus de 60% d’épilepsie ultérieure, certains experts recommandent un traitement suppresseur de crises à long terme, comme si l’épilepsie était déjà présente. Cependant, aucune étude n’a encore été menée pour déterminer si cette stratégie est réellement efficace.
Prophylaxie de l’épilepsie post-Stroke (antiépileptogenèse)
L’épilepsie, conséquence à long terme d’événements cérébrovasculaires, est l’une des causes les plus fréquentes d’épilepsie chez les personnes âgées [9]. Bien que le risque d’épilepsie post-cérébrale (ESP) soit d’environ 12% dans les 10 ans suivant un accident vasculaire cérébral ischémique et qu’il augmente même jusqu’à 30% après une hémorragie cérébrale, ces chiffres ne justifiaient pas un traitement suppressif des crises à titre prophylactique sans que des crises d’épilepsie ne se soient effectivement produites [10,11]. En l’absence de preuves, un tel traitement prophylactique ne peut pas être recommandé, car les patients seront désavantagés par les effets secondaires et ne bénéficieront pas d’une protection efficace contre les crises. Ce problème est également exacerbé par la polythérapie fréquente due à de nombreuses comorbidités dans ce groupe d’âge. Il est donc nécessaire de mener des études sur la prophylaxie pharmacologique de l’apparition d’un ESP. Et ce sont justement ces études qui font défaut aujourd’hui. Les essais menés jusqu’à présent ont été rares et peu concluants. Des collègues de Tel Aviv ont réfléchi à un concept compact et prometteur pour la prévention de l’épilepsie post-coup de chaleur au cours de la première décennie de ce siècle [12]. Ils ont choisi comme groupe cible les patients souffrant d’hémorragie intracérébrale, c’est-à-dire ceux qui présentent le plus grand risque de développer une épilepsie. Et la substance pharmacologique utilisée était le valproate, un suppresseur de crises très puissant. Une constellation parfaite dès le premier regard pour arriver au but. Les auteurs ont randomisé en double aveugle 72 patients souffrant d’hémorragies intracérébrales non anévrismales en deux groupes. Une moitié (n=36) a reçu du valproate pendant 4 semaines et l’autre (n=36) un placebo. Le nombre de crises d’épilepsie dans la première année suivant l’hémorragie cérébrale a été comparé entre le verum et le placebo et aucune différence statistiquement significative n’a été observée entre les deux bras (19,5% vs 22,2%, p=0,8).
Une autre étude portant sur la question de l’antiépileptogenèse après un AVC était “Early Treatment with Levetiracetam After Stroke for the prevention of late seizures” (ETLAS). Il était prévu de mener une étude multicentrique, randomisée, contrôlée par placebo et en double aveugle, à laquelle participeraient des patients victimes d’un AVC présentant un syndrome cortical et un score de Rankin modifié ≥3 ou un score NIHSS ≥6. Les participants ont été traités par lévétiracétam 1500 mg/jour ou placebo 12 semaines après l’AVC et suivis pendant 1 an [13]. Le traitement a débuté entre 48 heures et 7 jours après l’événement index et le critère d’évaluation principal était la survenue d’une première crise d’épilepsie tardive, définie comme une crise d’épilepsie non provoquée survenant plus d’une semaine après l’AVC. Des problèmes de recrutement ont fait qu’entre août 2005 et décembre 2006, seuls 16 patients (lévétiracétam, n = 9 ; placebo ; n = 7) ont été inclus dans l’étude et qu’un seul patient (bras placebo) a développé une épilepsie post-AVC. Le recrutement a été rendu difficile car la plupart des patients répondaient à des critères d’exclusion ou présentaient des comorbidités qui empêchaient leur participation à l’étude. En raison de ces difficultés, les auteurs ont conclu qu’il n’était pas possible de mener une étude sur l’antiépileptogenèse pour prévenir l’ESP.
Malgré les tentatives infructueuses de la dernière décennie, la prévention de l’épileptogenèse après un AVC reste un défi scientifique motivant pour de nouvelles études. Des modèles animaux expérimentaux ont suggéré un effet antiépileptogène potentiel de l’acétate d’eslicarbazépine (ESL). Cet effet a été suggéré par une inhibition efficace des courants entrants du hCaV3.2 de haute et de basse affinité [14,15]. Par exemple, dans un modèle de souris pilocarpine pour l’épilepsie chronique, il a été montré qu’un traitement temporaire par ESL réduisait considérablement la fréquence et la durée des décharges épileptiformes au stade chronique, et il a été montré en outre que le traitement par ESL atténuait la perte neuronale et réduisait considérablement l’altération de la coordination [14]. Dans ce contexte, le professeur Koepp de Londres, en collaboration avec le professeur Trinka de Salzbourg et d’autres co-auteurs, ont conçu une étude multicentrique de phase II, randomisée, en double aveugle et contrôlée par placebo, afin de tester l’hypothèse d’un éventuel effet préventif de l’ESL sur le développement d’un ESP et d’évaluer si un traitement par ESL d’un mois peut prévenir les crises non provoquées après un AVC [16]. Les patients présentant un risque élevé de développer des crises non provoquées après une hémorragie intracérébrale aiguë ou un AVC ischémique aigu ont été randomisés pour recevoir soit l’ESL 800 mg/d soit un placebo, le traitement ayant débuté dans les 120 heures suivant la survenue de l’AVC primaire. Le traitement a été poursuivi jusqu’au 30e jour, puis a été arrêté. Les patients ont pu recevoir tous les traitements nécessaires pour traiter l’AVC conformément aux directives de pratique clinique et aux normes de soins et ont été suivis pendant 18 mois. Le critère d’évaluation principal était la survenue d’une première crise non provoquée dans les 6 mois suivant la randomisation (“taux d’échec”). Les critères d’évaluation secondaires comprennent la survenue d’une première crise non provoquée dans les 12 mois suivant la randomisation et pendant toute la durée de l’étude ; les résultats fonctionnels (indice de Barthel ; NIHSS) ; la dépression post-crise (Patient Health Questionnaire-9 ; PHQ-9) ; et la survie globale. Les évaluations de sécurité comprennent l’évaluation des événements indésirables liés au traitement ; les paramètres de laboratoire ; les signes vitaux ; l’électrocardiogramme ; les pensées suicidaires et le comportement suicidaire (PHQ-9, question 9). Le protocole visait à randomiser environ 200 patients (1:1) recrutés sur 21 sites dans sept pays européens et en Israël. Malgré les défis, notamment pendant la pandémie de COVID-19, l’étude a progressé et a inclus un nombre remarquable de patients : 129 ont été étudiés et 125 ont été randomisés. Le recrutement a été arrêté après 30 mois et les résultats sont attendus prochainement.
Traitement de l’épilepsie post-Stroke
L’évolution clinique de l’ESP est hétérogène. Outre les formes qui répondent bien au traitement, il existe également des cas réfractaires. C’est pourquoi un suivi neurologique spécialisé est utile pour cette maladie. L’expérience d’un médecin spécialiste est déjà nécessaire pour établir le diagnostic différentiel entre les crises d’épilepsie focales et les événements cérébrovasculaires. Il n’est pas rare que les patients, mais aussi les médecins d’autres spécialités, confondent les phénomènes ictus nouvellement apparus avec des accidents ischémiques transitoires, ce qui peut conduire à des décisions thérapeutiques erronées. C’est pourquoi le suivi neurologique des patients ayant subi un AVC est recommandé, car il permet d’identifier et de traiter correctement les séquelles.
Une fois le diagnostic d’ESP posé, il est important de choisir le bon traitement pour contrôler efficacement les crises et éviter les effets secondaires. Comme il n’existe pas de directives spécifiques pour l’ESP, le choix des médicaments se fait généralement en fonction des recommandations pour le traitement suppressif des crises dans le cas d’épilepsies structurelles (focales). Cependant, cela doit se faire en tenant compte de la comorbidité des patients victimes d’un AVC, car il n’est pas rare qu’ils souffrent de troubles affectifs et cognitifs (par ex. dépression post-AVC, démence vasculaire). Ainsi, l’administration de modulateurs SV2A peut entraîner un risque accru d’effets secondaires affectifs. Dans l’ensemble, l’ajustement initial des dépresseurs de crise nécessite un contrôle neurologique spécialisé et une correction si nécessaire. Nos études ont montré que le contrôle et l’optimisation des dépresseurs de crise au cours de la première année après l’apparition de l’ESP entraînent une amélioration de 40% du rôle des crises motrices et améliorent considérablement la qualité de vie liée à la santé des patients [17].
Les données sur le traitement spécifique de l’ESP sont importantes pour aider les patients rapidement et efficacement en choisissant le bon médicament. Alors que les études randomisées en double aveugle sur le traitement de l’ESP font défaut, plusieurs études d’observation se sont penchées sur la question. Si ce n’est pas dans la prophylaxie, c’est déjà dans le traitement de l’ESP diagnostiquée que l’ESL se révèle être une substance prometteuse. Les données de l’étude Euro-Esli, par exemple, vont dans ce sens. Il s’agit d’une analyse de données groupées de 14 études européennes, incluant au total 2058 patients [18]. Dans l’analyse de sous-groupe actuelle, les informations sur l’étiologie étaient connues pour 1656 patients et 76 (4,6%) d’entre eux avaient un ESP. Les paramètres de résultat pris en compte étaient l’absence de crises et le taux de répondeurs (≥50% de réduction de la fréquence des crises). Lors de la dernière visite, le taux de répondeurs était significativement plus élevé chez les patients souffrant d’épilepsie post-Stroke que chez les patients souffrant d’autres étiologies d’épilepsie (72,9% vs 60,6%, p=0,04). Aucune différence significative n’a été observée à d’autres moments (3, 6 ou 12 mois). L’absence de crises était plus élevée en faveur de l’ESP à la plupart des moments (par exemple, 48,6% vs 31,7% à la dernière visite, p<0,01). L’incidence des événements indésirables était similaire chez les patients atteints d’ESP que chez les patients atteints d’autres épilepsies (36,0% vs 35,8% ; p=0,966). Les auteurs ont conclu que l’ESL pourrait être une option de traitement efficace et bien tolérée pour les patients atteints de crises focales dans l’ESP.
Notre groupe de travail s’est efforcé de présenter une étude comparative propre en monothérapie. Au total, 207 patients ont été inclus, ce qui représente un grand nombre de patients par rapport aux autres études disponibles [19]. Les comparateurs étaient le lévétiracétam (n=60), le lacosamide (n=43), la lamotrigine (n=40), l’eslicarbazépine (n=38), le valproate (n=18), le topiramate (n=3), le zonisamide (n=2), la gabapentine (n=2) et la carbamazépine n=1). Les résultats ont montré que l’ASM avec un mécanisme d’action par inhibition lente des canaux sodiques (eslicarbazépine et lacosamide) présentait le meilleur taux de rétention et de contrôle des crises par rapport aux ASM avec d’autres mécanismes d’action. En guise d’autocritique, il convient de noter que les derniers médicaments antiépileptiques, tels que le brivaracétam, le perampanel et le cénobamate, n’ont pas été pris en compte dans cette étude, car le traitement avec ces substances n’était pas encore largement répandu au moment de la collecte des données. En ce qui concerne le brivaracetam, l’analyse de sous-groupe de l’étude BRIVAFIRST portant sur 75 patients atteints d’ESPT montre un taux de répondeurs de 36 à 42,7% et une absence de crises de 24 à 34,7% [20]. Cette étude n’a pas été comparée à d’autres dépresseurs de crise.
Il existe maintenant des données sur le traitement de l’état de mal épileptique dans l’ESPT qui reproduisent les résultats de notre étude citée ci-dessus [19,21,22]. Sur 138 patients atteints d’ESPT et présentant un état de mal épileptique réfractaire, il a été démontré que les dépresseurs de crise agissant sur l’inhibition lente des canaux sodiques étaient les plus efficaces pour contrôler l’état de mal [22]. De plus, notre étude sur l’utilisation de l’ESL pour interrompre l’état de mal épileptique a montré que l’administration de ces inhibiteurs lents des canaux sodiques était la plus efficace chez les patients atteints d’ESP. L’application d’ESL a permis d’interrompre le statut chez 65,2% des patients atteints d’ESP, contre 29,8% pour les autres formes d’épilepsie structurelle (29,8%, p<0,01) [21].
Résumé
L’épilepsie post-AVC est la forme d’épilepsie la plus fréquente chez les personnes âgées et peut poser des problèmes de diagnostic différentiel et de traitement. Pour cette raison, il est important de connaître la présentation clinique des crises d’épilepsie chez les personnes âgées et leurs mimiques. Les crises symptomatiques aiguës après un événement cérébrovasculaire sont associées à un faible risque de récidive et, contrairement aux crises qui sont la première manifestation de l’épilepsie, elles ne sont généralement pas une indication pour un traitement continu de suppression des crises. La limite temporelle de 7 jours est considérée comme une valeur de référence, bien que des exceptions soient possibles dans des situations particulières et qu’une prédiction précise de la probabilité de récidive fasse l’objet de recherches en cours. Suite à des initiatives internationales, le modèle SeLECT a été développé pour les infarctus cérébraux ischémiques, y compris sa version disponible sous forme d’application pour smartphone à utiliser au chevet du patient, et le modèle CAVE pour les infarctus hémorragiques. Les décisions concernant la durée du traitement antiépileptique sont prises en fonction du risque de récidive calculé et les scénarios possibles (“The Good”, “The Bad” et “The Ugly”) ont été décrits en détail dans cet article. En ce qui concerne la prévention de l’épileptogenèse après un AVC, il n’existe à ce jour aucun résultat de recherche positif, bien que ce sujet continue d’être traité par différents groupes de travail. Le plus grand espoir réside pour l’instant dans les inhibiteurs lents des canaux sodiques, tels que l’eslicarbazépine ou le lacosamide. En ce qui concerne les effets de répression des crises, ce mécanisme d’action présente en tout cas des avantages dans l’épilepsie post-Stroke, comme le montrent les études les plus récentes de conception ouverte.
Messages Take-Home
- Les crises symptomatiques aiguës après un AVC ne nécessitent généralement pas de traitement à long terme et le délai actuellement recommandé dans les lignes directrices pour distinguer l’épilepsie après un AVC est de 7 jours.
- Pour évaluer plus précisément le risque de récurrence des crises d’épilepsie après un AVC, des outils validés, tels que le modèle SeLECT, ont été développés et sont disponibles sous forme numérique pour une utilisation au chevet du patient.
- Il n’existe actuellement aucune preuve de la prévention de l’épileptogenèse après un AVC, bien que ce sujet fasse actuellement l’objet de recherches intensives.
- De nouvelles études de conception ouverte fournissent les premières indications selon lesquelles le mécanisme d’action de l’inhibition lente des canaux sodiques pourrait présenter des avantages par rapport aux autres suppresseurs de crises en termes d’effet suppresseur de crises dans l’épilepsie post-AVC.
Littérature :
- Misra S, Kasner SE, Dawson J, et al : Outcomes in Patients With Poststroke Seizures. JAMA Neurol 2023 ; 80(11) : 1155-1165. doi:10.1001/jamaneurol.2023.3240.
- Beghi E, Carpio A, Forsgren L, et al : Recommandation pour une définition de l’épilepsie aiguë symptomatique. Epilepsia 2010 ; 51(4) : 671-675. doi:10.1111/j.1528-1167.2009.02285.x.
- Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE official report : a practical clinical definition of epilepsy. Epilepsia 2014 ; 55(4) : 475-482. doi:10.1111/epi.12550.
- Holtkamp M, May TW, Berkenfeld R, et al. Ligne directrice S2k : Première crise d’épilepsie et épilepsies de l’adulte. DGNeurologie. 2024;7(1):21-38. doi:10.1007/s42451-023-00618-z
- Peter-Derex L, Philippeau F, Garnier P, et al : Safety and efficacy of prophylactic levetiracetam for prevention of epileptic seizures in the acute phase of intracerebral haemorrhage (PEACH) : a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurology 2022 ; 21(9):781-791. doi:10.1016/s1474-4422(22)00235-6.
- Galovic M, Döhler N, Erdélyi-Canavese B, et al. : Prediction of late seizures after ischaemic stroke with a novel pronostic model (the SeLECT score) : a multivariable prediction model development and validation study. Lancet Neurol 2018 ; 17(2) : 143-152. doi:10.1016/s1474-4422(17)30404-0.
- Sinka L, Abraira L, Imbach LL, et al : Association of Mortality and Risk of Epilepsy With Type of Acute Symptomatic Seizure After Ischemic Stroke and an Updated Prognostic Model. JAMA Neurol 2023 ; 80(6) : 605-613. doi:10.1001/jamaneurol.2023.0611.
- Haapaniemi E, Strbian D, Rossi C, et al : The CAVE score for predicting late seizures after intracerebral hemorrhage. Accident vasculaire cérébral. 2014;45(7):1971–1976. doi:10.1161/strokeaha.114.004686
- Cloyd J, Hauser W, Towne A, et al : Epidemiological and medical aspects of epilepsy in the elderly. Epilepsy Res 2006 Jan ; 68 Suppl 1 : S39-48.
- Graham NS, Crichton S, Koutroumanidis M, et al : Incidence et associations de l’épilepsie post-traumatique : le registre prospectif des AVC de South London. Stroke 2013 Mar ; 44(3) : 605-611.
- Arntz R, Rutten-Jacobs L, Maaijwee N, et al. : Épilepsie post-coup chez les jeunes adultes : une étude de suivi à long terme. PLoS One 2013 ; 8(2) : e55498.
- Gilad R, Boaz M, Dabby R, et al : Are post intracerebral hemorrhage seizures prevented by anti-epileptic treatment ? Epilepsy Res 2011 Aug ; 95(3) : 227-231.
- van Tuijl JH, van Raak EP, de Krom MC, et al. : Early treatment after stroke for the prevention of late epileptic seizures : a report on the problems performing a randomised placebo-controlled double-blind trial aiming at anti-epileptogenesis. Seizure 2011 ; 20 : 285-291.
- Doeser A, Dickhof G, Reitze M, et al : Targeting pharmacoresistant epilepsy and epileptogenesis with a dual-purpose antiepileptic drug. Brain 2015 ; 138 : 371-387.
- Soares-da-Silva P, Pires N, Bonifacio MJ, et al : L’acétate d’eslicarbazépine pour le traitement de l’épilepsie focale : une mise à jour sur ses mécanismes d’action proposés. Pharmacol Res Perspect 2015 ; 3 : e00124.
- Koepp MJ, Trinka E, Mah YH, et al : Antiepileptogenesis after stroke-trials and tribulations : Methodological challenges and recruitment results of a Phase II study with eslicarbazepine acetate. Epilepsia Open 2023 Sep ; 8(3) : 1190-1201.
- Winter Y, Daneshkhah N, Galland N, et al : Health-related quality of life in patients with poststroke epilepsy. Epilepsy & Behavior 2018 ; 80 : 303-306
- Villanueva V, Holtkamp M, Delanty N, et al : Euro-Esli : a European audit of real-world use of eslicarbazepine acetate as a treatment for partial-onset seizures. J Neurol 2017 ; 264 : 2232-2248.
- Winter Y, Uphaus T, Sandner K, et al. : Efficacité et sécurité des médicaments antiseizure dans l’épilepsie post-stroke. Seizure. 2022 Aug ; 100 : 109-114.
- Lattanzi S, Canafoglia L, Canevini MP, et al. : BRIVAFIRST Group Membership. Brivaracetam comme traitement add-on chez les patients atteints d’épilepsie post-traumatique : données réelles de l’étude BRIVAracetam add-on First Italian netwoRk Study (BRIVAFIRST). Seizure . 2022 avr ; 97 : 37-42.
- Winter Y, Sandner K, Vieth T, Groppa S : L’acétate d’eslicarbazepine pour le traitement de l’état de mal épileptique. Epileptic Disord 2023 Apr ; 25(2) : 142-149.
- Winter Y, Sandner K, Vieth T, et al : Médicament anti-social de troisième génération dans le traitement de l’état de mal épileptique réfractaire aux benzodiazépines dans l’épilepsie post-critique : une étude rétrospective observationnelle basée sur un registre. CNS Drugs 2023 Oct;37(10) : 929-936.
HAUSARZT PRAXIS 2024; 19(12): 6–13