Le crisi sintomatiche acute post-ictus generalmente non richiedono una terapia a lungo termine e l’attuale limite di tempo raccomandato dalle linee guida per differenziare l’epilessia dopo l’ictus è di 7 giorni. Sono stati sviluppati strumenti convalidati, come il modello SeLECT, per valutare in modo più accurato il rischio di recidiva delle crisi epilettiche dopo l’ictus e sono disponibili in formato digitale per essere utilizzati al letto del paziente.
Può sostenere il test ECM nella nostra piattaforma di apprendimento dopo aver esaminato i materiali consigliati. Clicchi sul seguente pulsante:
Una persona su 20 in Europa soffrirà di una crisi epilettica nel corso della sua vita. Questo rende le crisi epilettiche uno dei disturbi neurologici più comuni. Le prime crisi epilettiche si verificano con particolare frequenza nell’infanzia e nella fanciullezza, mentre c’è un picco di incidenza nella giovane età adulta. Tuttavia, le crisi epilettiche sono ancora più frequenti dopo i 55 anni, dopodiché l’incidenza aumenta costantemente. Il motivo è l’invecchiamento del cervello e l’accumulo di varie malattie cerebrali.
L’ictus è la causa più comune di epilessia con prima manifestazione in età adulta in Europa. Nelle persone con più di 65 anni, la metà delle epilessie è dovuta a una malattia cerebrovascolare. Le crisi epilettiche che seguono un ictus non sono solo frequenti, ma anche rilevanti. Sono associate a una maggiore mortalità, disabilità e rischio di ulteriori deficit cognitivi [1].
Approccio pratico
Se si sospetta un attacco epilettico dopo un ictus, è necessario chiarire tre questioni principali:
- Si tratta di una crisi epilettica?
- Soffre di epilessia?
- Quale trattamento è appropriato in questa situazione?
1. Si tratta di una crisi epilettica?
Le diagnosi differenziali più importanti (mimiche) delle crisi epilettiche in questa fascia di età sono gli attacchi ischemici transitori (TIA), gli episodi neurologici focali transitori nell’angiopatia amiloide (TFNE, noti anche come incantesimi amiloidi ), la sincope e altri fenomeni autonomici. Le crisi epilettiche funzionali o dissociative e le emicranie sono meno comuni in questa fascia di età.
Le crisi epilettiche sono di solito episodi brevi della durata di circa 30 secondi – 2 minuti, spesso accompagnati da sintomi positivi come aura visiva, parestesia formicolante, mioclono o altri fenomeni motori. Al contrario, i TIA e le TFNE sono caratterizzati da deficit neurologici come paresi, difetti del campo visivo o disturbi del linguaggio. I disturbi della coscienza sono tipici delle crisi epilettiche, ma si verificano raramente nelle diagnosi differenziali citate. Una durata superiore a 15 minuti è atipica per le crisi epilettiche ed è più indicativa di TIA, TFNE o altri disturbi neurologici, come l’aura emicranica.
Tuttavia, va notato che le crisi epilettiche negli anziani sono spesso oligosintomatiche. Una manifestazione tipica è una crisi focale, vissuta inconsciamente e caratterizzata da pause e sguardo fisso. Queste crisi possono essere facilmente trascurate e richiedono un’attenta osservazione e una risposta mirata da parte della persona colpita durante la crisi. In seguito si verificano spesso disturbi post-ictali, come la confusione.
La differenziazione diagnostica si basa solitamente su un’anamnesi accurata e sull’osservazione esterna, ma spesso è difficile. Il rilevamento di cambiamenti epilettici tipici nell’EEG interictale, la registrazione di un EEG video ictale e la differenziazione delle diagnosi differenziali mediante risonanza magnetica possono essere utili. La sensibilità di un breve EEG interictale di routine per rilevare potenziali epilettici tipici è solo del 20-30% e non è sufficiente per escludere l’epilessia in caso di risultati negativi. La sensibilità può essere aumentata fino al 70% registrando precocemente, ripetendo gli EEG ed eseguendo un EEG a lungo termine durante la notte.
2 Il paziente soffre di epilessia?
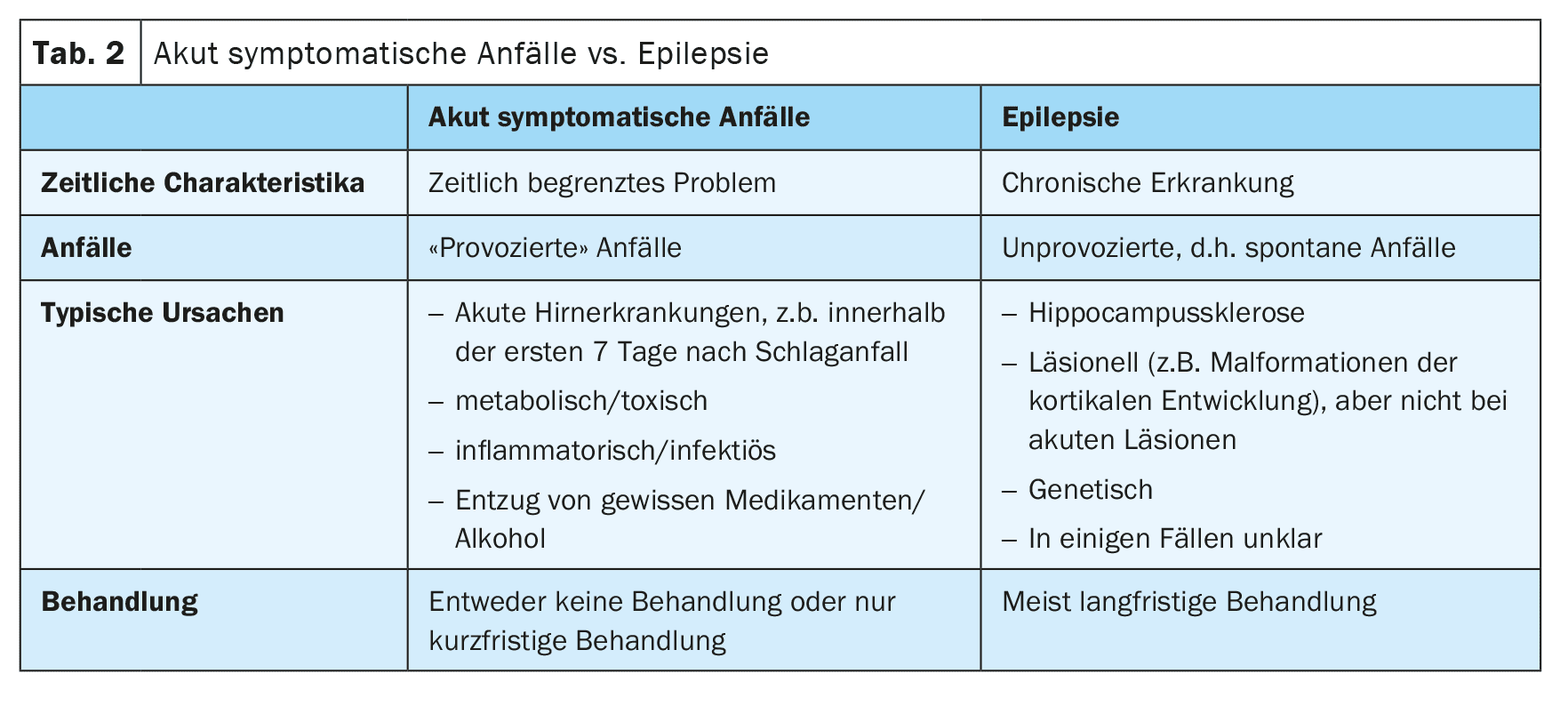
Se è chiaro che si tratta di una crisi epilettica, bisogna chiarire se la crisi è stata provocata o non provocata (Tabella 1). Il motto è: “Tutti i pazienti con epilessia hanno crisi epilettiche, ma non tutti i pazienti con crisi epilettiche hanno l’epilessia”.
Oggi ci riferiamo alle crisi provocate come “crisi sintomatiche acute” [2]. Queste si verificano in stretta connessione temporale con una malattia cerebrale o un disturbo metabolico, tossico o infiammatorio. Le crisi epilettiche che si verificano nei primi 7 giorni dopo un ictus sono considerate acutamente sintomatiche. Il motivo è che queste crisi sono scatenate da cambiamenti tossici e infiammatori acuti nel contesto dell’ictus e non sono espressione di un’epilessia sottostante. Di conseguenza, il rischio di successive crisi epilettiche non provocate è piuttosto basso. Tuttavia, il limite di 7 giorni non è ben stabilito e recenti dati non pubblicati suggeriscono che le crisi epilettiche entro il primo mese sono anch’esse associate a un basso rischio di crisi successive non provocate e potrebbero quindi essere considerate acutamente sintomatiche (Tabella 2).
Al contrario, le crisi epilettiche che si verificano più tardi dopo un ictus sono considerate non provocate, a meno che non siano state scatenate da altri fattori, come l’iponatriemia. Se una crisi epilettica non provocata è stata probabilmente causata dall’ictus di base, cioè ha una semiologia corrispondente, c’è un alto rischio di recidiva, superiore al 60%, per ulteriori crisi non provocate nei 10 anni successivi. Per questo motivo, secondo le attuali linee guida, una diagnosi di epilessia strutturale può essere fatta dopo una prima crisi epilettica non provocata a seguito di un ictus [3].
3. quale trattamento è appropriato in questa situazione?
La distinzione tra crisi sintomatiche acute ed epilessia strutturale è fondamentale, poiché gli approcci terapeutici sono molto diversi. Una descrizione dettagliata del trattamento di queste due entità segue più avanti in questo articolo.
In sintesi, le linee guida raccomandano di non trattare o di trattare solo a breve termine le crisi sintomatiche acute, mentre l’epilessia richiede solitamente un trattamento a lungo termine (Fig. 1) [4]. Se il trattamento viene iniziato dopo una crisi sintomatica acuta, deve essere relativamente aggressivo e con un farmaco ad azione rapida. Il motivo è che il rischio di crisi epilettiche è massimo nei primi giorni dopo l’ictus e diminuisce rapidamente in seguito. Al contrario, il trattamento dell’epilessia nelle persone anziane segue il principio ” iniziare piano, andare piano”, poiché la clearance dei farmaci antiepilettici (ASM) è ridotta in età avanzata.
Rischi dopo le crisi sintomatiche acute
Circa il 40–50% delle crisi epilettiche che si verificano per la prima volta sono acutamente sintomatiche. La malattia cerebrovascolare è una delle cause più comuni di crisi epilettiche sintomatiche acute, soprattutto nelle persone anziane. Le crisi epilettiche sono particolarmente comuni nei pazienti trattati nelle unità di terapia intensiva dopo un ictus, con circa il 20–30% di questi pazienti che presentano crisi epilettiche. Tuttavia, molte di queste crisi non sono convulsive, mostrano solo sintomi lievi o sono completamente subcliniche.
Se si effettua un monitoraggio EEG continuo, si possono rilevare più crisi epilettiche. In uno studio prospettico dopo un’emorragia intracerebrale, sono state rilevate crisi subcliniche in quasi la metà dei pazienti [5]. Rimane poco chiaro se le crisi subcliniche abbiano un significato simile a quelle cliniche. Tuttavia, è dimostrato che le crisi subcliniche sono associate a un rischio altrettanto elevato di sviluppo successivo dell’epilessia e di esito negativo rispetto alle crisi cliniche. Pertanto, il trattamento delle crisi subcliniche dovrebbe essere simile a quello delle crisi cliniche.
Rischio di sviluppare l’epilessia: le crisi acute sintomatiche non sono sinonimo di epilessia, poiché sono innescate da un danno cerebrale acuto. Tuttavia, indicano che la persona colpita può avere una bassa soglia convulsiva e che l’ictus ha attivato una rete potenzialmente epilettica che potrebbe in seguito contribuire allo sviluppo dell’epilessia. Le crisi sintomatiche acute sono quindi il fattore di rischio più importante per lo sviluppo dell’epilessia dopo un ictus.
Nelle persone che hanno avuto un attacco sintomatico acuto, il rischio di epilessia successiva è di circa il 20–40%. Il rischio più elevato, superiore all’80%, si osserva nei pazienti che hanno avuto uno status epilettico sintomatico acuto. Un aumento del rischio di circa il 60-70% è probabile anche nei pazienti che hanno avuto un attacco sintomatico acuto tonico-clonico il giorno dell’ictus.
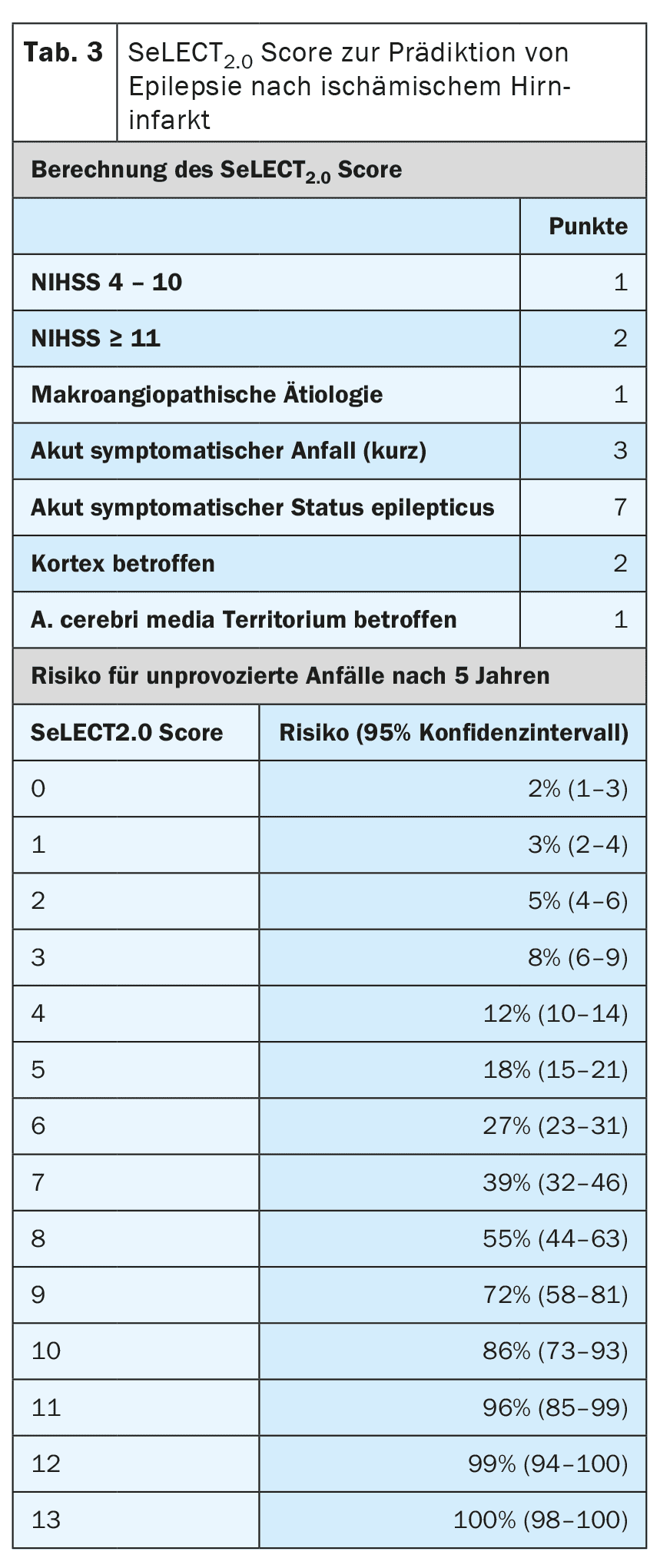
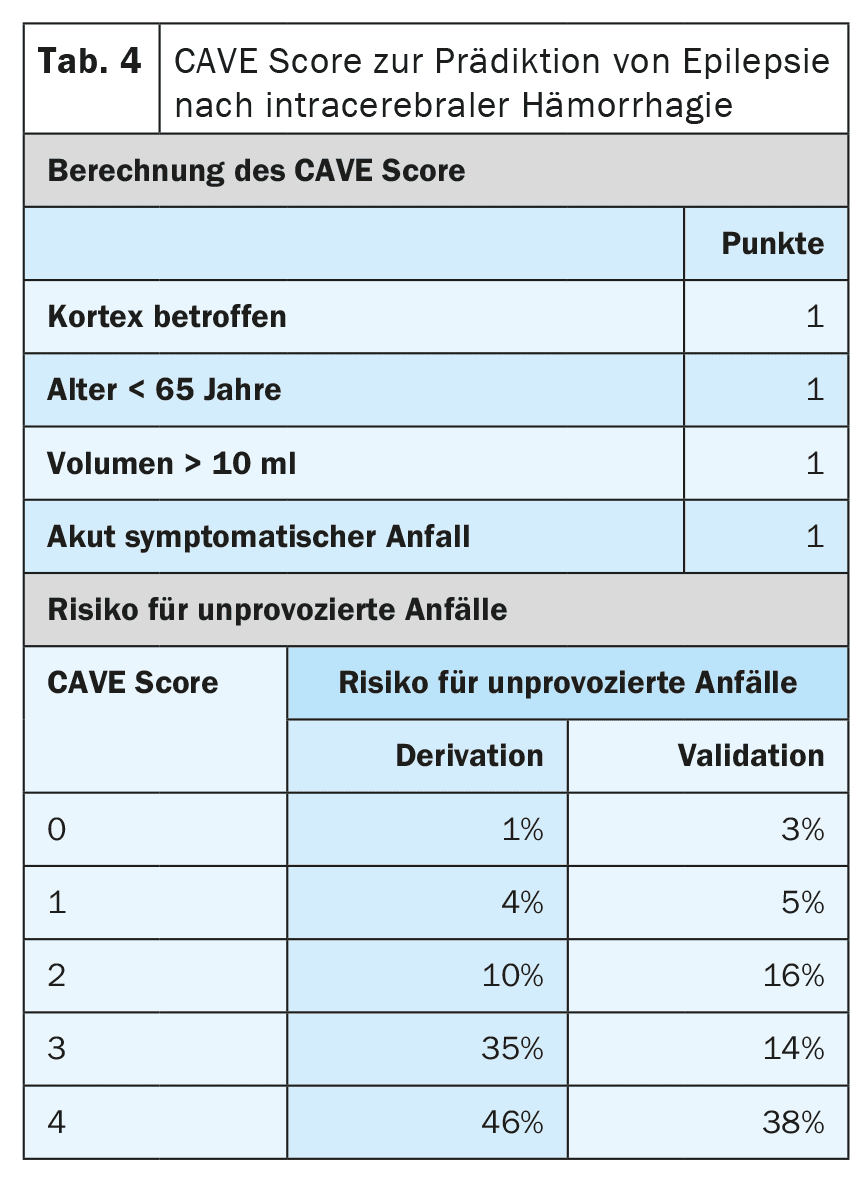
Altri fattori di rischio per lo sviluppo dell’epilessia dopo un ictus sono il tipo, la localizzazione, la gravità e l’eziologia dell’infarto. Esistono oggi modelli prognostici molto ben validati, in grado di prevedere il rischio con un elevato grado di accuratezza. [6,7] Il modello SeLECT (Tabella 3) è consigliato per gli infarti cerebrali ischemici, mentre il modello CAVE (Tabella 4) è consigliato per gli infarti emorragici [8]. Per il modello SeLECT è disponibile un’applicazione per smartphone con il nome di SeLECT Score , che facilita il calcolo al letto del paziente.
[20]Impatto sull’esito: le crisi epilettiche post-ictus sono associate a un esito peggiore, tra cui una mortalità più elevata, una maggiore disabilità e un aumento del rischio di deterioramento cognitivo, compresa la demenza. Questi effetti sono molto più pronunciati per le crisi sintomatiche acute rispetto alle crisi non provocate che si verificano successivamente. L’esito peggiore si ha dopo un epilettico di stato sintomatico acuto, che aumenta il rischio di mortalità di dieci volte. Nella maggior parte dei casi, tuttavia, il motivo della morte nell’epilessia acuta sintomatica è la sospensione del trattamento o un approccio palliativo.È importante sottolineare che queste correlazioni rappresentano un’associazione e non necessariamente una causalità. In altre parole, le crisi epilettiche dopo un ictus sono un indicatore di un danno cerebrale particolarmente grave causato dall’infarto. Se il trattamento soppressivo delle convulsioni migliori l’esito è discutibile. La maggior parte degli studi tende a indicare che l’esito non migliora.
Trattamento delle crisi sintomatiche acute
Esistono poche prove solide per il trattamento delle crisi epilettiche acutamente sintomatiche, ma molte incertezze e incomprensioni. L’attuale linea guida DGN raccomanda principalmente di non trattare le crisi epilettiche acutamente sintomatiche [4]. La ragione principale addotta è che occorre evitare un sovratrattamento frequente. Se il trattamento viene comunque iniziato dopo una valutazione individuale, deve essere effettuato solo a breve termine e durante la fase acuta, cioè nei primi 7-14 giorni dopo l’ictus. Si raccomanda inoltre di utilizzare modelli prognostici come il punteggio SeLECT o CAVE per la valutazione individuale.
Tuttavia, la realtà differisce notevolmente dalle raccomandazioni delle linee guida. I registri prognostici di Germania e Stati Uniti, nonché le indagini internazionali, mostrano che 9 pazienti su 10 con crisi sintomatiche acute vengono trattati con gli ASM. Circa la metà di questi pazienti riceve un trattamento per diversi mesi e fino a un terzo viene trattato con ASM a lungo termine. La maggior parte di questi dati proviene da centri specializzati, quindi i numeri reali nella popolazione generale potrebbero essere ancora più alti. Esiste quindi una chiara discrepanza tra le raccomandazioni della linea guida e la pratica clinica.
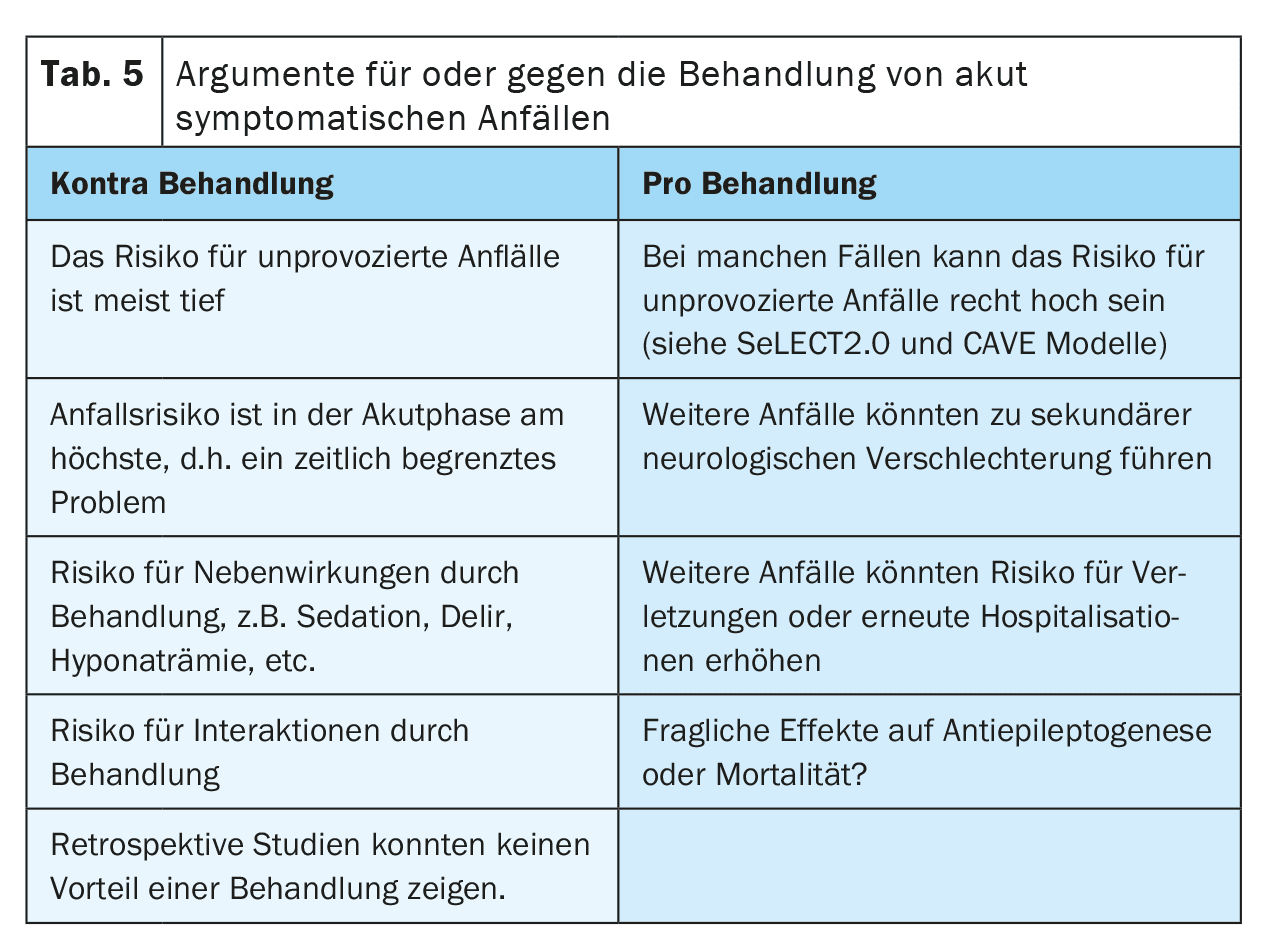
Ci sono diversi argomenti a favore o contro il trattamento delle crisi acutamente sintomatiche con gli ASM (Tabella 5). Un argomento a favore del trattamento è il timore di ulteriori crisi epilettiche che potrebbero provocare cadute o lesioni o causare disagio al paziente. Si discute anche se le crisi possano causare un deterioramento secondario dopo un ictus, a causa dell’aumento temporaneo della necessità di perfusione e metabolismo. Questo aspetto è particolarmente rilevante nei pazienti con stenosi vascolare di alto grado, vasospasmi, aumento della pressione intracranica o dopo un intervento di neurochirurgia.
D’altra parte, il trattamento con gli ASM può anche avere effetti collaterali. Per esempio, gli effetti collaterali psichiatrici potrebbero ridurre la motivazione alla neuroriabilitazione e quindi compromettere il recupero dopo un ictus. Le interazioni con altri farmaci, come gli anticoagulanti, gli antipertensivi o i farmaci ipocolesterolemizzanti, potrebbero ridurre l’efficacia della terapia e quindi aumentare il rischio di eventi cerebrovascolari ricorrenti, in particolare con gli ASM che inducono gli enzimi. Attualmente non è ancora chiaro se esista un’interazione rilevante tra anticoagulanti orali diretti e ASM, in quanto esistono risultati di studi contraddittori. Il trattamento a lungo termine con ASM può anche aumentare lo stigma e i costi per i pazienti.
Si sta ancora studiando se il trattamento soppressivo delle crisi sintomatiche acute dopo un ictus possa avere un effetto neuroprotettivo o antiepilettogeno. Ad oggi non ci sono prove evidenti.
A nostro avviso, si raccomanda una valutazione individuale. Seguiamo il concetto di “Il buono, il cattivo e il brutto”.
“Il bene”: le crisi sintomatiche acute con una buona prognosi e un basso rischio sono quelle che non sono accompagnate da una grave compromissione della coscienza o da fenomeni motori pronunciati e si verificano in pazienti che sono solo leggermente compromessi dopo l’ictus e non hanno una stenosi vascolare di alto grado. Se queste crisi si verificano solo una volta o raramente, riteniamo che il trattamento soppressivo delle crisi non sia necessario.
“Il male”: se le crisi sintomatiche acute sono associate a un rischio di lesione o deterioramento neurologico, ad esempio stenosi di alto grado, vasospasmo o aumento della pressione intracranica, si deve prendere in considerazione un trattamento soppressivo delle crisi a breve termine. In questi casi, è consigliabile utilizzare ASM che possono essere dosati rapidamente e che hanno un profilo di interazione e di effetti collaterali favorevole. > [21] Il Levetiracetam è il più comunemente usato nella pratica (nel 90% dei casi). La seconda scelta più comune è la lacosamide. Anche l’acido valproico viene utilizzato relativamente di frequente, ma a nostro avviso ha un profilo un po’ più problematico e dovrebbe essere considerato piuttosto una terapia di seconda scelta.
In questi casi, si consiglia di somministrare il trattamento solo per un breve periodo, idealmente da 7 a 14 giorni. In pratica, tuttavia, in alcuni centri tale trattamento viene continuato per 3 mesi, dopodiché la decisione di interrompere la terapia viene presa durante una consultazione ambulatoriale, che include un EEG.
“Il brutto”: nell’epilessia di stato acutamente sintomatica, c’è un rischio elevato (80%) di epilessia successiva, di esito negativo e di mortalità elevata [18]. In questi casi, è sempre necessario un trattamento soppressivo delle crisi. A causa dell’elevato rischio di sviluppare l’epilessia più tardi nella vita, può essere preso in considerazione anche un trattamento soppressivo delle crisi a lungo termine. Come minimo, devono essere previsti controlli neurologici regolari.
Oltre allo status epilettico sintomatico acuto, ci sono altre situazioni con un rischio elevato (>60%) di successiva epilessia post-ictus. Queste includono crisi sintomatiche acute tonico-cloniche nello stesso giorno dell’ictus, nonché alcune situazioni ad alto rischio, come la comparsa di cambiamenti epilettici-tipici nell’EEG precoce. I modelli prognostici comuni, come SeLECT o CAVE, devono essere utilizzati per una precisa stratificazione del rischio. Se questi modelli prevedono un rischio superiore al 60% di epilessia successiva, alcuni esperti raccomandano un trattamento soppressivo delle crisi a lungo termine, come se l’epilessia fosse già presente. Tuttavia, non è ancora stato studiato se questa strategia sia effettivamente efficace.
Profilassi dell’epilessia post-ictus (antiepilettogenesi)
L’epilessia come conseguenza a lungo termine di eventi cerebrovascolari è una delle cause più comuni di epilessia negli anziani [9]. Sebbene il rischio di epilessia post-ictus (PSE) nei primi 10 anni dopo un ictus ischemico sia di circa il 12% e salga addirittura al 30% dopo un’emorragia cerebrale, queste cifre non giustificano una terapia soppressiva delle crisi come profilassi senza che si siano effettivamente verificate delle crisi epilettiche [10,11]. Senza prove corrispondenti, tale terapia profilattica non può essere raccomandata, perché i pazienti subiranno svantaggi dovuti agli effetti collaterali e non avranno una protezione significativa dalle crisi. Questo problema è anche aggravato dalla frequente politerapia dovuta a numerose comorbidità in questo gruppo di età. Pertanto, sono necessari studi che indaghino la profilassi farmacologica dell’insorgenza di PSE. Ed è proprio questo tipo di studi che oggi manca. Gli studi condotti finora sono stati rari e senza successo. Nel primo decennio di questo secolo, i colleghi di Tel Aviv hanno proposto un progetto compatto e promettente per la prevenzione dell’epilessia post-ictus [12]. Hanno scelto come gruppo target i pazienti con emorragie intracerebrali, cioè quelli con il più alto rischio di sviluppare l’epilessia. E come sostanza farmacologica è stato utilizzato il valproato, un potente soppressore di crisi epilettiche. Una costellazione perfetta fin dal primo sguardo per raggiungere l’obiettivo. Gli autori hanno randomizzato 72 pazienti con emorragie intracerebrali non aneuristiche in due gruppi in doppio cieco. Una metà (n=36) ha ricevuto il valproato per 4 settimane e l’altra (n=36) il placebo. Il numero di crisi epilettiche nel primo anno dopo l’emorragia cerebrale è stato confrontato tra il valproato e il placebo e non c’è stata alcuna differenza statisticamente significativa tra i due bracci (19,5% vs 22,2%, p=0,8).
Un altro studio che si è concentrato sulla questione dell’antiepilettogenesi dopo l’ictus è stato “Early Treatment with Levetiracetam After Stroke for the prevention of late seizures” (ETLAS). È stato pianificato uno studio multicentrico, randomizzato, controllato con placebo, in doppio cieco, a cui hanno partecipato pazienti con ictus con una sindrome corticale e un punteggio Rankin modificato ≥3 o NIHSS ≥6. I partecipanti sono stati trattati con levetiracetam 1500 mg/die o placebo 12 settimane dopo l’ictus e seguiti per 1 anno [13]. Il trattamento è stato iniziato tra 48 ore e 7 giorni dopo l’evento indice e l’endpoint primario era il verificarsi di una prima crisi epilettica tardiva, definita come una crisi epilettica non provocata più di una settimana dopo l’ictus. I problemi di reclutamento hanno fatto sì che solo 16 pazienti (levetiracetam, n=9; placebo; n=7) siano stati inclusi nello studio tra agosto 2005 e dicembre 2006 e che solo un paziente (braccio placebo) abbia sviluppato un’epilessia post-ictus. Il reclutamento è stato reso difficile perché la maggior parte dei pazienti rispondeva a criteri di esclusione o presentava comorbidità che impedivano la partecipazione allo studio. A causa di queste difficoltà, gli autori sono giunti alla conclusione che non è possibile condurre uno studio anti-epilettogenesi per la prevenzione della PSE.
Nonostante i tentativi infruttuosi dell’ultimo decennio, la prevenzione dell’epilettogenesi dopo un ictus rimane una sfida scientifica che motiva nuovi studi. Modelli animali sperimentali hanno indicato un potenziale effetto antiepilettogeno dell’eslicarbazepina acetato (ESL). [14,15] Si è ipotizzato che questo effetto sia dovuto all’efficace inibizione delle correnti ascendenti hCaV3.2 ad alta e bassa affinità. [14] Ad esempio, in un modello murino di epilessia cronica con pilocarpina, è stato dimostrato che il trattamento transitorio con ESL riduce in modo significativo la frequenza e la durata delle scariche epilettiformi nella fase cronica; inoltre, è stato dimostrato che il trattamento con ESL attenua la perdita neuronale e riduce in modo significativo la compromissione della coordinazione. [16] In questo contesto, il Prof. Koepp di Londra insieme al Prof. Trinka di Salisburgo e ad altri co-autori hanno progettato uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo, di fase II, per verificare l’ipotesi di un possibile effetto preventivo dell’ESL per lo sviluppo di PSE e per valutare se un trattamento ESL di un mese può prevenire le crisi epilettiche non provocate dopo l’ictus. I pazienti ad alto rischio di sviluppare crisi epilettiche non provocate dopo un’emorragia intracerebrale acuta o un ictus ischemico acuto sono stati randomizzati a ricevere ESL 800 mg/d o placebo, con inizio del trattamento entro 120 ore dall’insorgenza dell’ictus primario. Il trattamento è stato continuato fino al giorno 30 e poi interrotto. I pazienti hanno potuto ricevere tutte le terapie necessarie per il trattamento dell’ictus secondo le linee guida della pratica clinica e lo standard di cura e sono stati seguiti per 18 mesi. L’endpoint primario era il verificarsi di una prima crisi non provocata entro 6 mesi dalla randomizzazione (“tasso di fallimento”). Gli endpoint secondari includono il verificarsi di una prima crisi non provocata entro 12 mesi dalla randomizzazione e per tutto il periodo dello studio; gli esiti funzionali (Barthel Index; NIHSS); la depressione post-ictus (Patient Health Questionnaire-9; PHQ-9); e la sopravvivenza complessiva. Le valutazioni di sicurezza includevano la valutazione degli eventi avversi correlati al trattamento; i parametri di laboratorio; i segni vitali; l’elettrocardiogramma; l’ideazione e il comportamento suicida (PHQ-9, domanda 9). Il protocollo prevedeva la randomizzazione di circa 200 pazienti (1:1) reclutati in 21 siti in sette Paesi europei e in Israele. Nonostante le sfide, soprattutto durante la pandemia COVID-19, lo studio è andato avanti e ha arruolato un numero notevole di pazienti: 129 sono stati sottoposti a screening e 125 sono stati randomizzati. Il reclutamento è stato interrotto dopo 30 mesi e i risultati sono attesi a breve.
Terapia per l’epilessia post-ictus
Il decorso clinico della PSE è eterogeneo. Oltre alle forme che rispondono bene alla terapia, ci sono anche casi che sono refrattari alla terapia. Per questa malattia è consigliabile un’assistenza neurologica specializzata. L’esperienza di uno specialista è necessaria per la diagnosi differenziale delle crisi epilettiche focali da eventi cerebrovascolari. I pazienti, ma anche i medici di altre specialità, spesso confondono i fenomeni ictali di recente insorgenza con gli attacchi ischemici transitori, il che può portare a decisioni terapeutiche errate. Si raccomanda pertanto che i pazienti ricevano un ulteriore trattamento neurologico dopo che si è verificato un ictus, in quanto ciò consente di classificare e trattare correttamente le malattie secondarie.
Una volta diagnosticata la PSE, è importante scegliere la terapia giusta per controllare efficacemente le crisi ed evitare gli effetti collaterali. Poiché non esistono linee guida specifiche per la PSE, la scelta dei farmaci si basa solitamente sulle raccomandazioni per la terapia soppressiva delle crisi per le epilessie strutturali (focali). Tuttavia, si deve tenere conto della comorbilità dei pazienti con ictus, che spesso soffrono di disturbi affettivi e cognitivi (ad esempio, depressione post-ictus, demenza vascolare). La somministrazione di modulatori SV2A, ad esempio, può quindi comportare un aumento del rischio di effetti collaterali affettivi. Nel complesso, l’interruzione iniziale dei soppressori di crisi epilettiche richiede un monitoraggio neurologico specialistico e una correzione, se necessario. [17] I nostri studi hanno dimostrato che il controllo e l’ottimizzazione dei soppressori delle crisi nel primo anno dopo l’insorgenza della PSE porta a un miglioramento del 40% della gravità delle crisi e aumenta significativamente la qualità di vita dei pazienti.
I dati sulla terapia specifica della PSE sono importanti per aiutare i pazienti in modo rapido ed efficace, scegliendo il farmaco giusto. Sebbene manchino studi randomizzati in doppio cieco sul trattamento della PSE, diversi studi osservazionali hanno affrontato questo tema. Se non nella profilassi, ma nel trattamento della PSE diagnosticata, l’ESL ha dimostrato di essere una sostanza promettente. Questo è supportato, ad esempio, dai dati dello studio Euro-Esli. [18] Si tratta di un’analisi dei dati raggruppati di 14 studi europei, che hanno incluso un totale di 2058 pazienti. Nell’attuale analisi di sottogruppo, le informazioni sull’eziologia erano note per 1656 pazienti e 76 (4,6%) di questi avevano la PSE. La libertà dalle crisi e il tasso di responder (riduzione ≥50% della frequenza delle crisi) sono stati considerati come parametri di esito. All’ultima visita, il tasso di responder era significativamente più alto nei pazienti con epilessia post-ictus rispetto ai pazienti con altre eziologie di epilessia (72,9% vs. 60,6%, p=0,04). Non c’era alcuna differenza significativa in altri punti temporali (3, 6 o 12 mesi). La libertà dalle crisi era maggiore a favore del PSE nella maggior parte dei punti temporali (ad esempio, 48,6% contro 31,7% all’ultima visita, p<0,01). L’incidenza di eventi avversi era simile nei pazienti con PSE e in quelli con altre epilessie (36,0% vs. 35,8%; p=0,966). Gli autori hanno riassunto che l’ESL potrebbe essere un’opzione di trattamento efficace e ben tollerata per i pazienti con crisi focali nella PSE.
Il nostro gruppo di lavoro ha cercato di presentare uno studio con un disegno comparativo pulito della monoterapia. [19] Sono stati inclusi 207 pazienti in totale, un numero elevato di pazienti rispetto ad altri studi disponibili. I comparatori erano levetiracetam (n=60), lacosamide (n=43), lamotrigina (n=40), eslicarbazepina (n=38), valproato (n=18), topiramato (n=3), zonisamide (n=2), gabapentin (n=2) e carbamazepina n=1). I risultati hanno mostrato che gli ASM con il meccanismo d’azione tramite l’inibizione lenta dei canali del sodio (eslicarbazepina e lacosamide) hanno mostrato il miglior tasso di ritenzione e controllo delle crisi rispetto agli ASM con altri meccanismi d’azione. Come autocritica, va notato che i più recenti soppressori delle crisi, come brivaracetam, perampanel e cenobamato, non sono stati inclusi in questo studio perché il trattamento con queste sostanze non era ancora diffuso al momento della raccolta dei dati. [20] L’analisi di sottogruppo dello studio BRIVAFIRST con 75 pazienti affetti da PSE è ora disponibile per il brivaracetam, che mostra un tasso di risposta del 36–42,7% e una libertà dalle crisi del 24–34,7%. In questo studio non è stato effettuato un confronto con altri soppressori di crisi.
Sono ora disponibili dati sul trattamento dell’epilessia di stato nella PSE, che replicano i risultati del nostro studio sopra citato [19,21,22]. In 138 pazienti PSE con epilessia di stato refrattaria, è stato dimostrato che i soppressori di crisi che agiscono attraverso l’inibizione lenta dei canali del sodio sono i più efficaci nel controllare l’epilessia di stato [22]. A sostegno di ciò, il nostro studio sull’uso dell’ESL per interrompere lo stato epilettico ha mostrato che la somministrazione di questi inibitori lenti dei canali del sodio era più efficace nei pazienti con PSE. Lo stato è stato abolito dall’applicazione di ESL nel 65,2% dei pazienti con PSE, rispetto al 29,8% di altre forme di epilessia strutturale (29,8%, p<0,01) [21].
Sommario
L’epilessia post-ictus è la forma più comune di epilessia negli anziani e può presentare sfide diagnostiche e terapeutiche differenziali. Per questo motivo, è importante conoscere la presentazione clinica delle crisi epilettiche negli anziani e i loro mimici. Le crisi sintomatiche acute che seguono un evento cerebrovascolare sono associate a un basso rischio di recidiva e, a differenza delle crisi come prima manifestazione dell’epilessia, di solito non costituiscono un’indicazione per una terapia soppressiva delle crisi a lungo termine. Il limite temporale di 7 giorni viene utilizzato come linea guida, anche se sono possibili eccezioni in situazioni particolari e una previsione precisa della probabilità di recidiva è oggetto di ricerca attuale. A seguito di iniziative internazionali, sono stati sviluppati il modello SeLECT per gli infarti cerebrali ischemici, compresa la versione disponibile come applicazione per smartphone da utilizzare al letto del paziente, e il modello CAVE per gli infarti emorragici. Le decisioni sulla durata della terapia soppressiva delle crisi epilettiche vengono prese in base al rischio calcolato di recidiva e i possibili scenari (“Il buono”, “Il cattivo” e “Il brutto”) sono descritti in dettaglio in questo articolo. Per quanto riguarda la prevenzione dell’epilettogenesi dopo un ictus, ad oggi non sono disponibili risultati di ricerca positivi, anche se questo argomento è ancora oggetto di studio da parte di diversi gruppi di ricerca. Al momento, la speranza maggiore risiede negli inibitori lenti dei canali del sodio, come l’eslicarbazepina o la lacosamide. In termini di effetti soppressivi delle crisi, questo meccanismo d’azione mostra certamente dei vantaggi nell’epilessia post-ictus, come dimostrano gli ultimi studi con un disegno aperto.
Messaggi da portare a casa
- Le crisi sintomatiche acute post-ictus in genere non richiedono una terapia a lungo termine e il limite di tempo attualmente raccomandato nelle linee guida per differenziare l’epilessia dopo l’ictus è di 7 giorni.
- Sono stati sviluppati strumenti convalidati, come il modello SeLECT, per una valutazione più precisa del rischio di recidiva di crisi epilettiche dopo un ictus e sono disponibili in formato digitale per essere utilizzati al letto del paziente.
- Attualmente non esistono prove sulla prevenzione dell’epilettogenesi dopo un ictus, anche se è in corso un’intensa ricerca su questo tema.
- Nuovi studi con un disegno aperto forniscono le prime indicazioni che il meccanismo d’azione dell’inibizione lenta dei canali del sodio potrebbe avere dei vantaggi rispetto ad altri soppressori di crisi per quanto riguarda l’effetto soppressivo delle crisi nell’epilessia post-ictus.
Letteratura:
- Misra S, Kasner SE, Dawson J, et al: Esiti nei pazienti con convulsioni post-ictus. JAMA Neurol 2023; 80(11): 1155-1165. doi:10.1001/jamaneurol.2023.3240.
- Beghi E, Carpio A, Forsgren L, et al: Raccomandazione per una definizione di crisi sintomatica acuta. Epilepsia 2010; 51(4): 671-675. doi:10.1111/j.1528-1167.2009.02285.x.
- Fisher RS, Acevedo C, Arzimanoglou A, et al. Rapporto ufficiale ILAE: una definizione clinica pratica di epilessia. Epilepsia 2014; 55(4): 475-482. doi:10.1111/epi.12550.
- Holtkamp M, May TW, Berkenfeld R, et al. Linea guida S2k: prima crisi epilettica ed epilessie in età adulta. DGNeurologia. 2024;7(1):21-38. doi:10.1007/s42451-023-00618-z
- Peter-Derex L, Philippeau F, Garnier P, et al: Sicurezza ed efficacia del levetiracetam profilattico per la prevenzione delle crisi epilettiche nella fase acuta dell’emorragia intracerebrale (PEACH): uno studio di fase 3, randomizzato, in doppio cieco, controllato con placebo. Lancet Neurology 2022; 21(9):781-791. doi:10.1016/s1474-4422(22)00235-6.
- Galovic M, Döhler N, Erdélyi-Canavese B, et al: Previsione di crisi epilettiche tardive dopo ictus ischemico con un nuovo modello prognostico (il punteggio SeLECT): uno studio di sviluppo e di convalida del modello di previsione multivariabile. Lancet Neurol 2018; 17(2): 143-152. doi:10.1016/s1474-4422(17)30404-0.
- Sinka L, Abraira L, Imbach LL, et al: Associazione tra mortalità e rischio di epilessia con il tipo di crisi sintomatica acuta dopo ictus ischemico e un modello prognostico aggiornato. JAMA Neurol 2023; 80(6): 605-613. doi:10.1001/jamaneurol.2023.0611.
- Haapaniemi E, Strbian D, Rossi C, et al: Il punteggio CAVE per prevedere le crisi epilettiche tardive dopo un’emorragia intracerebrale. Stroke. 2014;45(7):1971–1976. doi:10.1161/strokeaha.114.004686
- Cloyd J, Hauser W, Towne A, et al: Aspetti epidemiologici e medici dell’epilessia negli anziani. Epilepsy Res 2006 Jan; 68 Suppl 1: S39-48.
- Graham NS, Crichton S, Koutroumanidis M, et al: Incidenza e associazioni dell’epilessia post-ictus: il registro prospettico South London Stroke. Stroke 2013 Mar; 44(3): 605-611.
- Arntz R, Rutten-Jacobs L, Maaijwee N, et al: Epilessia post-ictus nei giovani adulti: uno studio di follow-up a lungo termine. PLoS One 2013; 8(2): e55498.
- Gilad R, Boaz M, Dabby R, et al: Le crisi post emorragia intracerebrale sono prevenute dal trattamento antiepilettico? Epilepsy Res 2011 Aug; 95(3): 227-231.
- van Tuijl JH, van Raak EP, de Krom MC, et al: Trattamento precoce dopo l’ictus per la prevenzione delle crisi epilettiche tardive: una relazione sui problemi di esecuzione di uno studio randomizzato in doppio cieco controllato con placebo e finalizzato all’antiepilettogenesi. Seizure 2011; 20: 285-291.
- Doeser A, Dickhof G, Reitze M, et al.: Puntare sull’epilessia farmacoresistente e sull’epilettogenesi con un farmaco antiepilettico a doppio scopo. Brain 2015; 138: 371-387.
- Soares-da-Silva P, Pires N, Bonifacio MJ, et al: Eslicarbazepina acetato per il trattamento dell’epilessia focale: un aggiornamento sui meccanismi d’azione proposti. Pharmacol Res Perspect 2015; 3: e00124.
- Koepp MJ, Trinka E, Mah YH, et al: Antiepilettogenesi dopo ictus – prove e tribolazioni: sfide metodologiche e risultati di reclutamento di uno studio di Fase II con eslicarbazepina acetato. Epilepsia Open 2023 Sep; 8(3): 1190-1201.
- Winter Y, Daneshkhah N, Galland N, et al: Qualità di vita correlata alla salute nei pazienti con epilessia post-ictus. Epilessia & Comportamento 2018; 80: 303-306
- Villanueva V, Holtkamp M, Delanty N, et al: Euro-Esli: un audit europeo sull’uso reale dell’eslicarbazepina acetato come trattamento delle crisi parziali. J Neurol 2017; 264: 2232-2248.
- Winter Y, Uphaus T, Sandner K, et al: Efficacia e sicurezza dei farmaci antiepilettici nell’epilessia post-ictus. Sequestro. 2022 agosto; 100: 109-114.
- Lattanzi S, Canafoglia L, Canevini MP, et al: Membri del gruppo BRIVAFIRST. Brivaracetam come trattamento aggiuntivo nei pazienti con epilessia post-ictus: dati reali dello studio BRIVAracetam add-on First Italian netwoRk Study (BRIVAFIRST). Sequestro. 2022 Apr; 97: 37-42.
- Winter Y, Sandner K, Vieth T, Groppa S: Eslicarbazepina acetato per il trattamento dello status epilettico. Epileptic Disord 2023 Apr; 25(2): 142-149.
- Winter Y, Sandner K, Vieth T, et al: Farmaci antiepilettici di terza generazione nel trattamento dell’epilessia di stato refrattaria alle benzodiazepine nell’epilessia post-ictus: uno studio retrospettivo osservazionale basato su un registro. CNS Drugs 2023 Oct;37(10): 929-936.
HAUSARZT PRAXIS 2024; 19(12): 6–13