Las convulsiones sintomáticas agudas tras un ictus no suelen requerir terapia a largo plazo y el plazo actual recomendado por las directrices para diferenciar la epilepsia tras un ictus es de 7 días. Se han desarrollado herramientas validadas, como el modelo SeLECT, para evaluar con mayor precisión el riesgo de recurrencia de crisis epilépticas tras un ictus y están disponibles digitalmente para su uso junto a la cama del paciente.
Puede realizar el examen CME en nuestra plataforma de aprendizaje después de revisar los materiales recomendados. Haga clic en el siguiente botón:
Una de cada 20 personas en Europa sufrirá una crisis epiléptica a lo largo de su vida. Esto convierte a las crisis epilépticas en uno de los trastornos neurológicos más comunes. Las primeras crisis se producen con especial frecuencia en la infancia y la niñez, mientras que hay una meseta en la incidencia en la edad adulta joven. Sin embargo, las crisis epilépticas son aún más frecuentes a partir de los 55 años, edad a partir de la cual la incidencia aumenta de forma constante. La razón de ello es el envejecimiento del cerebro y la acumulación de diversas enfermedades cerebrales.
El ictus es la causa más frecuente de epilepsia con primera manifestación en la edad adulta en Europa. En las personas mayores de 65 años, la mitad de las epilepsias se deben a una enfermedad cerebrovascular. Las crisis epilépticas tras un ictus no sólo son frecuentes, sino también relevantes. Se asocian a una mayor mortalidad, discapacidad y riesgo de mayores déficits cognitivos [1].
Enfoque práctico
Si se sospecha que se produce una convulsión tras un ictus, deben aclararse tres cuestiones principales:
- ¿Es un ataque epiléptico?
- ¿Tiene epilepsia?
- ¿Qué tratamiento es el adecuado en esta situación?
1. ¿se trata de un ataque epiléptico?
Los diagnósticos diferenciales (imitaciones) más importantes de las crisis epilépticas en este grupo de edad son los ataques isquémicos transitorios (AIT), los episodios neurológicos focales transitorios en la angiopatía amiloide (TFNE, también conocidos como espasmos amiloides ), el síncope y otros fenómenos autonómicos. Las convulsiones funcionales o disociativas y las migrañas son menos frecuentes en este grupo de edad.
Los ataques epilépticos suelen ser episodios breves que duran entre 30 segundos y 2 minutos y que suelen ir acompañados de síntomas positivos como auras visuales, hormigueos parestésicos, mioclonías u otros fenómenos motores. Por el contrario, los AIT y los TFNE se caracterizan por déficits neurológicos como paresia, defectos del campo visual o trastornos del habla. La pérdida de consciencia es típica de las crisis epilépticas, pero rara vez aparece en los diagnósticos diferenciales mencionados. Una duración de más de 15 minutos es atípica para las crisis epilépticas y es más indicativa de AIT, TFNE u otros trastornos neurológicos, como un aura migrañosa.
Sin embargo, hay que tener en cuenta que las crisis epilépticas en las personas mayores suelen ser oligosintomáticas. Una manifestación típica es una crisis focal, inconsciente, caracterizada por pausas y mirada fija. Una crisis de este tipo puede pasarse por alto fácilmente y requiere una observación atenta y una respuesta específica por parte de la persona afectada durante la crisis. Después suelen aparecer trastornos postictales como la confusión.
La diferenciación diagnóstica suele basarse en una historia clínica exhaustiva y en la observación externa, pero a menudo resulta difícil. La detección de cambios epilepsia-típicos en el EEG interictal, la grabación de un EEG ictal en vídeo y la diferenciación de diagnósticos diferenciales mediante resonancia magnética pueden ser útiles. La sensibilidad de un EEG interictal rutinario corto para detectar potenciales epilepsia-típicos es sólo del 20–30% y no es suficiente para descartar la epilepsia en caso de hallazgos negativos. La sensibilidad puede aumentarse hasta un 70% mediante el registro precoz, la repetición de EEG y la realización de un EEG de larga duración durante la noche.
2 ¿El paciente sufre epilepsia?
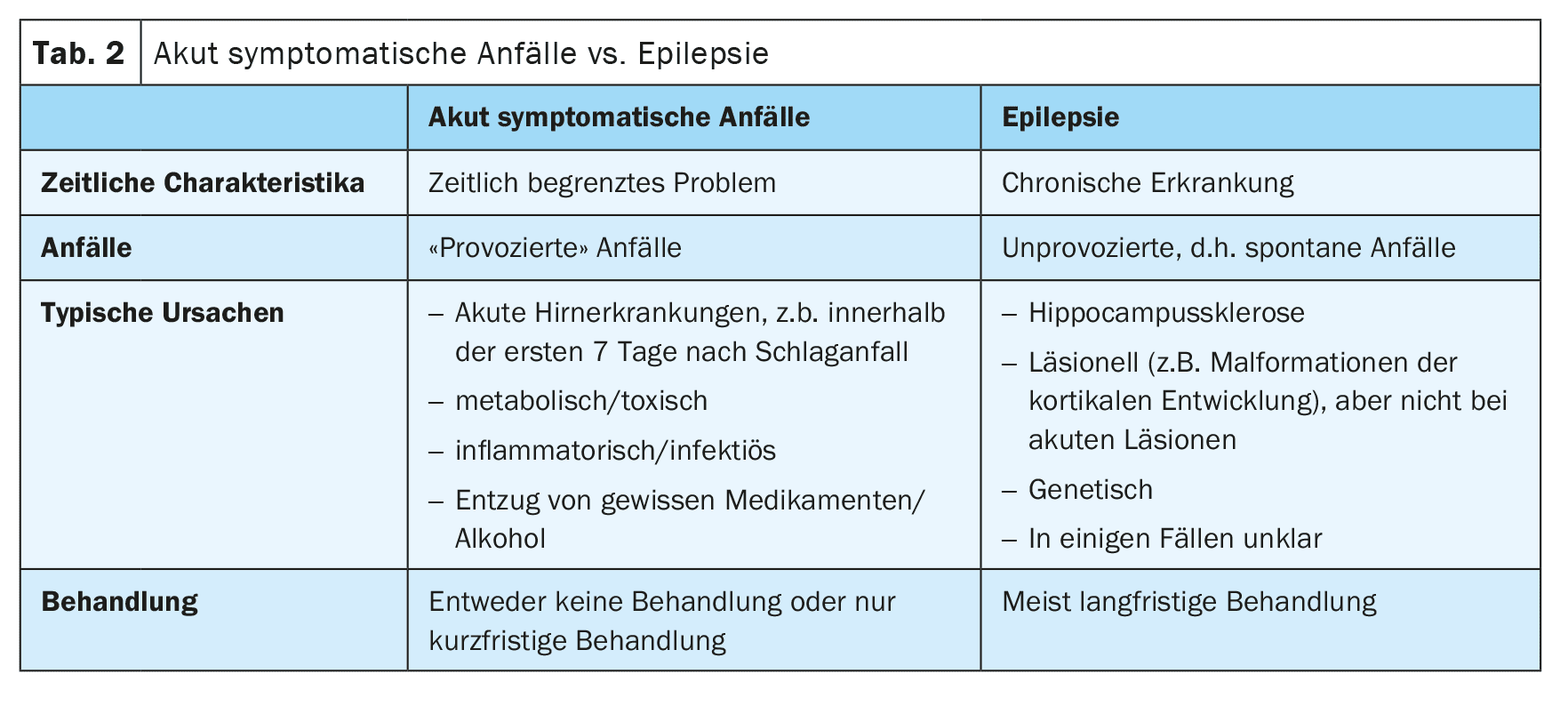
Si está claro que se trata de una crisis epiléptica, hay que aclarar si la crisis ha sido provocada o no (Tabla 1). El lema es: “Todos los epilépticos tienen crisis, pero no todos los que tienen crisis tienen epilepsia”.
Hoy en día, nos referimos a las crisis provocadas como “crisis sintomáticas agudas” [2]. Se producen en estrecha relación temporal con una enfermedad cerebral o un trastorno metabólico, tóxico o inflamatorio. Las crisis epilépticas que se producen en los primeros 7 días tras un ictus se consideran agudamente sintomáticas. La razón es que estos ataques se desencadenan por cambios tóxicos e inflamatorios agudos en el contexto del ictus y no son una expresión de la epilepsia subyacente. En consecuencia, el riesgo de convulsiones posteriores no provocadas es bastante bajo. Sin embargo, el límite de 7 días no está bien establecido y datos recientes no publicados sugieren que las crisis durante el primer mes también se asocian a un riesgo bajo de crisis posteriores no provocadas y, por lo tanto, también podrían considerarse sintomáticas agudas (Tabla 2).
Por el contrario, las convulsiones que se producen más tarde tras un ictus se consideran no provocadas, a menos que hayan sido desencadenadas por otros factores, como la hiponatremia. Si una crisis no provocada fue probablemente causada por el ictus subyacente, es decir, tiene una semiología coincidente, existe un alto riesgo de recurrencia de más del 60% para nuevas crisis no provocadas en los 10 años siguientes. Por este motivo, según las directrices actuales, se puede hacer un diagnóstico de epilepsia estructural tras una primera crisis epiléptica no provocada después de un ictus [3].
3. ¿qué tratamiento es el adecuado en esta situación?
La distinción entre crisis sintomáticas agudas y epilepsia estructural es crucial, ya que los enfoques de tratamiento son muy diferentes. Más adelante en este artículo se describe detalladamente el tratamiento de estas dos entidades.
En resumen, las directrices recomiendan no tratar las crisis sintomáticas agudas o hacerlo sólo a corto plazo, mientras que la epilepsia suele requerir un tratamiento a largo plazo (Fig. 1) [4]. Si se inicia el tratamiento tras una crisis sintomática aguda, debe ser relativamente agresivo y con un fármaco de acción rápida. La razón de ello es que el riesgo de convulsiones es mayor en los primeros días tras un ictus y disminuye rápidamente después. Por el contrario, el tratamiento de la epilepsia en personas mayores sigue el principio de empezar poco a poco, ir despacio, ya que el aclaramiento de los fármacos antiepilépticos (MEA) se reduce en la vejez.
Riesgos tras convulsiones sintomáticas agudas
Aproximadamente entre el 40% y el 50% de las primeras crisis epilépticas son agudamente sintomáticas. La enfermedad cerebrovascular es una de las causas más comunes de las crisis sintomáticas agudas, sobre todo en las personas mayores. Las crisis epilépticas son especialmente frecuentes en los pacientes tratados en unidades de cuidados intensivos tras un ictus, ya que aproximadamente el 20-30% de estos pacientes sufren crisis epilépticas. Sin embargo, muchas de estas convulsiones no son convulsivas, muestran sólo síntomas leves o son completamente subclínicas.
Si se lleva a cabo una monitorización continua del EEG, pueden detectarse más convulsiones. En un estudio prospectivo realizado tras una hemorragia intracerebral, se detectaron convulsiones subclínicas en casi la mitad de los pacientes [5]. Aún no está claro si las crisis subclínicas tienen una importancia similar a las crisis clínicas. Sin embargo, existen pruebas de que las crisis subclínicas se asocian a un riesgo de desarrollo posterior de epilepsia y de mala evolución similar al de las crisis clínicas. Por lo tanto, el tratamiento de las crisis subclínicas debería ser probablemente similar al de las crisis clínicas.
Riesgo de desarrollar epilepsia: Las crisis sintomáticas agudas no son sinónimo de epilepsia, ya que se desencadenan por un daño cerebral agudo. Sin embargo, indican que la persona afectada puede tener un umbral convulsivo bajo y que el ictus ha activado una red potencialmente epiléptica que más tarde puede contribuir al desarrollo de la epilepsia. Las crisis sintomáticas agudas son, por tanto, el factor de riesgo más importante para el desarrollo de epilepsia tras un ictus.
En las personas que han sufrido una crisis sintomática aguda, el riesgo de epilepsia posterior se sitúa en torno al 20–40%. El riesgo más elevado, de más del 80%, se observa en pacientes que han sufrido un estado epiléptico agudo sintomático. Probablemente también exista un mayor riesgo de alrededor del 60–70% en pacientes con una crisis sintomática aguda tónico-clónica el día del ictus.
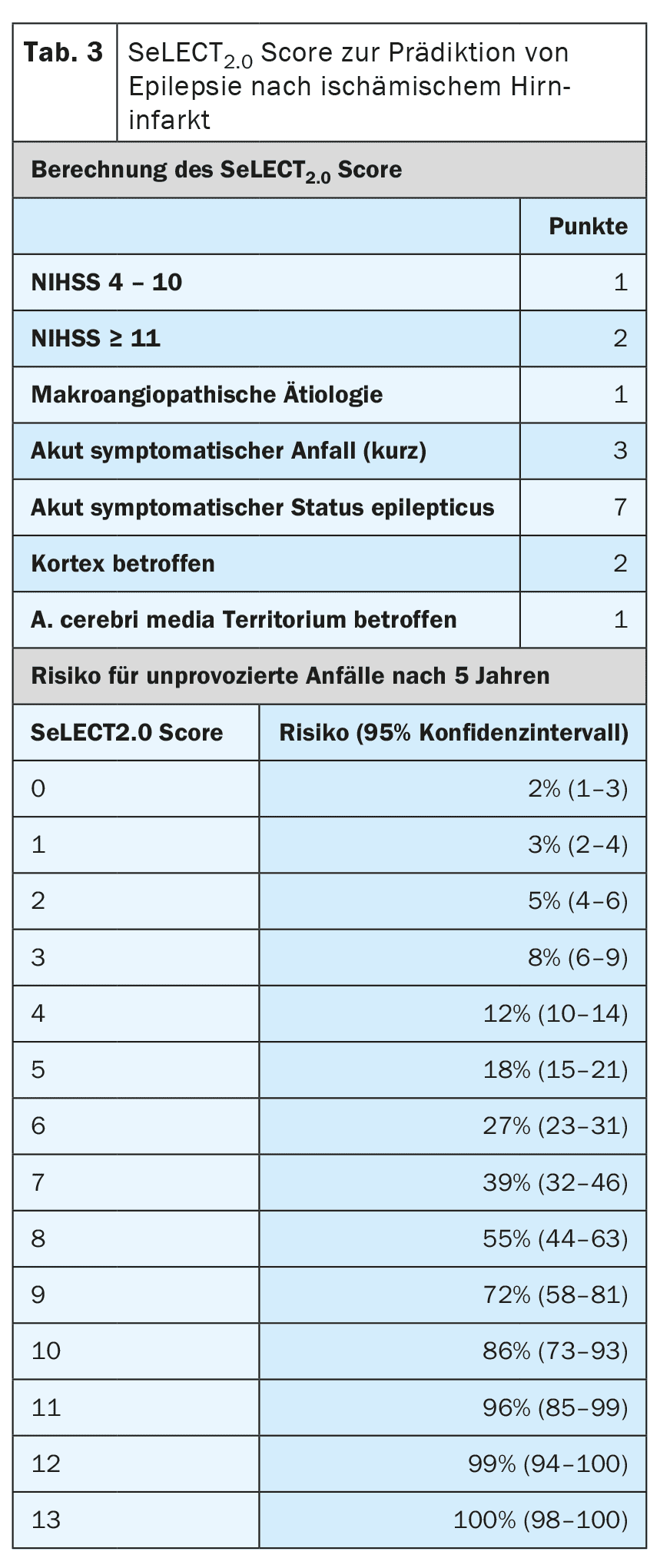
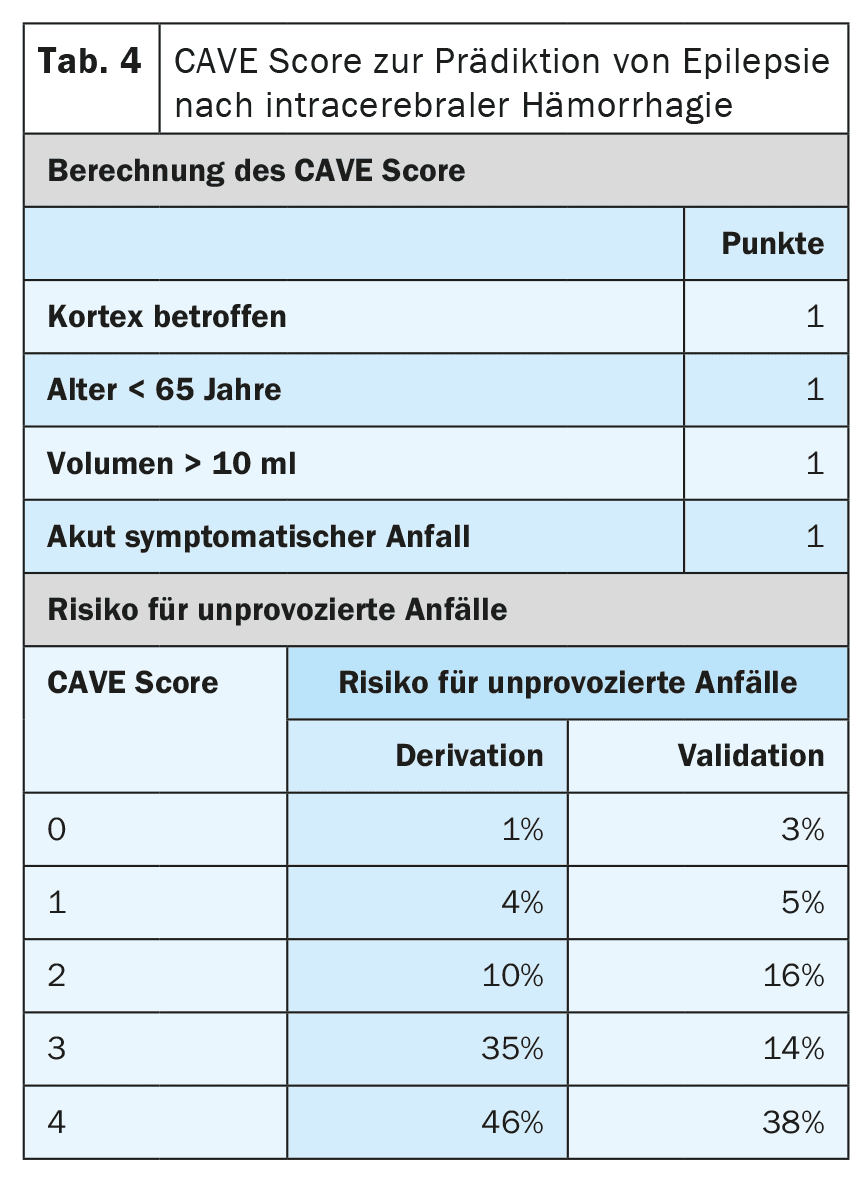
Otros factores de riesgo para el desarrollo de epilepsia tras un ictus son el tipo, la localización, la gravedad y la etiología del infarto. En la actualidad existen modelos de pronóstico muy bien validados que pueden predecir el riesgo con un alto grado de exactitud. [6,7] El modelo SeLECT (tabla 3) se recomienda para los infartos cerebrales isquémicos, mientras que el modelo CAVE (tabla 4) se recomienda para los infartos hemorrágicos [8]. Existe una aplicación para smartphone para el modelo SeLECT bajo el nombre de Puntuación SeLECT , que facilita el cálculo a la cabecera del paciente.
Impacto en el resultado: Las convulsiones posteriores a un ictus se asocian a un peor resultado, incluida una mayor mortalidad, una mayor discapacidad y un mayor riesgo de deterioro cognitivo, incluida la demencia [20]. Estos efectos son mucho más pronunciados en las crisis sintomáticas agudas en comparación con las crisis no provocadas que se producen más tarde. El peor resultado se produce tras un estado epiléptico sintomático agudo, que multiplica por diez el riesgo de mortalidad. En la mayoría de los casos, sin embargo, el motivo de la muerte en el estado epiléptico sintomático agudo es la retirada del tratamiento o un enfoque paliativo.
Es importante subrayar que estas correlaciones representan una asociación y no necesariamente una causalidad. En otras palabras, las convulsiones tras un ictus son un indicador de un daño cerebral especialmente grave causado por el infarto. Que el tratamiento anticonvulsivo mejore el resultado es cuestionable. La mayoría de los estudios tienden a indicar que el resultado no mejora.
Tratamiento de las convulsiones sintomáticas agudas
Existen pocas pruebas sólidas para el tratamiento de las convulsiones agudas sintomáticas, pero muchas incertidumbres y malentendidos. La directriz actual de la DGN recomienda principalmente que no se traten las convulsiones agudamente sintomáticas [4]. La razón principal que se da para ello es que debe evitarse el sobretratamiento frecuente. Si, a pesar de todo, se inicia el tratamiento tras una evaluación individual, sólo debe llevarse a cabo a corto plazo y durante la fase aguda, es decir, en los primeros 7 a 14 días tras el ictus. También se recomienda utilizar modelos de pronóstico como la puntuación SeLECT o CAVE para la evaluación individual.
Sin embargo, la realidad difiere considerablemente de las recomendaciones de las directrices. Los registros de pronóstico de Alemania y EE.UU., así como las encuestas internacionales, muestran que 9 de cada 10 pacientes con crisis sintomáticas agudas son tratados con ASM. Aproximadamente la mitad de estos pacientes reciben tratamiento durante varios meses, y hasta un tercio son tratados con ASM a largo plazo. La mayoría de estos datos proceden de centros especializados, por lo que las cifras reales en la población general pueden ser incluso superiores. Existe, por tanto, una clara discrepancia entre las recomendaciones de las directrices y la práctica clínica.
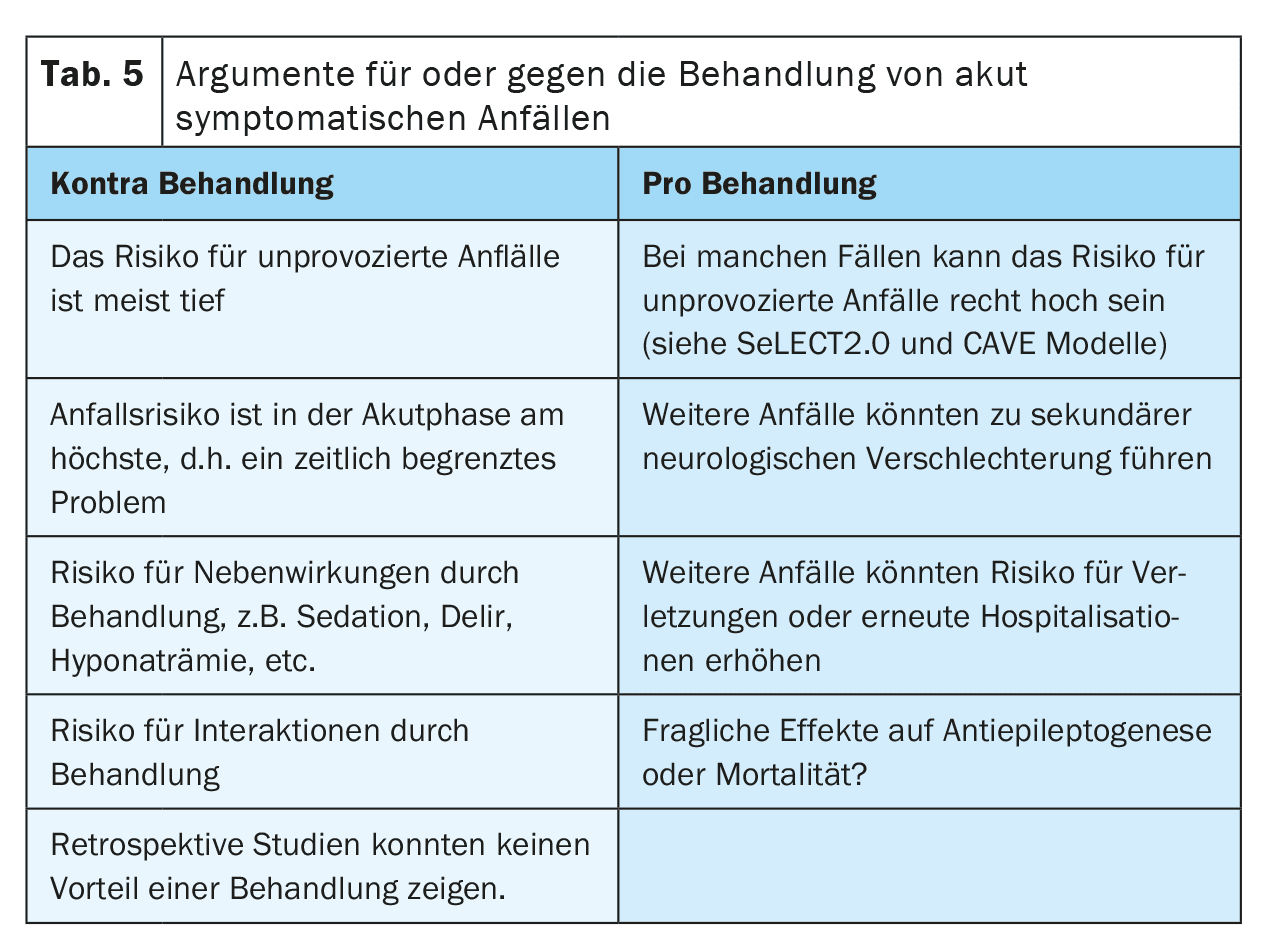
Existen varios argumentos a favor o en contra del tratamiento de las convulsiones agudas sintomáticas con ASM (Tabla 5). Un argumento a favor del tratamiento es el temor a nuevas convulsiones que podrían provocar caídas o lesiones o causar angustia al paciente. También se discute si las convulsiones podrían causar un deterioro secundario tras un ictus debido al aumento temporal de la necesidad de perfusión y metabolismo. Esto es especialmente relevante en pacientes con estenosis vascular de alto grado, vasoespasmos, aumento de la presión intracraneal o tras una neurocirugía.
Por otro lado, el tratamiento con ASM también puede tener efectos secundarios. Por ejemplo, los efectos secundarios psiquiátricos podrían reducir la motivación para la neurorrehabilitación y perjudicar así la recuperación tras un ictus. Las interacciones con otros medicamentos, como los anticoagulantes, los antihipertensivos o los fármacos para reducir el colesterol, podrían reducir la eficacia de la terapia y aumentar así el riesgo de episodios cerebrovasculares recurrentes, sobre todo con los ASM inductores de enzimas. En la actualidad aún no está claro si existe una interacción relevante entre los anticoagulantes orales directos y los ASM, ya que existen resultados contradictorios en los estudios. El tratamiento a largo plazo con ASM también puede aumentar el estigma y los costes para los pacientes.
Todavía se está investigando si el tratamiento anticonvulsivo de las crisis sintomáticas agudas tras un ictus podría tener un efecto neuroprotector o antiepileptógeno. Hasta la fecha no existen pruebas claras.
En nuestra opinión, se recomienda una evaluación individual. Seguimos el concepto de “lo bueno, lo malo y lo feo”.
“Lo bueno”: Las convulsiones sintomáticas agudas con un buen pronóstico y un riesgo bajo son aquellas que no se acompañan de una alteración grave de la consciencia ni de fenómenos motores pronunciados y que se producen en pacientes que sólo están ligeramente deteriorados tras el ictus y que no presentan una estenosis vascular de alto grado. Si estas convulsiones se producen una sola vez o rara vez, creemos que no es necesario un tratamiento anticonvulsivo.
“Lo malo”: Si las convulsiones sintomáticas agudas se asocian a un riesgo de lesión o deterioro neurológico, por ejemplo, estenosis de alto grado, vasoespasmo o aumento de la presión intracraneal, debe considerarse un tratamiento supresor de las convulsiones a corto plazo. En estos casos, es aconsejable utilizar ASM que puedan dosificarse rápidamente y tengan un perfil favorable de interacciones y efectos secundarios. > [21] El levetiracetam es el más utilizado en la práctica (en el 90% de los casos) . La segunda opción más común es la lacosamida. El ácido valproico también se utiliza con relativa frecuencia, pero en nuestra opinión tiene un perfil algo más problemático y debería considerarse más bien una terapia de segunda elección.
En estos casos, recomendamos que el tratamiento sólo se administre durante poco tiempo, idealmente de 7 a 14 días. En la práctica, sin embargo, dicho tratamiento se prolonga en algunos centros durante 3 meses, tras los cuales se toma la decisión de interrumpir la terapia en una consulta ambulatoria, que incluye un EEG.
“Lo feo”: En el estado epiléptico agudo sintomático, existe un alto riesgo ( 80%) de epilepsia posterior, mal pronóstico y alta mortalidad [18]. En estos casos, siempre es necesario un tratamiento anticonvulsivo. Debido al alto riesgo de desarrollar epilepsia más adelante en la vida, también puede considerarse un tratamiento supresor de las crisis a más largo plazo. Como mínimo, deben planificarse controles neurológicos regulares.
Además del estado epiléptico sintomático agudo, existen otras situaciones con un alto riesgo (>60%) de epilepsia posterior al ictus. Entre ellas se incluyen las crisis sintomáticas agudas tónico-clónicas el mismo día del ictus, así como ciertas situaciones de alto riesgo, como la aparición de cambios epilepsia-típicos en el EEG precoz. Para una estratificación precisa del riesgo deben utilizarse modelos pronósticos comunes como el SeLECT o el CAVE. Si estos modelos predicen un riesgo de epilepsia posterior superior al 60%, algunos expertos recomiendan un tratamiento anticonvulsivo a largo plazo como si la epilepsia ya estuviera presente. Sin embargo, aún no se ha investigado si esta estrategia es realmente eficaz.
Profilaxis de la epilepsia post-ictus (antiepileptogénesis)
La epilepsia como consecuencia a largo plazo de acontecimientos cerebrovasculares es una de las causas más frecuentes de epilepsia en los ancianos [9]. Aunque el riesgo de epilepsia posterior a un ictus (PSE) en los primeros 10 años tras un ictus isquémico es de alrededor del 12% e incluso se eleva al 30% tras una hemorragia cerebral, estas cifras no justifican una terapia anticonvulsiva como profilaxis sin que se hayan producido realmente crisis epilépticas [10,11]. Sin las pruebas correspondientes, este tipo de terapia profiláctica no puede recomendarse porque los pacientes sufrirán desventajas debido a los efectos secundarios y no tendrán una protección anticonvulsiva significativa. Este problema también se ve agravado por la frecuente politerapia debida a las numerosas comorbilidades en este grupo de edad. Por lo tanto, se necesitan estudios que investiguen la profilaxis farmacológica de la aparición de PSE. Y son precisamente tales estudios los que faltan en la actualidad. Los ensayos realizados hasta la fecha han sido escasos e infructuosos. [12] En la primera década de este siglo, unos colegas de Tel Aviv idearon un diseño compacto y prometedor para la prevención de la epilepsia post-ictus . Eligieron como grupo objetivo a los pacientes con hemorragias intracerebrales, es decir, aquellos con mayor riesgo de desarrollar epilepsia. Y como sustancia farmacológica se utilizó el valproato, un supresor de convulsiones muy potente. Una constelación perfecta desde el primer vistazo para alcanzar el objetivo. Los autores distribuyeron aleatoriamente a 72 pacientes con hemorragias intracerebrales no aneurismáticas en dos grupos a doble ciego. Una mitad (n=36) recibió valproato durante 4 semanas y la otra (n=36) placebo. Se comparó el número de crisis epilépticas en el primer año tras la hemorragia cerebral entre el verum y el placebo y no hubo diferencias estadísticamente significativas entre los dos brazos (19,5% frente a 22,2%, p=0,8).
Otro estudio que se centró en la cuestión de la antiepileptogénesis tras un ictus fue el “Tratamiento precoz con levetiracetam tras un ictus para la prevención de crisis tardías” (ETLAS). Se planificó un estudio multicéntrico, aleatorizado, controlado con placebo y doble ciego en el que participaron pacientes con ictus con un síndrome cortical y una puntuación Rankin modificada ≥3 o NIHSS ≥6. [13] Los participantes fueron tratados con levetiracetam 1500 mg/día o placebo 12 semanas después del ictus y se les realizó un seguimiento durante 1 año . El tratamiento se inició entre 48 horas y 7 días después del acontecimiento índice, y el criterio de valoración primario fue la aparición de una primera crisis epiléptica tardía, definida como una crisis epiléptica no provocada más de una semana después del ictus. Los problemas de reclutamiento hicieron que sólo 16 pacientes (levetiracetam, n=9; placebo; n=7) fueran incluidos en el estudio entre agosto de 2005 y diciembre de 2006 y que sólo un paciente (brazo placebo) desarrollara epilepsia tras el ictus. El reclutamiento fue difícil porque la mayoría de los pacientes cumplían criterios de exclusión o tenían comorbilidades que impedían su participación en el estudio. Debido a estas dificultades, los autores llegaron a la conclusión de que no es posible realizar un estudio de antiepileptogénesis para la prevención de la PSE.
A pesar de los intentos infructuosos de la última década, la prevención de la epileptogénesis tras un ictus sigue siendo un reto científico que motiva nuevos estudios. Los modelos animales experimentales indicaron un potencial efecto antiepileptógeno del acetato de eslicarbazepina (ESL). [14,15] Se planteó la hipótesis de que este efecto se debía a la inhibición eficaz de las corrientes entrantes de alta y baja afinidad hCaV3.2 . Por ejemplo, en un modelo de ratón con pilocarpina de epilepsia crónica, se demostró que el tratamiento transitorio con ESL reducía significativamente la frecuencia y la duración de las descargas epileptiformes en la fase crónica, y se demostró además que el tratamiento con ESL atenuaba la pérdida neuronal y reducía significativamente el deterioro de la coordinación [14]. En este contexto, el Prof. Koepp de Londres junto con el Prof. Trinka de Salzburgo y otros coautores han diseñado un estudio de fase II multicéntrico, aleatorizado, doble ciego y controlado con placebo para probar la hipótesis de un posible efecto preventivo del ESL para el desarrollo de PSE y evaluar si un tratamiento con ESL de un mes puede prevenir las crisis no provocadas tras un ictus [16]. Los pacientes con alto riesgo de desarrollar convulsiones no provocadas tras una hemorragia intracerebral aguda o un ictus isquémico agudo fueron aleatorizados para recibir 800 mg/día de ESL o placebo, iniciándose el tratamiento en las 120 horas siguientes al inicio del ictus primario. El tratamiento se continuó hasta el día 30 y después se interrumpió. Los pacientes pudieron recibir todas las terapias necesarias para el tratamiento del ictus de acuerdo con las directrices de la práctica clínica y los cuidados estándar y se les realizó un seguimiento durante 18 meses. El criterio de valoración primario fue la aparición de una primera crisis no provocada en los 6 meses siguientes a la aleatorización (“tasa de fracaso”). Los criterios secundarios de valoración incluyen la aparición de una primera crisis no provocada en los 12 meses siguientes a la aleatorización y a lo largo del periodo de estudio; resultados funcionales (Índice de Barthel; NIHSS); depresión posterior al ictus (Cuestionario de Salud del Paciente-9; PHQ-9); y supervivencia global. Las evaluaciones de seguridad incluyeron la evaluación de los acontecimientos adversos relacionados con el tratamiento; parámetros de laboratorio; constantes vitales; electrocardiograma; ideación y comportamiento suicida (PHQ-9, pregunta 9). El protocolo pretendía aleatorizar a unos 200 pacientes (1:1) reclutados en 21 centros de siete países europeos e Israel. A pesar de los desafíos, especialmente durante la pandemia de COVID-19, el estudio progresó e inscribió a un número notable de pacientes: 129 fueron seleccionados y 125 aleatorizados. El reclutamiento se interrumpió al cabo de 30 meses y los resultados se esperan en breve.
Terapia para la epilepsia post-ictus
El curso clínico de la PSE es heterogéneo. Además de formas que responden bien a la terapia, también hay casos refractarios a ella. Por lo tanto, es aconsejable una atención neurológica especializada para esta enfermedad. Se requiere la experiencia de un especialista para el diagnóstico diferencial de las crisis epilépticas focales de los acontecimientos cerebrovasculares. Los pacientes, pero también los médicos de otras especialidades, confunden a menudo los fenómenos ictales de reciente aparición con los ataques isquémicos transitorios, lo que puede conducir a decisiones terapéuticas incorrectas. Por lo tanto, se recomienda que los pacientes reciban tratamiento neurológico adicional después de que se haya producido un ictus, ya que esto permite categorizar y tratar correctamente las enfermedades secundarias.
Una vez diagnosticada la PSE, es importante elegir la terapia adecuada para controlar eficazmente las crisis y evitar los efectos secundarios. Dado que no existen directrices específicas para la PSE, la elección de la medicación suele basarse en las recomendaciones para el tratamiento anticonvulsivo de las epilepsias estructurales (focales). Sin embargo, debe tenerse en cuenta la comorbilidad de los pacientes que han sufrido un ictus, ya que a menudo padecen trastornos afectivos y cognitivos (por ejemplo, depresión postictus, demencia vascular). Por tanto, la administración de moduladores de SV2A, por ejemplo, puede conllevar un mayor riesgo de efectos secundarios afectivos. En general, la interrupción inicial de los anticonvulsivos requiere un seguimiento neurológico especializado y su corrección si es necesario. [17] Nuestros estudios han demostrado que el control y la optimización de los supresores convulsivos en el primer año tras la aparición de la PSE conducen a una mejora del 40% en la gravedad de las convulsiones y aumentan significativamente la calidad de vida relacionada con la salud de los pacientes .
Los datos sobre la terapia específica de la PSE son importantes para ayudar a los pacientes de forma rápida y eficaz eligiendo la medicación adecuada. Aunque faltan estudios aleatorizados doble ciego sobre el tratamiento de la PSE, varios estudios observacionales han abordado esta cuestión. Si no en la profilaxis, sí en el tratamiento de la PSE diagnosticada, el ESL ha demostrado ser una sustancia prometedora. Así lo avalan, por ejemplo, los datos del estudio Euro-Esli. [18] Se trata de un análisis de datos agrupados de 14 estudios europeos, que incluyeron un total de 2058 pacientes . En el presente análisis de subgrupos, se conocía información sobre la etiología de 1656 pacientes y 76 (4,6%) de ellos tenían PSE. Se tomaron como parámetros de resultado la ausencia de convulsiones y la tasa de respondedores (reducción ≥50% de la frecuencia de las convulsiones). En la última visita, la tasa de respondedores fue significativamente mayor en los pacientes con epilepsia posterior a un ictus que en los pacientes con otras etiologías de epilepsia (72,9% frente a 60,6%, p=0,04). No hubo diferencias significativas en otros puntos temporales (3, 6 ó 12 meses). La ausencia de crisis fue mayor a favor de la PSE en la mayoría de los puntos temporales (por ejemplo, 48,6% frente a 31,7% en la última visita, p<0,01). La incidencia de acontecimientos adversos fue similar en los pacientes con PSE que en los pacientes con otras epilepsias (36,0% frente a 35,8%; p=0,966). Los autores resumieron que el ESL podría ser una opción de tratamiento eficaz y bien tolerada para los pacientes con crisis focales en PSE.
Nuestro grupo de trabajo se esforzó por presentar un estudio con un diseño comparativo de monoterapia limpia. [19] Se incluyó a un total de 207 pacientes, lo que supone un gran número de pacientes en comparación con otros estudios disponibles . Los comparadores fueron levetiracetam (n=60), lacosamida (n=43), lamotrigina (n=40), eslicarbazepina (n=38), valproato (n=18), topiramato (n=3), zonisamida (n=2), gabapentina (n=2) y carbamazepina n=1). Los resultados mostraron que los ASM con mecanismo de acción por inhibición lenta de los canales de sodio (eslicarbazepina y lacosamida) mostraban la mejor tasa de retención y control de las crisis en comparación con los ASM con otros mecanismos de acción. Como autocrítica, hay que señalar que los supresores de convulsiones más recientes, como el brivaracetam, el perampanel y el cenobamato, no se incluyeron en este estudio porque el tratamiento con estas sustancias aún no estaba generalizado en el momento de la recogida de datos. [20] Ya está disponible el análisis de subgrupos del estudio BRIVAFIRST con 75 pacientes con PSE para el brivaracetam, que muestra una tasa de respuesta del 36-42,7% y una ausencia de crisis del 24-34,7% . En este estudio no se realizó una comparación con otros anticonvulsivos.
Actualmente se dispone de datos sobre el tratamiento del estado epiléptico en la PSE que replican los resultados de nuestro estudio citado anteriormente [19,21,22]. En 138 pacientes de PSE con estado epiléptico refractario, se demostró que los supresores de crisis que actúan mediante la inhibición lenta de los canales de sodio eran los más eficaces para controlar el estado epiléptico [22]. En apoyo de esto, nuestro estudio del uso de ESL para interrumpir el estado epiléptico demostró que la administración de estos inhibidores lentos de los canales de sodio era más eficaz en pacientes con PSE. El estado fue abolido por la aplicación de ESL en el 65,2% de los pacientes con PSE en comparación con el 29,8% en otras formas de epilepsia estructural (29,8%, p<0,01) [21].
Resumen
La epilepsia post-ictus es la forma más común de epilepsia en los ancianos y puede presentar retos diagnósticos y terapéuticos diferenciales. Por este motivo, es importante conocer la presentación clínica de las crisis epilépticas en los ancianos y sus imitaciones. Las crisis sintomáticas agudas tras un acontecimiento cerebrovascular se asocian a un bajo riesgo de recurrencia y, a diferencia de las crisis como primera manifestación de la epilepsia, no suelen ser una indicación de terapia supresora de crisis a largo plazo. El plazo de 7 días se utiliza como directriz, aunque son posibles excepciones en situaciones especiales y la predicción precisa de la probabilidad de recurrencia es objeto de investigación en la actualidad. Como resultado de iniciativas internacionales, se desarrolló el modelo SeLECT para los infartos cerebrales isquémicos, incluida su versión disponible como aplicación para smartphone para su uso junto a la cama del paciente, y el modelo CAVE para los infartos hemorrágicos. Las decisiones sobre la duración de la terapia anticonvulsiva se toman en función del riesgo calculado de recurrencia y los posibles escenarios (“Lo bueno”, “Lo malo” y “Lo feo”) se describen con detalle en este artículo. En cuanto a la prevención de la epileptogénesis tras un ictus, hasta la fecha no se dispone de resultados de investigación positivos, aunque este tema sigue siendo investigado por diversos grupos de investigación. Por el momento, la mayor esperanza reside en los inhibidores lentos de los canales de sodio, como la eslicarbazepina o la lacosamida. En términos de efectos anticonvulsivos, este mecanismo de acción muestra sin duda ventajas en la epilepsia postinfarto, como demuestran los últimos estudios con un diseño abierto.
Mensajes para llevar a casa
- Las convulsiones sintomáticas agudas tras un ictus no suelen requerir una terapia a largo plazo y el límite de tiempo recomendado actualmente en las directrices para diferenciar la epilepsia tras un ictus es de 7 días.
- Se han desarrollado instrumentos validados, como el modelo SeLECT, para una evaluación más precisa del riesgo de recurrencia de ataques epilépticos tras un ictus y están disponibles digitalmente para su uso junto a la cama del paciente.
- En la actualidad no existen pruebas sobre la prevención de la epileptogénesis tras un ictus, aunque se están llevando a cabo intensas investigaciones sobre este tema.
- Nuevos estudios con un diseño abierto proporcionan indicios iniciales de que el mecanismo de acción de la inhibición lenta de los canales de sodio podría tener ventajas sobre otros anticonvulsivos en lo que respecta al efecto anticonvulsivo en la epilepsia posterior a una apoplejía.
Literatura:
- Misra S, Kasner SE, Dawson J, et al: Resultados en pacientes con convulsiones tras un ictus. JAMA Neurol 2023; 80(11): 1155-1165. doi:10.1001/jamaneurol.2023.3240.
- Beghi E, Carpio A, Forsgren L, et al: Recomendación para una definición de crisis sintomática aguda. Epilepsia 2010; 51(4): 671-675. doi:10.1111/j.1528-1167.2009.02285.x.
- Fisher RS, Acevedo C, Arzimanoglou A, et al. Informe oficial de la ILAE: una definición clínica práctica de la epilepsia. Epilepsia 2014; 55(4): 475-482. doi:10.1111/epi.12550.
- Holtkamp M, May TW, Berkenfeld R, et al. Directriz S2k: Primera crisis epiléptica y epilepsias en la edad adulta. DGNeurology. 2024;7(1):21-38. doi:10.1007/s42451-023-00618-z
- Peter-Derex L, Philippeau F, Garnier P, et al: Seguridad y eficacia del levetiracetam profiláctico para la prevención de las crisis epilépticas en la fase aguda de la hemorragia intracerebral (PEACH): un ensayo aleatorizado, doble ciego, controlado con placebo, de fase 3. Lancet Neurology 2022; 21(9):781-791. doi:10.1016/s1474-4422(22)00235-6.
- Galovic M, Döhler N, Erdélyi-Canavese B, et al: Predicción de convulsiones tardías tras un ictus isquémico con un nuevo modelo de pronóstico (la puntuación SeLECT): un estudio de desarrollo y validación de un modelo de predicción multivariable. Lancet Neurol 2018; 17(2): 143-152. doi:10.1016/s1474-4422(17)30404-0.
- Sinka L, Abraira L, Imbach LL, et al: Asociación de la mortalidad y el riesgo de epilepsia con el tipo de crisis sintomática aguda tras un ictus isquémico y un modelo de pronóstico actualizado. JAMA Neurol 2023; 80(6): 605-613. doi:10.1001/jamaneurol.2023.0611.
- Haapaniemi E, Strbian D, Rossi C, et al: La puntuación CAVE para predecir convulsiones tardías tras una hemorragia intracerebral. Stroke. 2014;45(7):1971–1976. doi:10.1161/strokeaha.114.004686
- Cloyd J, Hauser W, Towne A, et al: Aspectos epidemiológicos y médicos de la epilepsia en ancianos. Epilepsy Res 2006 Jan; 68 Suppl 1: S39-48.
- Graham NS, Crichton S, Koutroumanidis M, et al: Incidencia y asociaciones de la epilepsia posterior al ictus: el registro prospectivo de ictus del sur de Londres. Ictus 2013 Mar; 44(3): 605-611.
- Arntz R, Rutten-Jacobs L, Maaijwee N, et al: Epilepsia post-accidente cerebrovascular en adultos jóvenes: un estudio de seguimiento a largo plazo. PLoS One 2013; 8(2): e55498.
- Gilad R, Boaz M, Dabby R, et al: ¿Se previenen las crisis posthemorragia intracerebral con tratamiento antiepiléptico? Epilepsy Res 2011 ago; 95(3): 227-231.
- van Tuijl JH, van Raak EP, de Krom MC, et al: Tratamiento precoz tras un ictus para la prevención de crisis epilépticas tardías: informe sobre los problemas para realizar un ensayo aleatorizado doble ciego controlado con placebo dirigido a la antiepileptogénesis. Seizure 2011; 20: 285-291.
- Doeser A, Dickhof G, Reitze M, et al: Targeting pharmacoresistant epilepsy and epileptogenesis with a dual-purpose antiepileptic drug. Brain 2015; 138: 371-387.
- Soares-da-Silva P, Pires N, Bonifacio MJ, et al: Acetato de eslicarbazepina para el tratamiento de la epilepsia focal: actualización de sus mecanismos de acción propuestos. Pharmacol Res Perspect 2015; 3: e00124.
- Koepp MJ, Trinka E, Mah YH, et al: Antiepileptogenesis after stroke-trials and tribulations: Methodological challenges and recruitment results of a Phase II study with eslicarbazepine acetate. Epilepsia Open 2023 Sep; 8(3): 1190-1201.
- Winter Y, Daneshkhah N, Galland N, et al: Calidad de vida relacionada con la salud en pacientes con epilepsia postictus. Epilepsia y comportamiento 2018; 80: 303-306
- Villanueva V, Holtkamp M, Delanty N, et al: Euro-Esli: una auditoría europea del uso en el mundo real del acetato de eslicarbazepina como tratamiento de las crisis de inicio parcial. J Neurol 2017; 264: 2232-2248.
- Winter Y, Uphaus T, Sandner K, et al: Eficacia y seguridad de la medicación anticonvulsiva en la epilepsia post-ictus. Seizure. 2022 Aug; 100: 109-114.
- Lattanzi S, Canafoglia L, Canevini MP, et al: Miembros del grupo BRIVAFIRST. Brivaracetam as add-on treatment in patients with post-stroke epilepsy: real-world data from the BRIVAracetam add-on First Italian netwoRk Study (BRIVAFIRST). Seizure. 2022 Abr; 97: 37-42.
- Winter Y, Sandner K, Vieth T, Groppa S: Acetato de eslicarbazepina para el tratamiento del estado epiléptico. Epileptic Disord 2023 abr; 25(2): 142-149.
- Winter Y, Sandner K, Vieth T, et al: Medicamentos anticonvulsivos de tercera generación en el tratamiento del estado epiléptico refractario a las benzodiacepinas en la epilepsia postictus: un estudio observacional retrospectivo basado en registros. CNS Drugs 2023 Oct;37(10): 929-936.
HAUSARZT PRAXIS 2024; 19(12): 6–13