As convulsões sintomáticas agudas pós-AVC geralmente não requerem terapia a longo prazo e o limite de tempo recomendado pelas diretrizes actuais para diferenciar a epilepsia após o AVC é de 7 dias. Foram desenvolvidas ferramentas validadas, como o modelo SeLECT, para avaliar com maior precisão o risco de recorrência de crises epilépticas após o AVC e estão disponíveis digitalmente para utilização à cabeceira do doente.
Pode fazer o teste CME na nossa plataforma de aprendizagem depois de rever os materiais recomendados. Clique no botão seguinte:
Uma em cada 20 pessoas na Europa sofrerá um ataque epilético durante a sua vida. Este facto faz com que as crises epilépticas sejam uma das doenças neurológicas mais comuns. As primeiras crises ocorrem com particular frequência na infância e na adolescência, registando-se um patamar de incidência na idade adulta jovem. No entanto, as crises epilépticas são ainda mais frequentes a partir dos 55 anos de idade, após os quais a incidência aumenta de forma constante. A razão para este facto é o envelhecimento do cérebro e a acumulação de várias doenças cerebrais.
O acidente vascular cerebral (AVC) é a causa mais comum de epilepsia com primeira manifestação na idade adulta na Europa. Em pessoas com mais de 65 anos, metade das epilepsias são devidas a doença cerebrovascular. As convulsões após um AVC não são apenas frequentes, mas também relevantes. Estão associadas a uma maior mortalidade, incapacidade e risco de agravamento dos défices cognitivos [1].
Abordagem prática
Se se suspeitar de uma convulsão após um AVC, devem ser esclarecidas três questões principais:
- É um ataque epilético?
- Sofre de epilepsia?
- Que tratamento é adequado nesta situação?
1. é um ataque epilético?
Os diagnósticos diferenciais mais importantes (mímicos) das crises epilépticas neste grupo etário são os ataques isquémicos transitórios (AIT), os episódios neurológicos focais transitórios na angiopatia amiloide (TFNE, também conhecidos como feitiços amilóides ), a síncope e outros fenómenos autonómicos. As convulsões funcionais ou dissociativas e as enxaquecas são menos comuns neste grupo etário.
As crises epilépticas são geralmente episódios curtos que duram cerca de 30 segundos a 2 minutos e que são frequentemente acompanhados de sintomas positivos, como auras visuais, formigueiro, parestesia, mioclonia ou outros fenómenos motores. Em contrapartida, os AIT e os TFNE caracterizam-se por défices neurológicos como paresia, defeitos do campo visual ou perturbações da fala. As perturbações da consciência são típicas das crises epilépticas, mas raramente ocorrem nos diagnósticos diferenciais mencionados. Uma duração superior a 15 minutos é atípica para as crises epilépticas e é mais indicativa de AIT, TFNE ou outras perturbações neurológicas, como uma aura de enxaqueca.
No entanto, deve ter em atenção que as crises epilépticas em pessoas idosas são frequentemente oligossintomáticas. Uma manifestação típica é uma crise focal, inconsciente, caracterizada por uma pausa e um olhar fixo. Este tipo de crise pode facilmente passar despercebido e requer uma observação atenta e uma reação específica da pessoa afetada durante a crise. Depois disso, ocorrem frequentemente perturbações pós-ictais, como confusão.
A diferenciação diagnóstica baseia-se geralmente numa história clínica exaustiva e na observação externa, mas é frequentemente difícil. A deteção de alterações típicas da epilepsia no EEG interictal, o registo de um vídeo-EEG ictal e a diferenciação de diagnósticos diferenciais utilizando a ressonância magnética podem ser úteis. A sensibilidade de um EEG interictal curto de rotina para detetar potenciais típicos de epilepsia é de apenas 20-30% e não é suficiente para excluir a epilepsia em caso de resultados negativos. A sensibilidade pode ser aumentada até 70% através do registo precoce, de EEGs repetidos e da realização de um EEG de longa duração durante a noite.
2 O doente sofre de epilepsia?
Se for claro que se trata de uma crise epilética, deve ser esclarecido se a crise foi provocada ou não provocada (Tabela 1). O lema é: “Toda a gente com epilepsia tem crises, mas nem toda a gente com crises tem epilepsia.”
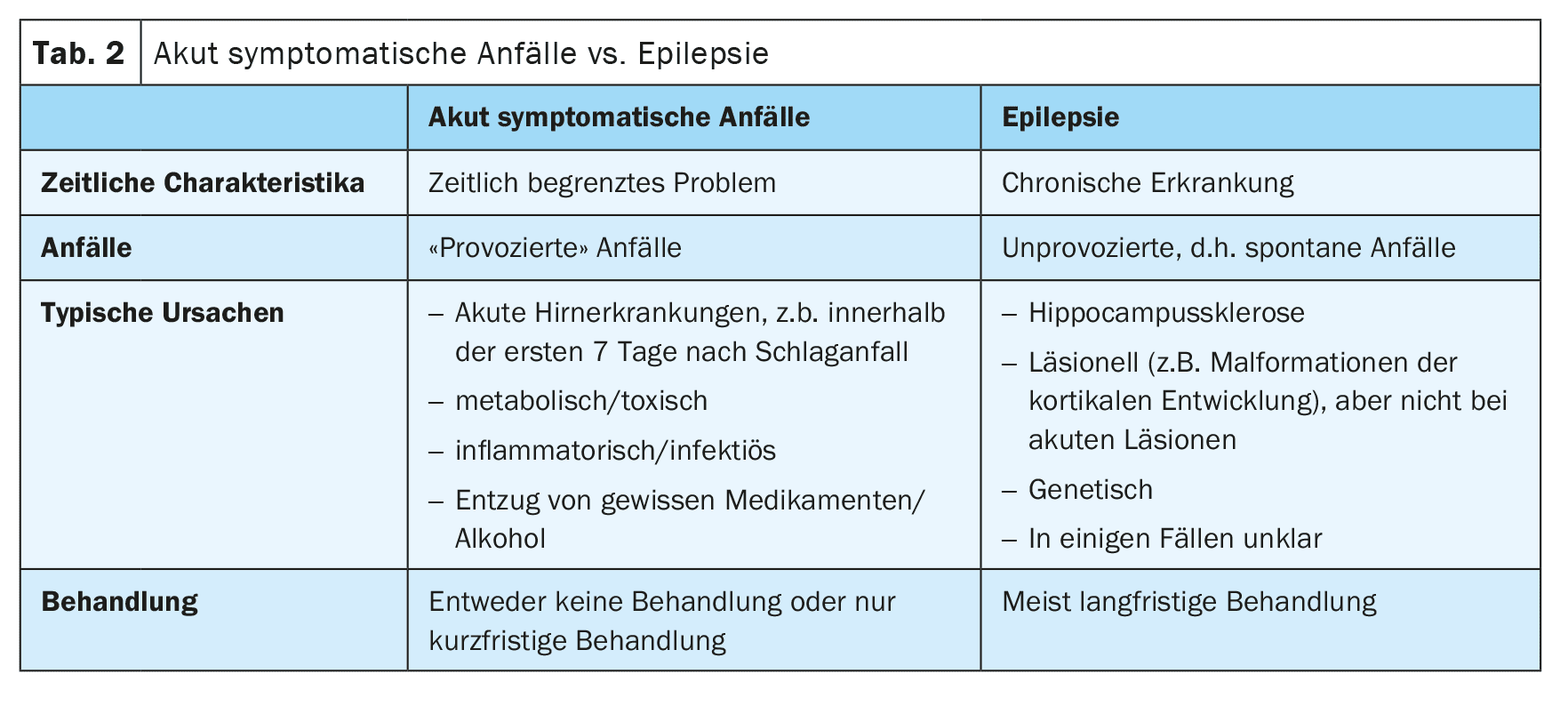
Atualmente, designamos as crises provocadas por “crises sintomáticas agudas” [2]. Estas ocorrem em estreita ligação temporal com uma doença cerebral ou uma perturbação metabólica, tóxica ou inflamatória. As crises epilépticas que ocorrem nos primeiros 7 dias após um AVC são consideradas sintomáticas agudas. A razão para tal é que estas crises são desencadeadas por alterações tóxicas e inflamatórias agudas no contexto do AVC e não são uma expressão de epilepsia subjacente. Por conseguinte, o risco de convulsões subsequentes não provocadas é bastante reduzido. No entanto, o limite de 7 dias não está bem estabelecido e dados recentes não publicados sugerem que as convulsões no primeiro mês também estão associadas a um baixo risco de convulsões subsequentes não provocadas e, por conseguinte, também podem ser consideradas como agudamente sintomáticas (Tabela 2).
Em contrapartida, as convulsões que ocorrem mais tarde após um AVC são consideradas não provocadas, a menos que tenham sido desencadeadas por outros factores, como a hiponatrémia. Se uma crise não provocada tiver sido provavelmente causada pelo AVC subjacente, ou seja, se tiver uma semiologia correspondente, existe um elevado risco de recorrência de mais de 60% de novas crises não provocadas nos 10 anos seguintes. Por esta razão, de acordo com as diretrizes actuais, o diagnóstico de epilepsia estrutural pode ser feito após uma primeira crise epilética não provocada após um AVC [3].
3. que tratamento é adequado nesta situação?
A distinção entre crises sintomáticas agudas e epilepsia estrutural é crucial, pois as abordagens terapêuticas são muito diferentes. Uma descrição detalhada do tratamento destas duas entidades é apresentada mais adiante neste artigo.
Em resumo, as diretrizes não recomendam nenhum tratamento ou apenas um tratamento a curto prazo de crises sintomáticas agudas, enquanto a epilepsia geralmente requer tratamento a longo prazo (Fig. 1) [4]. Se o tratamento for iniciado após uma crise sintomática aguda, ele deve ser relativamente agressivo e com um medicamento de ação rápida. A razão para isso é que o risco de convulsões é maior nos primeiros dias após um AVC e diminui rapidamente depois disso. Em contrapartida, o tratamento da epilepsia nos idosos segue o princípio ” começar devagar, ir devagar”, uma vez que a depuração dos fármacos antiepilépticos (FAE) é reduzida na velhice.
Riscos após crises sintomáticas agudas
Cerca de 40% a 50% das primeiras crises epilépticas são agudamente sintomáticas. A doença cerebrovascular é uma das causas mais comuns de crises sintomáticas agudas, particularmente em pessoas idosas. As convulsões são particularmente comuns em doentes tratados em unidades de cuidados intensivos após um AVC, com cerca de 20-30% destes doentes a sofrerem convulsões. No entanto, muitas destas convulsões não são convulsivas, apresentam apenas sintomas ligeiros ou são completamente subclínicas.
Se for efectuada uma monitorização contínua do EEG, podem ser detectadas mais convulsões. Num estudo prospetivo após uma hemorragia intracerebral, foram detectadas crises subclínicas em quase metade dos doentes [5]. Ainda não é claro se as crises subclínicas têm um significado semelhante ao das crises clínicas. No entanto, há evidências de que as crises subclínicas estão associadas a um risco igualmente elevado de desenvolvimento posterior de epilepsia e de mau resultado como as crises clínicas. Por conseguinte, o tratamento das crises subclínicas deve provavelmente ser semelhante ao tratamento das crises clínicas.
Risco de desenvolver epilepsia: As crises sintomáticas agudas não são sinónimo de epilepsia, uma vez que são desencadeadas por uma lesão cerebral aguda. No entanto, indicam que a pessoa afetada pode ter um limiar convulsivo baixo e que o AVC activou uma rede potencialmente epilética que pode mais tarde contribuir para o desenvolvimento de epilepsia. As crises sintomáticas agudas são, portanto, o fator de risco mais importante para o desenvolvimento de epilepsia após um AVC.
Nas pessoas que sofreram uma crise sintomática aguda, o risco de epilepsia posterior é de cerca de 20–40%. O risco mais elevado, superior a 80%, é observado em doentes que sofreram um estado epilético agudo sintomático. Pensa-se também que existe um risco acrescido de cerca de 60–70% em doentes com uma crise sintomática aguda tónico-clónica no dia do AVC.
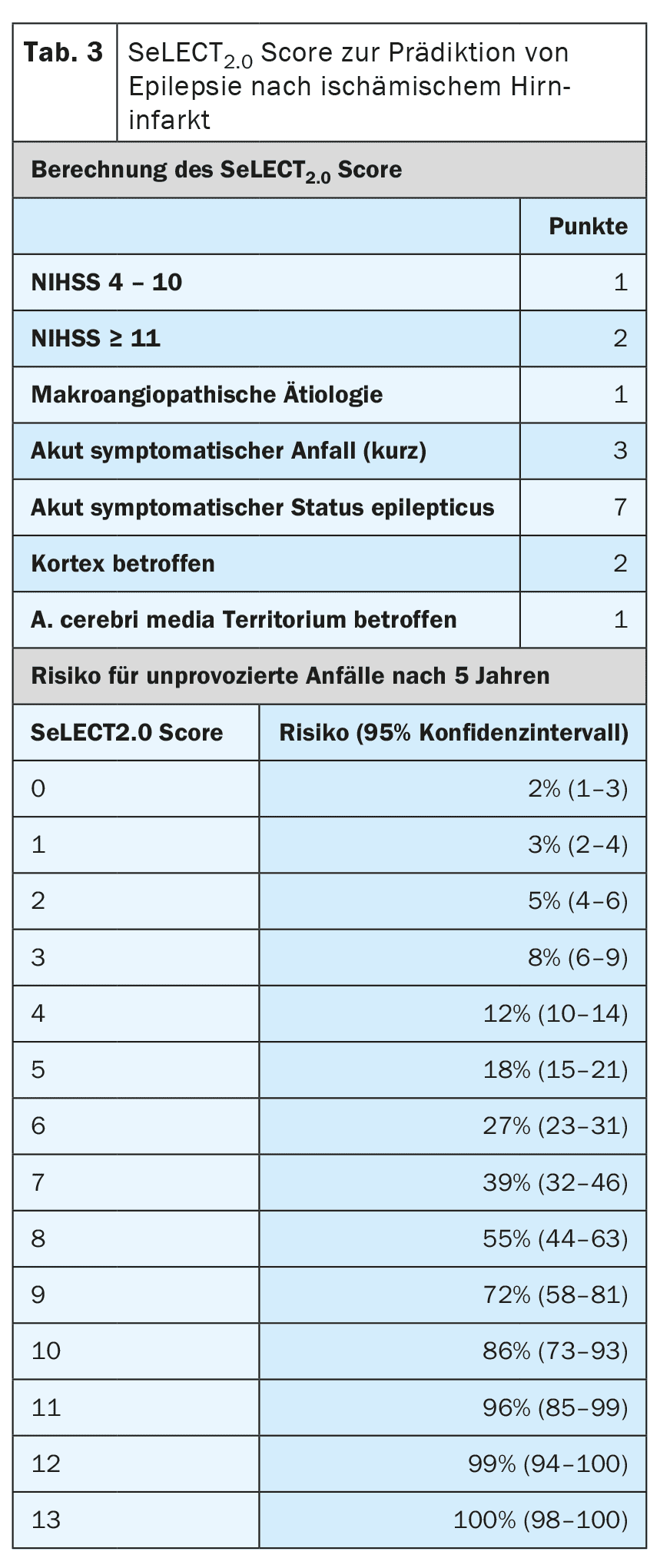
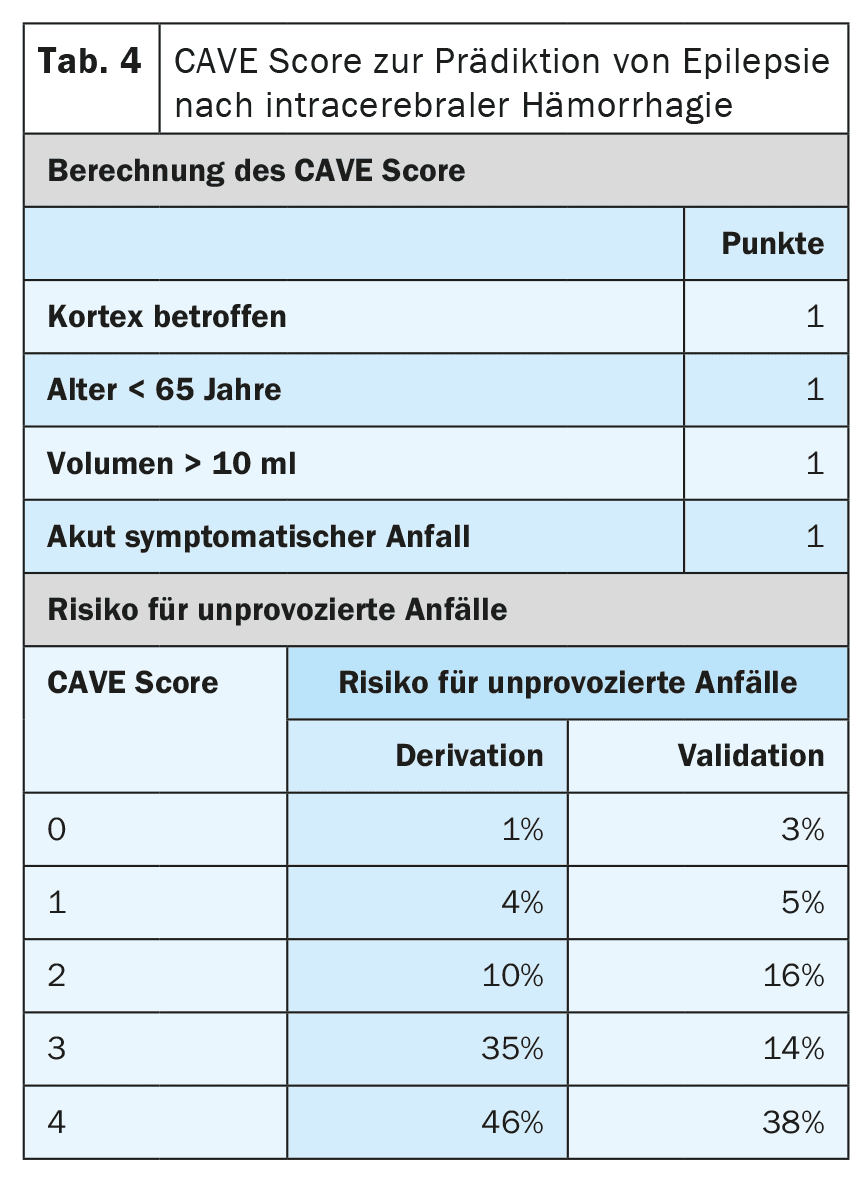
Outros factores de risco para o desenvolvimento de epilepsia após um AVC são o tipo, a localização, a gravidade e a etiologia do enfarte. Existem atualmente modelos de prognóstico muito bem validados que podem prever o risco com um elevado grau de precisão. [6,7] O modelo SeLECT (Tabela 3) é recomendado para os enfartes cerebrais isquémicos, enquanto o modelo CAVE (Tabela 4) é recomendado para os enfartes hemorrágicos [8]. Está disponível uma aplicação para smartphone para o modelo SeLECT com o nome SeLECT Score , que facilita o cálculo à cabeceira do doente.
[20]Impacto no resultado: As convulsões pós-AVC estão associadas a um pior resultado, incluindo maior mortalidade, maior incapacidade e um risco acrescido de perturbações cognitivas, incluindo demência. Estes efeitos são muito mais pronunciados nas crises sintomáticas agudas do que nas crises não provocadas que ocorrem mais tarde. O pior resultado ocorre após um status epilepticus sintomático agudo, que aumenta dez vezes o risco de mortalidade. No entanto, na maioria dos casos, a razão para a morte num estado epilético sintomático agudo é a retirada do tratamento ou uma abordagem paliativa.É importante sublinhar que estas correlações representam uma associação e não necessariamente uma causalidade. Por outras palavras, as convulsões após um AVC são um indicador de danos cerebrais particularmente graves causados pelo enfarte. É questionável se o tratamento de supressão de convulsões melhora o resultado. A maioria dos estudos tende a indicar que o resultado não é melhorado.
Tratamento de crises sintomáticas agudas
Existem poucas provas sólidas para o tratamento das crises agudas sintomáticas, mas muitas incertezas e mal-entendidos. A atual diretriz da DGN recomenda principalmente que as crises agudas sintomáticas não devem ser tratadas [4]. A principal razão apresentada para este facto é que se deve evitar o sobretratamento frequente. Se, apesar disso, for iniciado um tratamento após uma avaliação individual, este só deve ser efectuado a curto prazo e durante a fase aguda, ou seja, nos primeiros 7 a 14 dias após o AVC. Recomenda-se também a utilização de modelos de prognóstico como o SeLECT ou a pontuação CAVE para a avaliação individual.
No entanto, a realidade difere consideravelmente das recomendações das diretrizes. Registos de prognóstico da Alemanha e dos EUA, bem como inquéritos internacionais, mostram que 9 em cada 10 doentes com convulsões sintomáticas agudas são tratados com MSA. Cerca de metade destes doentes recebem tratamento durante vários meses e até um terço são tratados com MAPA a longo prazo. A maioria destes dados provém de centros especializados, pelo que os números reais na população em geral podem ser ainda mais elevados. Existe, portanto, uma clara discrepância entre as recomendações das diretrizes e a prática clínica.
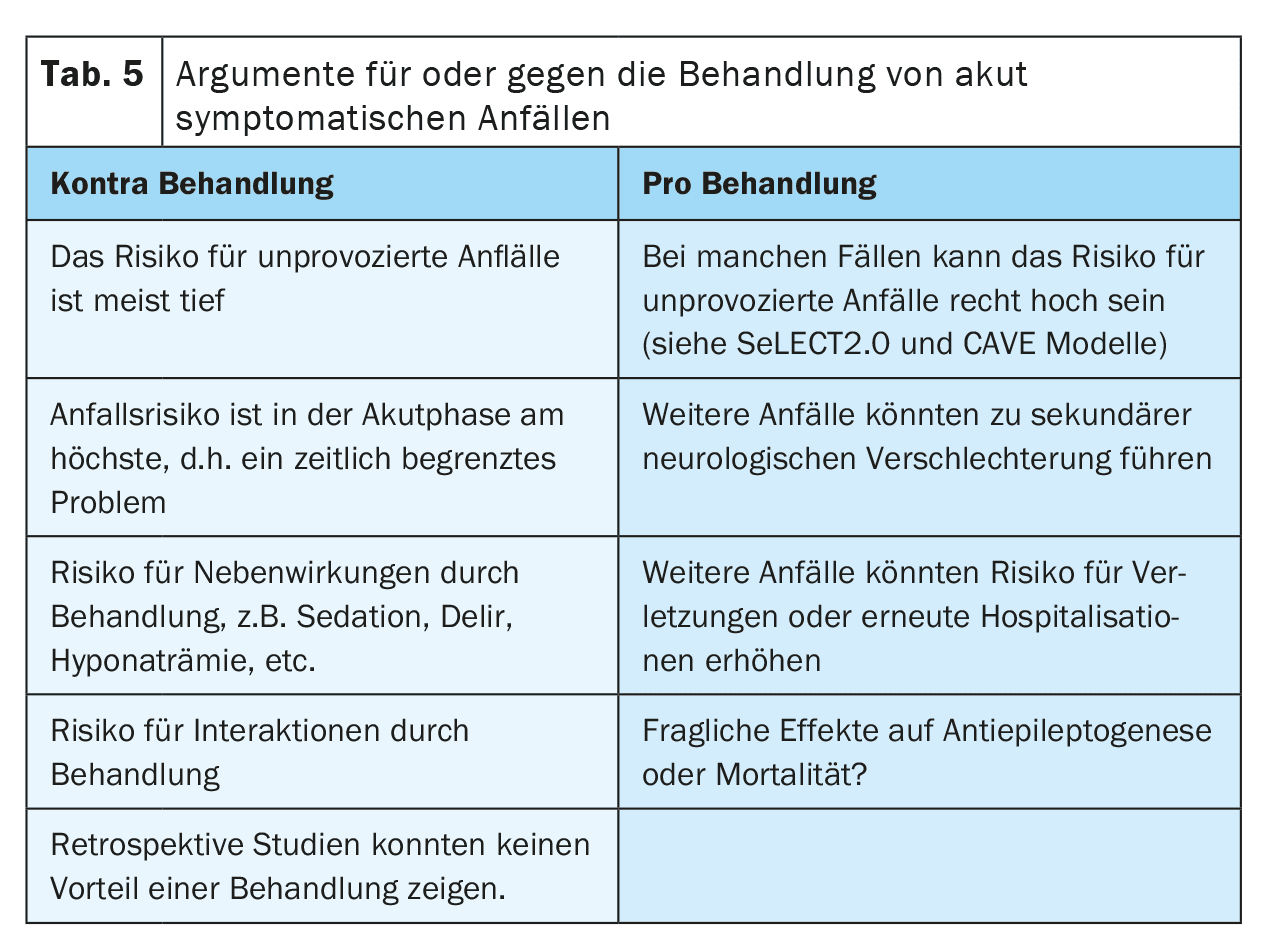
Existem vários argumentos a favor ou contra o tratamento de crises agudas sintomáticas com MSA (Tabela 5). Um dos argumentos a favor do tratamento é o receio de novas convulsões que possam levar a quedas ou lesões ou causar angústia ao doente. Discute-se também se as convulsões podem causar uma deterioração secundária após um AVC devido ao aumento temporário da necessidade de perfusão e metabolismo. Isto é particularmente relevante em doentes com estenose vascular de alto grau, vasoespasmo, aumento da pressão intracraniana ou após neurocirurgia.
Por outro lado, o tratamento com MAPE também pode ter efeitos secundários. Por exemplo, os efeitos secundários psiquiátricos podem reduzir a motivação para a neuroreabilitação, prejudicando assim a recuperação após um AVC. As interações com outros medicamentos, como os anticoagulantes, os anti-hipertensores ou os medicamentos para baixar o colesterol, podem reduzir a eficácia da terapêutica e, assim, aumentar o risco de eventos cerebrovasculares recorrentes, em especial com os ASM indutores de enzimas. Atualmente, ainda não é claro se existe uma interação relevante entre os anticoagulantes orais diretos e os ASM, uma vez que existem resultados de estudos contraditórios. O tratamento a longo prazo com ASMs pode também aumentar o estigma e os custos para os doentes.
Ainda está a ser investigado se o tratamento supressor das crises sintomáticas agudas após um AVC pode ter um efeito neuroprotector ou antiepileptogénico. Até à data, não existem provas claras.
Na nossa opinião, recomenda-se uma avaliação individual. Seguimos o conceito de “O Bom, o Mau e o Feio”.
“The Good”: As convulsões sintomáticas agudas com bom prognóstico e baixo risco são aquelas que não são acompanhadas de perturbações graves da consciência ou de fenómenos motores pronunciados e que ocorrem em doentes que estão apenas ligeiramente debilitados após o AVC e que não têm estenose vascular de alto grau. Se estas crises ocorrerem apenas uma vez ou raramente, pensamos que não é necessário um tratamento de supressão de crises.
“O Mau”: Se as convulsões sintomáticas agudas estiverem associadas a um risco de lesão ou deterioração neurológica, por exemplo, estenose de alto grau, vasoespasmo ou aumento da pressão intracraniana, deve ser considerado um tratamento supressor de convulsões a curto prazo. Nestes casos, é aconselhável usar ASMs que possam ser doseados rapidamente e que tenham um perfil favorável de interação e de efeitos secundários. > [21] O levetiracetam é o mais frequentemente utilizado na prática (em 90% dos casos). A segunda escolha mais comum é a lacosamida. O ácido valpróico também é utilizado com relativa frequência, mas, em nossa opinião, tem um perfil um pouco mais problemático e deve ser considerado como uma terapia de segunda escolha.
Nestes casos, recomendamos que o tratamento seja efectuado apenas por um curto período de tempo, idealmente durante 7 a 14 dias. No entanto, na prática, em alguns centros, o tratamento é continuado durante 3 meses, após os quais a decisão de interromper a terapêutica é tomada numa consulta externa, incluindo um EEG.
“O Feio”: No estado de mal epilético agudamente sintomático, existe um risco elevado (80%) de epilepsia subsequente, mau resultado e mortalidade elevada [18]. Nestes casos, é sempre necessário um tratamento supressor das crises. Devido ao elevado risco de desenvolver epilepsia numa fase posterior da vida, pode também ser considerado um tratamento supressor das crises a longo prazo. No mínimo, devem ser planeados controlos neurológicos regulares.
Para além do status epilepticus sintomático agudo, existem outras situações com um risco elevado (>60%) de epilepsia subsequente após o AVC. Estas incluem as crises sintomáticas agudas tónico-clónicas no mesmo dia do AVC, bem como certas situações de alto risco, como a ocorrência de alterações típicas da epilepsia no EEG inicial. Para uma estratificação precisa do risco, devem ser utilizados modelos de prognóstico comuns, como o SeLECT ou o CAVE. Se estes modelos prevêem um risco superior a 60% de epilepsia posterior, alguns especialistas recomendam um tratamento supressor de crises a longo prazo, como se a epilepsia já estivesse presente. No entanto, ainda não foi investigado se esta estratégia é efetivamente eficaz.
Profilaxia da epilepsia pós-acidente vascular cerebral (antiepileptogénese)
A epilepsia como consequência a longo prazo de eventos cerebrovasculares é uma das causas mais comuns de epilepsia nos idosos [9]. Embora o risco de epilepsia pós-AVC (EEP) nos primeiros 10 anos após um AVC isquémico seja de cerca de 12% e aumente até 30% após uma hemorragia cerebral, estes números não justificam a terapia de supressão de crises como profilaxia sem que tenham efetivamente ocorrido crises epilépticas [10,11]. Sem as provas correspondentes, esta terapia profiláctica não pode ser recomendada porque os doentes sofrerão desvantagens devido aos efeitos secundários e à ausência de uma proteção significativa contra as crises. Este problema é também exacerbado pela politerapia frequente devido a numerosas comorbilidades neste grupo etário. Por conseguinte, são necessários estudos para investigar a profilaxia farmacológica da ocorrência de PSE. E são precisamente esses estudos que faltam atualmente. Os ensaios realizados até à data têm sido raros e sem sucesso. Na primeira década deste século, colegas de Tel Aviv criaram um projeto compacto e promissor para a prevenção da epilepsia pós-AVC [12]. Escolheram como grupo-alvo os pacientes com hemorragias intracerebrais, ou seja, aqueles com maior risco de desenvolver epilepsia. E o valproato, um potente supressor de convulsões, foi utilizado como substância farmacológica. Uma constelação perfeita, desde o primeiro olhar, para atingir o objetivo. Os autores dividiram aleatoriamente 72 doentes com hemorragias intracerebrais não aneurismáticas em dois grupos, de forma duplamente cega. Uma metade (n=36) recebeu valproato durante 4 semanas e a outra (n=36) placebo. O número de crises epilépticas no primeiro ano após a hemorragia cerebral foi comparado entre valproato e placebo e não houve diferença estatisticamente significativa entre os dois braços (19,5% vs 22,2%, p=0,8).
Outro estudo que se centrou na questão da antiepileptogénese após o AVC foi o “Early Treatment with Levetiracetam After Stroke for the prevention of late seizures” (ETLAS). Foi planeado um estudo multicêntrico, aleatório, controlado por placebo e em dupla ocultação, no qual participaram doentes com AVC com uma síndrome cortical e uma pontuação Rankin modificada ≥3 ou NIHSS ≥6. [13] Os participantes foram tratados com levetiracetam 1500 mg/dia ou placebo 12 semanas após o AVC e seguidos durante 1 ano. O tratamento foi iniciado entre 48 horas e 7 dias após o evento índice, e o endpoint primário foi a ocorrência de uma primeira crise epilética tardia, definida como uma crise epilética não provocada mais de uma semana após o AVC. Problemas de recrutamento fizeram com que apenas 16 doentes (levetiracetam, n=9; placebo; n=7) fossem incluídos no estudo entre agosto de 2005 e dezembro de 2006 e que apenas um doente (braço placebo) desenvolvesse epilepsia pós-AVC. O recrutamento foi dificultado pelo facto de a maioria dos doentes preencher critérios de exclusão ou ter comorbilidades que impediam a participação no estudo. Devido a estas dificuldades, os autores chegaram à conclusão de que não é possível realizar um estudo anti-epileptogénico para a prevenção da PSE.
Apesar das tentativas infrutíferas da última década, a prevenção da epileptogénese após um AVC continua a ser um desafio científico que motiva novos estudos. Modelos animais experimentais indicaram um potencial efeito antiepileptogénico do acetato de eslicarbazepina (ESL). A hipótese é que este efeito se deve à inibição efectiva das correntes de entrada hCaV3.2 de alta e baixa afinidade [14,15]. Por exemplo, num modelo de epilepsia crónica em ratos com pilocarpina, o tratamento transitório com ESL demonstrou reduzir significativamente a frequência e a duração das descargas epileptiformes na fase crónica, tendo sido também demonstrado que o tratamento com ESL atenuava a perda neuronal e reduzia significativamente a perturbação da coordenação [14]. Neste contexto, o Prof. Koepp de Londres, juntamente com o Prof. Trinka de Salzburgo e outros co-autores, conceberam um estudo multicêntrico, aleatório, em dupla ocultação e controlado por placebo, de fase II, para testar a hipótese de um possível efeito preventivo do ESL no desenvolvimento da PSE e para avaliar se um tratamento de um mês com ESL pode prevenir convulsões não provocadas após um AVC [16]. Os doentes com elevado risco de desenvolver convulsões não provocadas na sequência de uma hemorragia intracerebral aguda ou de um acidente vascular cerebral isquémico agudo foram aleatoriamente selecionados para receber 800 mg/d de ESL ou placebo, tendo o tratamento começado nas 120 horas seguintes ao início do acidente vascular cerebral primário. O tratamento foi continuado até ao dia 30 e depois interrompido. Os doentes puderam receber todas as terapias necessárias para o tratamento do AVC, de acordo com as diretrizes da prática clínica e o padrão de cuidados, e foram acompanhados durante 18 meses. O endpoint primário foi a ocorrência de uma primeira convulsão não provocada no prazo de 6 meses após a aleatorização (“taxa de insucesso”). Os endpoints secundários incluem a ocorrência de uma primeira convulsão não provocada nos 12 meses após a aleatorização e durante todo o período do estudo; resultados funcionais (Índice de Barthel; NIHSS); depressão pós-AVC (Patient Health Questionnaire-9; PHQ-9); e sobrevivência global. As avaliações de segurança incluíram a avaliação de acontecimentos adversos relacionados com o tratamento; parâmetros laboratoriais; sinais vitais; eletrocardiograma; ideação e comportamento suicidas (PHQ-9, questão 9). O protocolo tinha como objetivo aleatorizar aproximadamente 200 doentes (1:1) recrutados em 21 centros em sete países europeus e em Israel. Apesar dos desafios, especialmente durante a pandemia de COVID-19, o estudo progrediu e inscreveu um número notável de doentes: 129 foram rastreados e 125 foram aleatorizados. O recrutamento foi interrompido após 30 meses e os resultados são esperados em breve.
Terapia para a epilepsia pós-acidente vascular cerebral
O curso clínico da PSE é heterogéneo. Para além das formas que respondem bem à terapêutica, existem também casos refractários à mesma. Por isso, são aconselháveis cuidados neurológicos especializados para esta doença. Para o diagnóstico diferencial entre crises epilépticas focais e eventos cerebrovasculares, é necessária a experiência de um especialista. Os doentes, mas também os médicos de outras especialidades, confundem frequentemente os fenómenos ictais que ocorrem recentemente com ataques isquémicos transitórios, o que pode levar a decisões terapêuticas incorrectas. Recomenda-se, portanto, que os doentes recebam tratamento neurológico adicional após um AVC, uma vez que isso permite que as doenças secundárias sejam corretamente classificadas e tratadas.
Uma vez diagnosticada a PSE, é importante escolher a terapêutica correta para controlar eficazmente as crises e evitar os efeitos secundários. Uma vez que não existem diretrizes específicas para a PSE, a escolha da medicação baseia-se geralmente nas recomendações para a terapêutica supressora de crises nas epilepsias estruturais (focais). No entanto, esta deve ter em conta a comorbilidade dos doentes com AVC, uma vez que estes sofrem frequentemente de perturbações afectivas e cognitivas (por exemplo, depressão pós-AVC, demência vascular). A administração de moduladores SV2A, por exemplo, pode levar a um aumento do risco de efeitos secundários afectivos. Em geral, a interrupção inicial dos supressores de convulsões requer um acompanhamento neurológico especializado e, se necessário, uma correção. Os nossos estudos demonstraram que o controlo e a otimização dos supressores de crises no primeiro ano após o início da PSE conduzem a uma melhoria de 40% na gravidade das crises e aumentam significativamente a qualidade de vida relacionada com a saúde dos doentes [17].
Os dados sobre a terapia específica da PSE são importantes para ajudar os doentes de forma rápida e eficaz, escolhendo a medicação correta. Embora não existam estudos aleatórios em dupla ocultação sobre o tratamento da PSE, vários estudos observacionais abordaram esta questão. Se não na profilaxia, então no tratamento da PSE diagnosticada, o ESL demonstrou ser uma substância promissora. Este facto é apoiado, por exemplo, pelos dados do estudo Euro-Esli. [18] Trata-se de uma análise de dados agrupados de 14 estudos europeus, que incluíram um total de 2058 doentes. Na atual análise de subgrupo, a informação sobre a etiologia era conhecida para 1656 doentes e 76 (4,6%) destes tinham PSE. A ausência de convulsões e a taxa de resposta (≥50% de redução na frequência das convulsões) foram consideradas como parâmetros de resultado. Na última visita, a taxa de resposta foi significativamente mais elevada nos doentes com epilepsia pós-AVC do que nos doentes com outras etiologias de epilepsia (72,9% vs. 60,6%, p=0,04). Não se registaram diferenças significativas noutros momentos (3, 6 ou 12 meses). A liberdade de convulsões foi maior a favor do PSE na maioria dos momentos (por exemplo, 48,6% vs. 31,7% na última visita, p<0,01). A incidência de eventos adversos foi semelhante nos doentes com PSE e nos doentes com outras epilepsias (36,0% vs. 35,8%; p=0,966). Os autores resumiram que o ESL pode ser uma opção de tratamento eficaz e bem tolerada para doentes com crises focais na PSE.
O nosso grupo de trabalho esforçou-se por apresentar um estudo com um desenho comparativo de monoterapia simples. [19] Foi incluído um total de 207 doentes, o que representa um grande número de doentes em comparação com outros estudos disponíveis. Os comparadores foram o levetiracetam (n=60), a lacosamida (n=43), a lamotrigina (n=40), a eslicarbazepina (n=38), o valproato (n=18), o topiramato (n=3), a zonisamida (n=2), a gabapentina (n=2) e a carbamazepina (n=1). Os resultados mostraram que os medicamentos com mecanismo de ação através da inibição lenta dos canais de sódio (eslicarbazepina e lacosamida) apresentaram a melhor taxa de retenção e controlo das crises em comparação com os medicamentos com outros mecanismos de ação. Como autocrítica, é de notar que os supressores de crises mais recentes, como o brivaracetam, o perampanel e o cenobamato, não foram incluídos neste estudo porque o tratamento com estas substâncias ainda não estava generalizado na altura da recolha de dados. [20] A análise de subgrupo do estudo BRIVAFIRST com 75 pacientes com PSE está agora disponível para o brivaracetam, que mostra uma taxa de resposta de 36-42,7% e 24-34,7% de liberdade de convulsões. Neste estudo não foi efectuada uma comparação com outros supressores de crises.
Atualmente, estão disponíveis dados sobre o tratamento do estado de mal epilético na PSE que reproduzem os resultados do nosso estudo acima referido [19,21,22]. Em 138 doentes com PSE com status epilepticus refratário, foi demonstrado que os supressores de convulsões que actuam através da inibição lenta dos canais de sódio foram mais eficazes no controlo do status epilepticus [22]. Em apoio a este facto, o nosso estudo sobre a utilização de ESL para interromper o status epilepticus mostrou que a administração destes inibidores lentos dos canais de sódio foi mais eficaz em doentes com PSE. O estado foi abolido pela aplicação de ESL em 65,2% dos doentes com PSE, em comparação com 29,8% noutras formas de epilepsia estrutural (29,8%, p<0,01) [21].
Resumo
A epilepsia pós-AVC é a forma mais comum de epilepsia no idoso e pode apresentar desafios diagnósticos diferenciais e terapêuticos. Por este motivo, é importante conhecer a apresentação clínica das crises epilépticas no idoso e os seus mímicos. As crises sintomáticas agudas que se seguem a um evento cerebrovascular estão associadas a um baixo risco de recorrência e, ao contrário das crises como primeira manifestação de epilepsia, não são habitualmente uma indicação para terapêutica supressora de crises a longo prazo. O prazo de 7 dias é utilizado como orientação, embora sejam possíveis excepções em situações especiais e uma previsão precisa da probabilidade de recorrência seja objeto de investigação atual. Na sequência de iniciativas internacionais, foram desenvolvidos o modelo SeLECT para os enfartes cerebrais isquémicos, incluindo a sua versão disponível como aplicação para smartphone para utilização à cabeceira do doente, e o modelo CAVE para os enfartes hemorrágicos. As decisões sobre a duração da terapia de supressão de crises são tomadas com base no risco calculado de recorrência e os cenários possíveis (“O Bom”, “O Mau” e “O Feio”) são descritos em pormenor neste artigo. No que diz respeito à prevenção da epileptogénese após um AVC, não existem resultados de investigação positivos até à data, embora este tópico continue a ser investigado por vários grupos de investigação. Atualmente, a maior esperança reside nos inibidores lentos dos canais de sódio, como a eslicarbazepina ou a lacosamida. Em termos de efeitos supressores das crises, este mecanismo de ação apresenta certamente vantagens na epilepsia pós-AVC, como demonstram os últimos estudos com um desenho aberto.
Mensagens para levar para casa
- As convulsões sintomáticas agudas pós-AVC geralmente não requerem uma terapia a longo prazo e o limite de tempo atualmente recomendado nas diretrizes para diferenciar a epilepsia após o AVC é de 7 dias.
- Foram desenvolvidos instrumentos validados, como o modelo SeLECT, para uma avaliação mais precisa do risco de recorrência de crises epilépticas após um AVC e estão disponíveis digitalmente para utilização à cabeceira do doente.
- Atualmente, não existem provas sobre a prevenção da epileptogénese após um acidente vascular cerebral, embora esteja a ser realizada uma investigação intensiva sobre este tema.
- Novos estudos com um desenho aberto fornecem indicações iniciais de que o mecanismo de ação da inibição lenta dos canais de sódio pode ter vantagens sobre outros supressores de convulsões no que diz respeito ao efeito supressor de convulsões na epilepsia pós-AVC.
Literatura:
- Misra S, Kasner SE, Dawson J, et al: Resultados em pacientes com convulsões pós-AVC. JAMA Neurol 2023; 80(11): 1155-1165. doi:10.1001/jamaneurol.2023.3240.
- Beghi E, Carpio A, Forsgren L, et al: Recomendação para uma definição de convulsão sintomática aguda. Epilepsia 2010; 51(4): 671-675. doi:10.1111/j.1528-1167.2009.02285.x.
- Fisher RS, Acevedo C, Arzimanoglou A, et al. Relatório oficial da ILAE: uma definição clínica prática de epilepsia. Epilepsia 2014; 55(4): 475-482. doi:10.1111/epi.12550.
- Holtkamp M, May TW, Berkenfeld R, et al. S2k guideline: First epileptic seizure and epilepsies in adulthood (Primeira crise epilética e epilepsias na idade adulta). DGNeurology. 2024;7(1):21-38. doi:10.1007/s42451-023-00618-z
- Peter-Derex L, Philippeau F, Garnier P, et al: Segurança e eficácia do levetiracetam profilático para a prevenção de crises epilépticas na fase aguda da hemorragia intracerebral (PEACH): um ensaio de fase 3 aleatório, em dupla ocultação, controlado por placebo. Lancet Neurology 2022; 21(9):781-791. doi:10.1016/s1474-4422(22)00235-6.
- Galovic M, Döhler N, Erdélyi-Canavese B, et al: Previsão de convulsões tardias após acidente vascular cerebral isquémico com um novo modelo de prognóstico (a pontuação SeLECT): um estudo de desenvolvimento e validação de modelo de previsão multivariável. Lancet Neurol 2018; 17(2): 143-152. doi:10.1016/s1474-4422(17)30404-0.
- Sinka L, Abraira L, Imbach LL, et al: Associação de Mortalidade e Risco de Epilepsia com Tipo de Convulsão Sintomática Aguda Após Acidente Vascular Cerebral Isquémico e um Modelo de Prognóstico Atualizado. JAMA Neurol 2023; 80(6): 605-613. doi:10.1001/jamaneurol.2023.0611.
- Haapaniemi E, Strbian D, Rossi C, et al: The CAVE score for predicting late seizures after intracerebral hemorrhage. Stroke. 2014;45(7):1971–1976. doi:10.1161/strokeaha.114.004686
- Cloyd J, Hauser W, Towne A, et al: Epidemiological and medical aspects of epilepsy in the elderly. Epilepsy Res 2006 Jan; 68 Suppl 1: S39-48.
- Graham NS, Crichton S, Koutroumanidis M, et al: Incidência e associações de epilepsia pós-AVC: o registo prospetivo do AVC no sul de Londres. Stroke 2013 Mar; 44(3): 605-611.
- Arntz R, Rutten-Jacobs L, Maaijwee N, et al: Epilepsia pós-AVC em adultos jovens: um estudo de acompanhamento a longo prazo. PLoS One 2013; 8(2): e55498.
- Gilad R, Boaz M, Dabby R, et al: As convulsões pós-hemorragia intracerebral são evitadas pelo tratamento anti-epilético? Epilepsy Res 2011 Aug; 95(3): 227-231.
- van Tuijl JH, van Raak EP, de Krom MC, et al: Tratamento precoce após acidente vascular cerebral para a prevenção de crises epilépticas tardias: um relatório sobre os problemas na realização de um ensaio aleatório duplo-cego controlado por placebo destinado a anti-epileptogénese. Seizure 2011; 20: 285-291.
- Doeser A, Dickhof G, Reitze M, et al: Visando a epilepsia farmacorresistente e a epileptogénese com um fármaco antiepilético de dupla finalidade. Cérebro 2015; 138: 371-387.
- Soares-da-Silva P, Pires N, Bonifacio MJ, et al: Acetato de eslicarbazepina para o tratamento da epilepsia focal: uma atualização dos mecanismos de ação propostos. Pharmacol Res Perspect 2015; 3: e00124.
- Koepp MJ, Trinka E, Mah YH, et al: Antiepileptogénese após acidente vascular cerebral – ensaios e tribulações: Desafios metodológicos e resultados de recrutamento de um estudo de Fase II com acetato de eslicarbazepina. Epilepsia Open 2023 Sep; 8(3): 1190-1201.
- Winter Y, Daneshkhah N, Galland N, et al: Qualidade de vida relacionada à saúde em pacientes com epilepsia pós-AVC. Epilepsia e Comportamento 2018; 80: 303-306
- Villanueva V, Holtkamp M, Delanty N, et al: Euro-Esli: uma auditoria europeia da utilização no mundo real do acetato de eslicarbazepina como tratamento para crises parciais. J Neurol 2017; 264: 2232-2248.
- Winter Y, Uphaus T, Sandner K, et al: Eficácia e segurança da medicação anti-convulsiva na epilepsia pós-AVC. Seizure. 2022 Aug; 100: 109-114.
- Lattanzi S, Canafoglia L, Canevini MP, et al: BRIVAFIRST Group Membership. Brivaracetam como tratamento complementar em pacientes com epilepsia pós-AVC: dados do mundo real do BRIVAracetam add-on First Italian netwoRk Study (BRIVAFIRST). Seizure. 2022 Abr; 97: 37-42.
- Winter Y, Sandner K, Vieth T, Groppa S: Acetato de eslicarbazepina para o tratamento do status epilepticus. Epileptic Disord 2023 Apr; 25(2): 142-149.
- Winter Y, Sandner K, Vieth T, et al: Medicação Anti-convulsiva de Terceira Geração no Tratamento do Estado Epilético Refratário às Benzodiazepinas na Epilepsia Pós-AVC: Um Estudo Retrospetivo Observacional Baseado em Registos. CNS Drugs 2023 Oct;37(10): 929-936.
HAUSARZT PRAXIS 2024; 19(12): 6–13