Il trattamento del carcinoma bronchiale viene notevolmente modificato dall’immunoterapia. Gli attuali sviluppi porteranno a un adeguamento dei nostri algoritmi terapeutici nei prossimi mesi.
Il sistema immunitario può essere considerato come una scala che ha meccanismi stimolanti da un lato e meccanismi bloccanti dall’altro, che sono finemente sintonizzati l’uno con l’altro e quindi consentono di proteggersi dalle strutture patogene (virus, batteri e sostanze estranee) evitando l’autoimmunità. Dagli anni 2000, sono stati identificati sempre più meccanismi su entrambi i lati della scala. In particolare, le molecole del gruppo dei cosiddetti “checkpoint regolatori immunitari” sembrano svolgere un ruolo importante nell’equilibrio del sistema immunitario. Gli anticorpi che consentono l’attivazione del sistema immunitario bloccando le molecole inibitorie del “checkpoint immunitario” stanno attualmente facendo scalpore. Questi anticorpi sono disponibili, ad esempio, nel trattamento del tumore polmonare metastatico e sono diventati parte integrante del repertorio terapeutico. La loro applicazione si basa sulla premessa che il tumore possa essere riconosciuto dal sistema immunitario e che questa risposta immunitaria sia almeno parzialmente bloccata dai “checkpoint regolatori immunitari” PD-1/PDL-1.
Sulla base dei dati disponibili, si può ipotizzare che questo scenario fisiopatologico sia presente in circa il 15-25% di tutti i pazienti (in questi pazienti, si verifica un controllo a lungo termine della malattia metastatica). Questo viene interpretato come un’indicazione indiretta del controllo da parte del sistema immunitario e, al contrario, significa anche che in circa l’80% dei pazienti sono attivi altri meccanismi immunosoppressivi o che il sistema immunitario non riconosce questi tumori in linea di principio e quindi non è possibile “sbloccare” la risposta immunitaria ( Fig. 1).
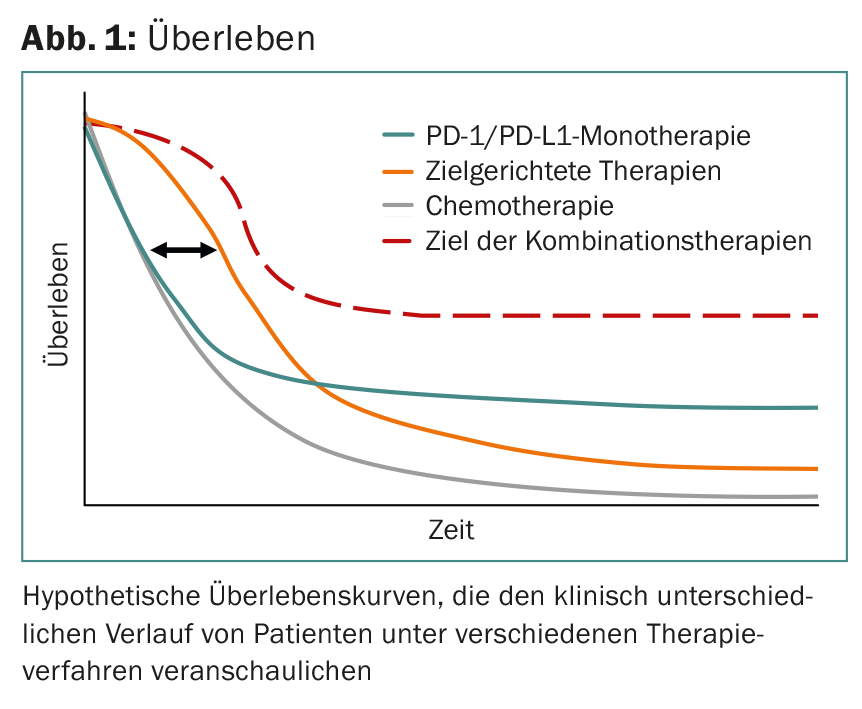
Al momento, non esistono metodi di analisi soddisfacenti che prevedano la risposta al blocco PD-1/PD-L1.
Cancro polmonare metastatico
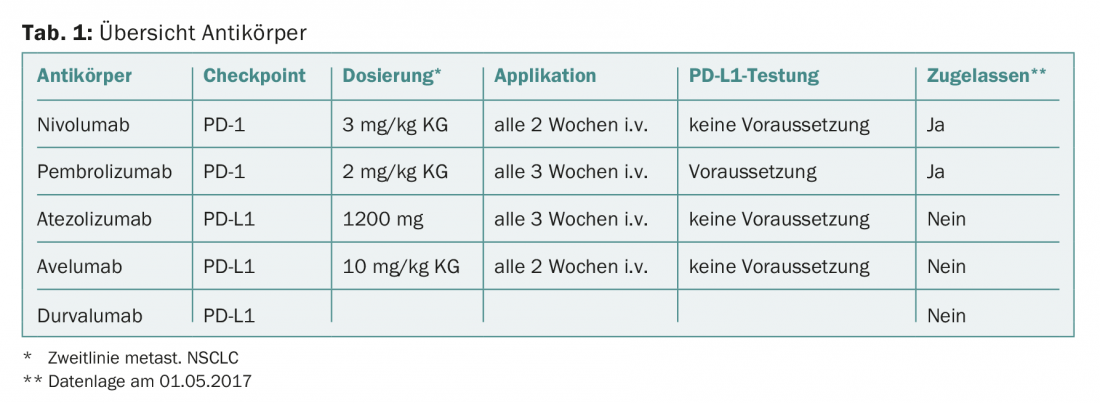
Gli anticorpi sono già approvati per il tumore polmonare metastatico (Tab. 1), che possono impedire l’attivazione dei checkpoint PD-1/PDL-1 e quindi liberare le cellule T dal bloccare il tumore maligno. Gli anticorpi monoclonali possono essere suddivisi in due gruppi: diretti contro PD-1 o contro PD-L1.
In primo luogo, nivolumab (anti-PD-1) ha ricevuto l’approvazione di seconda linea nel carcinoma bronchiale metastatico, indipendentemente dall’espressione di PD-L1 (Checkmate 057 e Checkmate 017). Rispetto alla chemioterapia con docetaxel, la sopravvivenza globale a 2 anni è migliorata di circa il 15% (sopravvivenza globale mediana, “non squamoso”: 9,5 vs. 12,2 mesi; “squamoso”: 6,0 vs. 9,2 mesi). Lo studio Checkmate 057 ha anche dimostrato che in assenza dell’espressione di PD-L1, si può ancora ottenere una migliore sopravvivenza globale a 2 anni rispetto al docetaxel (<1% delle cellule tumorali: 25% vs. 18%). Pertanto, l’approvazione è stata concessa indipendentemente dallo stato di espressione di PD-L1. Questo dimostra chiaramente i limiti dell’espressione di PD-L1 come biomarcatore nel carcinoma bronchiale, poiché anche i pazienti senza espressione di PD-L1 nel tumore traggono un beneficio clinico dalla terapia di seconda linea con nivolumab.
Lo sviluppo di pembrolizumab (anti-PD-1) si basa sul presupposto che, sebbene PD-L1 non sia un biomarcatore perfetto, l’espressione di PD-L1 nel tessuto tumorale è biologicamente abbastanza importante da rendere necessaria la sua determinazione per giustificare l’inibizione del checkpoint. Pertanto, solo i pazienti in cui è stato possibile rilevare l’espressione di PD-L1 (>1% delle cellule tumorali) sono stati inclusi negli studi di registrazione. Nello studio Keynote 010, è stato riscontrato un significativo beneficio in termini di sopravvivenza rispetto alla chemioterapia con docetaxel (sopravvivenza globale mediana, “non squamosa”: 8,5 vs. 10,4 mesi).
I risultati dello studio su nivolumab e pembrolizumab dimostrano che con l’aumento dell’espressione di PD-L1, la sopravvivenza globale migliora quando si utilizza l’inibizione del checkpoint (monoterapia) con un anticorpo anti-PD-1. Entrambi gli anticorpi monoclonali sottolineano quindi l’importante ruolo biologico del checkpoint PD-1/PDL-1, ma i risultati non consentono di utilizzarlo come unico biomarcatore, in quanto anche i pazienti senza espressione di PD-L1 nel tumore traggono beneficio.
Atezolizumab, durvalumab e avelumab sono diretti contro PD-L1 e teoricamente hanno un profilo immunologico leggermente diverso. Gli anticorpi anti-PD-L1 bloccano solo l’interazione tra PD-L1 e PD-1 e non tra PD-L1/-L2 e PD-1, come fa un anticorpo anti-PD-1. Questa differenza potrebbe portare a un profilo di effetti collaterali più favorevole. Inoltre, sono teoricamente disponibili più recettori stimolanti che le cellule T possono utilizzare grazie all’interazione di B7.1 e PD-L1. Tuttavia, poiché finora non sono stati condotti studi comparativi tra gli anticorpi anti-PD-1 e anti-PD-L1, il vantaggio clinico postulato in termini di un effetto migliore e di minori effetti collaterali indesiderati non è stato dimostrato. Atezolizumab è stato in grado di dimostrare un vantaggio significativo in termini di sopravvivenza rispetto al docetaxel in uno studio di fase III (studio OAK) (sopravvivenza globale mediana, “non squamosa”: 11,2 vs. 15,6 mesi; “squamosa”: 7,7 vs. 8,9 mesi). Sono disponibili i dati di uno studio di fase II (studio ATLANTIC) per durvalumab come monoterapia. Questo studio consiste in tre coorti di pazienti dopo il fallimento della terapia di seconda linea, la cui sopravvivenza globale è stata analizzata in base al livello di espressione di PD-L1 (sopravvivenza globale mediana, <25% delle cellule tumorali: 9,3 mesi; >25% delle cellule tumorali: 10,9 mesi; >90% delle cellule tumorali: non raggiunta a 12 mesi). Avelumab ha mostrato un tasso di risposta globale di 11,6 settimane per i tumori PD-L1-positivi (>25% delle cellule tumorali) e di 6,0 settimane per i tumori PD-L1-negativi (<25% delle cellule tumorali) in uno studio di fase IB (JAVELIN Solid Tumour) nella terapia di seconda linea.
Tutti gli inibitori del checkpoint PD-1/PD-L1 hanno un profilo di effetti collaterali simile. Gli eventi avversi di grado 3-4 si sono verificati nel 2-5% dei pazienti in tutti gli studi e hanno incluso polmonite, aumento delle transaminasi e disfunzione tiroidea.
Sommario
Alla fine, gli oncologi curanti avranno l’imbarazzo della scelta, poiché diversi inibitori del checkpoint stanno rapidamente diventando disponibili a partire dalla seconda linea nel carcinoma bronchiale metastatico. Tutti gli anticorpi presentano uno spettro simile di effetti ed effetti collaterali. Le principali differenze cliniche tra gli anticorpi sono i dosaggi e la frequenza di applicazione (tab. 1).
Anche l’uso degli inibitori del checkpoint PD-1/PD-L1 cambierà di nuovo in modo significativo nelle prossime settimane, poiché pembrolizumab è ora approvato anche in Svizzera in prima linea per i carcinomi bronchiali che esprimono >50% di PD-L1. Pertanto, in seconda linea, la chemioterapia dovrebbe avere di nuovo uno status più importante e il test di PD-L1 dovrebbe diventare una diagnosi centrale prima della terapia di prima linea, con una grande rilevanza terapeutica.
Inoltre, si può ipotizzare che le terapie di combinazione possano essere utilizzate nel prossimo futuro – sia come inibizione del checkpoint con la chemioterapia, sia come due inibitori del checkpoint in combinazione. Di conseguenza, anche la monoterapia di seconda linea con blocco PD-1/PD-L1 diventerà meno importante nel carcinoma bronchiale metastatico.
Messaggi da portare a casa
- Il trattamento del carcinoma bronchiale senza una mutazione driver rilevabile è attualmente molto modificato dall’immunoterapia.
- Gli attuali sviluppi porteranno a un adeguamento dei nostri algoritmi terapeutici nei prossimi mesi.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(3): 14-16











