O arsenal de substâncias activas atualmente investigadas na área de indicação da dermatite atópica (DA) é considerável. Para além dos anticorpos anti-OX40/OX40L, do CM310, do nemolizumab e dos antagonistas dos receptores 1 da neuroquinina, existem também várias terapêuticas anti-inflamatórias tópicas, como o tapinarof, o ruxolitinib, o delgocitinib, o roflumilast, o difamilast e o asivatrep. Algumas destas terapêuticas inovadoras já foram autorizadas em alguns países.
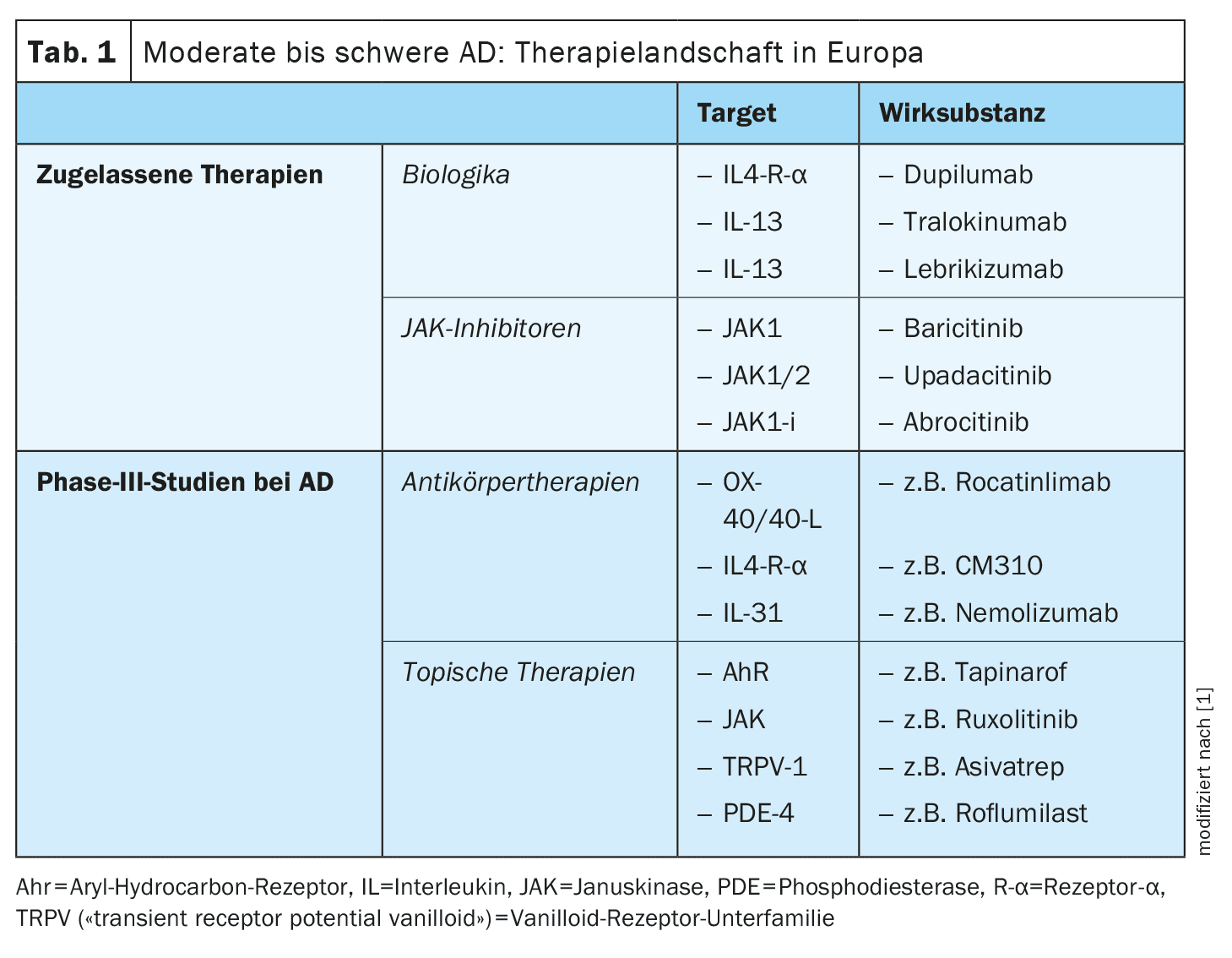
As opções de tratamento para a dermatite atópica (DA) expandiram-se significativamente nos últimos anos, estando atualmente disponível uma vasta gama de terapias tópicas e sistémicas eficazes e seguras. As exigências e expectativas em relação à terapêutica aumentaram: o objetivo não é apenas otimizar o perfil risco-benefício, mas também obter efeitos de tratamento tão duradouros quanto possível. No entanto, as “necessidades não satisfeitas” incluem também determinados subgrupos de doentes que não respondem adequadamente às opções de tratamento atualmente disponíveis ou que não as toleram. O fator comodidade também não deve ser negligenciado; o tratamento deve ser tão fácil quanto possível de integrar na vida quotidiana do doente e ajudar a obter uma melhoria rápida e duradoura da qualidade de vida.
Novas terapias com anticorpos imunomoduladores
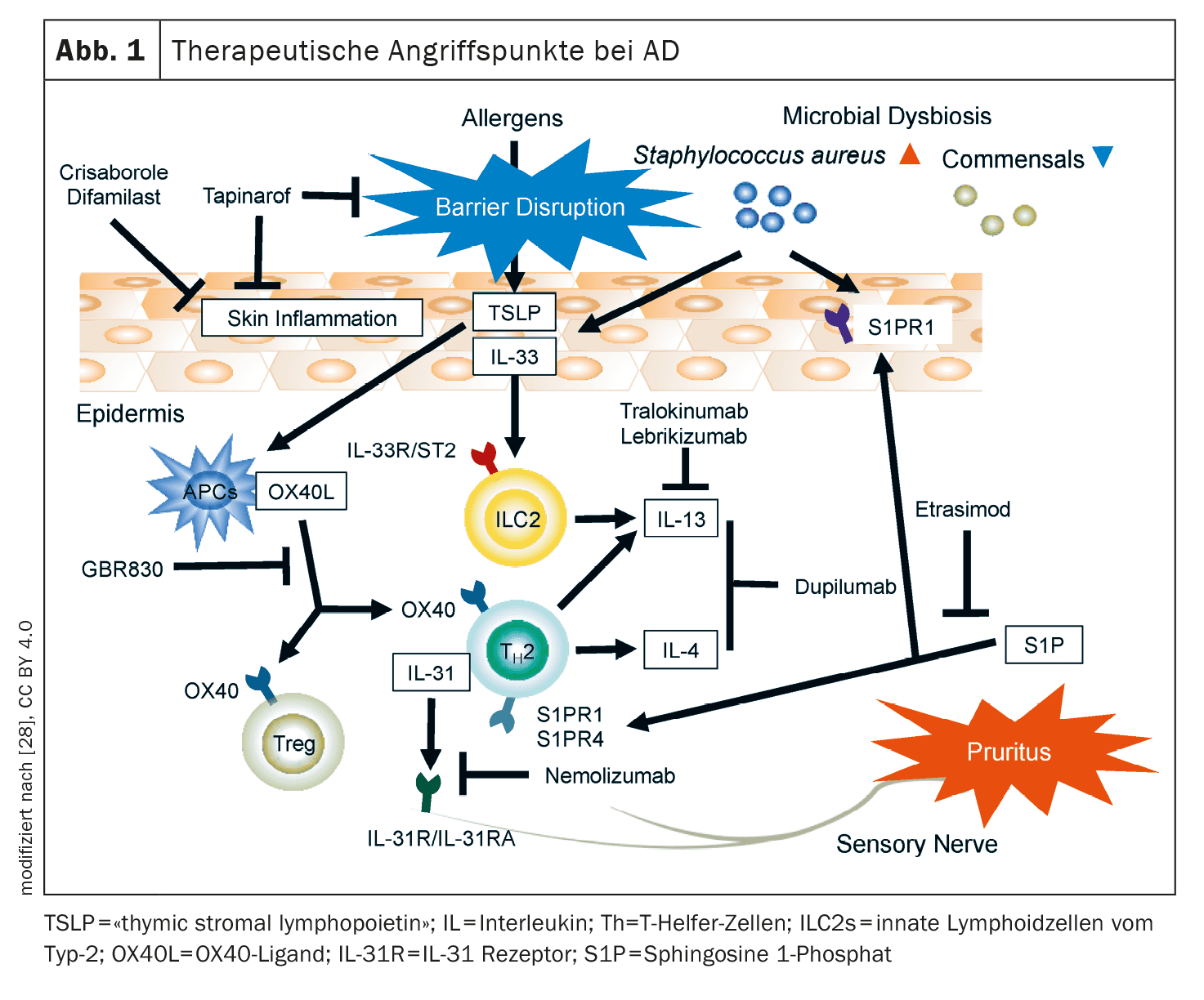
[1,2]Entre as terapias com anticorpos, o eixo OX40/OX40L, a IL-31 e o recetor da neuroquinina-1 nos neurónios sensoriais são alvos promissores para a DA. Além disso, estão a ser investigados novos representantes de estruturas-alvo comprovadas, como o recetor IL-4-α (IL4R-α).Eixo OX40/OX40L: A OX40 é expressa em células T na pele lesionada da DA [4]. A ligação do ligando OX40 à OX40 conduz a uma diferenciação imunitária orientada para T2, que é alvo de vários novos medicamentos [5].
- O Rocatinlimab (AMG451/KHK4083) é um anticorpo anti-OX40L administrado por via subcutânea que está atualmente a ser investigado em ensaios de Fase III em adultos com DA moderada a grave. Num estudo de Fase IIb, a dose de 300 mg a cada 2 semanas (q2w) provou ser a mais eficaz com uma redução do EASI de 61% na semana 16 [3]. Os eventos adversos ( EAs) mais comuns, que ocorreram com maior frequência do que com o placebo, foram pirexia (17%), nasofaringite (14%) e calafrios (11%) [6]. As análises do proteoma mostraram que os mediadores Th2/Th22 e associados ao prurido diminuíram com o rocatinlimab na semana 16, acompanhados por uma regulação negativa dos genes Th2, Th1/17 e Th22 na semana 52.
- Outros inibidores da OX-40: atualmente em preparação para a DA são o GBR830 (anti-OX40), o telazorlimab (ISB830) e o amlitelimab (KY1005; anti-OX40L) [7].
IL-4Rα: Para além do anticorpo IgG4 dupilumab já aprovado, que se liga ao IL-4Rα e inibe assim a via de sinalização da IL-4 e da IL-13, estão atualmente em desenvolvimento outras substâncias activas.
- CBP-201: Este é um inibidor da IL-4Rα que está atualmente a ser investigado em dois estudos de Fase II (NCT04444752, NCT05017480) e obteve resultados promissores [8]. Uma alteração média nas pontuações EASI de -63,0% (a cada 2 semanas, q2w) e -65,4% (a cada 4 semanas, q4w) foi alcançada com CBP-201, em comparação com -40,7% no grupo placebo [8].
- CM310: Este anticorpo anti-IL-4Rα está atualmente a ser investigado em estudos de fase II (NCT04805411) e de fase III (NCT05265923, NCT04893707) [8].
IL-31: Esta citocina demonstrou ser extremamente importante na patogénese da comichão e os níveis séricos de IL-31 estão correlacionados com a gravidade da DA [9]. A IL-31 está envolvida na rutura da barreira epidérmica típica da DA e ativa os neurónios pruriceptivos, que libertam neuropeptídeos que conduzem à inflamação local na pele, atraindo células Th2.
[10,11]A cadeia α do recetor de IL-31 (IL-31Rα) é um importante alvo terapêutico que é antagonizado pelo nemolizumab. [10,12] Nos EUA, este medicamento biológico está aprovado para o tratamento do prurigo nodular e no Japão também para o prurido associado à DA em doentes com idade ≥13 anos.- [10]Nemolizumab: Com nemolizumab 60 mg (q4w) como adjuvante à terapia tópica padrão, 66% alcançaram uma redução no prurido e 78% uma redução no EASI na semana 68. [11] Os EAs mais comuns foram nasofaringite (33,9%) e DA (25,2%). Estão atualmente em curso ensaios de Fase III de nemolizumab e ensaios de Fase II em crianças (2-11 anos) com DA moderada a grave.
A substância P (SP) e o recetor da neuroquinina-1 (Nκ1R): [13,14] Sabe-se que estas taquicininas estão envolvidas na transmissão periférica e central do prurido independente da histamina e que os doentes com DA apresentam níveis elevados de SP na pele lesionada e no soro. Os Nκ1R estão principalmente localizados no gânglio da raiz dorsal e no corno dorsal da medula espinal.
- Ainda não é totalmente claro se os antagonistas Nκ1R são eficazes na DA, especialmente porque o aprepitant com terapia tópica padrão concomitante não levou a uma melhoria significativa do prurido na DA numa comparação com placebo. [22] Em contrapartida, o serlopitant reduziu significativamente o prurido crónico na PN.
Os dados do estudo de fase III sobre o serlopitant e o tradipitant relativamente ao prurido na DA ainda não foram publicados.
Novas substâncias tópicas para a terapia anti-inflamatória
<Para além da terapêutica sistémica administrada por via subcutânea e oral, as terapias anti-inflamatórias tópicas também desempenham um papel importante, particularmente para os doentes com DA com uma área de superfície corporal (BSA) limitada a 10%.
Inibidores tópicos da JAK: Em comparação com a aplicação sistémica de JAK-i, a aplicação tópica apresenta significativamente menos riscos de efeitos secundários.
- [17]Ruxolitinib: O creme de ruxolitinib inibe a JAK1/2 e foi aprovado pela Food and Drug Administration (FDA) dos EUA em 2021 para o tratamento da DA ligeira a moderada em pessoas com ≥12 anos de idade. No estudo relevante para a aprovação, também foi alcançada uma boa eficácia no que diz respeito ao prurido e a tolerabilidade também provou ser boa. [17] A nasofaringite foi relatada como o EA mais comum.
- [18]Delgocitinib: Este JAK-i tópico bloqueia todas as moléculas JAK e foi aprovado para o tratamento da DA no Japão em 2020. Num estudo de fase III, um tratamento de quatro semanas com creme de delgocitinib a 0,5% levou a uma melhoria da inflamação local de cerca de 45%. [19] Os efeitos secundários mais frequentes foram foliculite (2,4%), acne (2,2%) ou irritação (1,8%) no local da aplicação.
- Outros JAK-i tópicos estão atualmente a ser investigados em ensaios clínicos: [20] Brepocitinib (IIb), ATI-1777, Jaktinib e SHR0302 (Fase II/III).
- Tapinarof creme 1%: [23] Este é um agonista AhR que foi aprovado pela FDA em 2022 para o tratamento da psoríase em placas. O Tapinarof modula a expressão genética através da ativação das vias de sinalização AhR, resultando numa regulação negativa da inflamação de tipo 2 (IL-4, IL-13), normalizando a barreira cutânea e contribuindo para uma redução do stress oxidativo. [24] Num estudo de fase II, aleatório, em dupla ocultação, com a duração de 12 semanas, os doentes adolescentes e adultos com DA tratados com tapinarof creme a 0,5% ou a 1%, em comparação com a preparação do veículo, apresentaram uma boa melhoria das lesões eczematosas e do prurido. [24] Os EA notificados foram nasofaringite, infecções do trato respiratório superior, agravamento da DA e foliculite . [22] Estão atualmente em curso estudos de fase III sobre tapinarof .
- Crisaborole: Este inibidor tópico da PDE-4 foi autorizado nos EUA e na UE, mas até agora só está disponível no mercado europeu de forma limitada.
- [17,22]Roflumilast e difamilast: Estes representantes dos inibidores tópicos da PDE-4 estão atualmente a ser investigados e poderão em breve estar disponíveis para o tratamento da DA ligeira a moderada.
Antagonistas tópicos do TRPV-1: Os TRPV (“transient recetor potential vanilloid“)-1, ou seja, uma subfamília de receptores vanilóides, encontram-se nos queratinócitos, nas células dendríticas e nos neurónios sensoriais e estão sobre-expressos na pele lesionada da DA. O TRPV-1 modula os processos inflamatórios, bem como o prurido dependente e independente da histamina, desencadeando a libertação de neuropeptídeos centrais como a substância P e o CGRP (peptídeo relacionado com o gene da calcitonina).
- [21]Asivatrep: Este antagonista seletivo do TRPV-1 conduziu a melhorias nas lesões eczematosas e no prurido num estudo aleatório de fase III controlado por veículo em doentes com ≥12 anos de idade com DA ligeira a moderada.
Literatura:
- Müller S, Maintz L, Bieber T: Treatment of atopic dermatitis: Recently approved drugs and advanced clinical development programs. Allergy 2024; 79(6): 1501–1515.
- Buhl T, Werfel T: [Atopische Dermatitis – Perspektiven und unerfüllte medizinische Bedarfe]. JDDG 2023; 21(4): 349–354.
- Lé AM, Torres T: OX40-OX40L Inhibition for the Treatment of Atopic Dermatitis-Focus on Rocatinlimab and Amlitelimab. Pharmaceutics 2022 Dec 8; 14(12): 2753.
- Nakagawa H, et al.: Safety, tolerability and efficacy of repeated intravenous infusions of KHK4083, a fully human anti-OX40 monoclonal antibody, in Japanese patients with moderate to severe atopic dermatitis. J Dermatol Sci 2020; 99: 82–89.
- Elsner JS, et al.: The OX40 Axis is associated with both systemic and local involvement in atopic dermatitis. Acta Derm Venereol 2020; 100: adv00099.
- Guttman-Yassky E, et al.: An anti-OX40 antibody to treat moderate-to-severe atopic dermatitis: a multicentre, double-blind, placebo-controlled phase 2b study. Lancet 2022; 401(10372): 204–214.
- Clinicaltrials, https://clinicaltrials.gov, estado 2022.
- Facheris P, et al.: The translational revolution in atopic dermatitis: the paradigm shift from pathogenesis to treatment. Cell Mol Immunol 2023; 20(5): 448–474.
- Datsi A, et al.: Interleukin-31: the «itchy» cytokine in inflammation and therapy. Allergy 2021; 76: 2982–2997.
- Kabashima K, et al.: Nemolizumab plus topical agents in patients with atopic dermatitis (AD) and moderate-to-severe pruritus provide improvement in pruritus and signs of AD for up to 68 weeks: results from two phase III, long-term studies. Br J Dermatol 2022; 186: 642–651.
- Kabashima K, et al.: Trial of Nemolizumab and topical agents for atopic dermatitis with pruritus. N Engl J Med 2020; 383: 141–150.
- Keam SJ: Nemolizumab: First Approval. Drugs. 2022; 82: 1143–1150.
- Ständer S, et al.: Serlopitant reduced pruritus in patients with prurigo nodularis in a phase 2, randomized, placebo-controlled trial. JAAD 2019; 80: 1395–1402.
- Welsh SE, et al.: Neurokinin-1 receptor antagonist tradipitant has mixed effects on itch in atopic dermatitis: results from EPIONE, a randomized clinical trial. JEADV 2021; 35: e338–e340.
- Yosipovitch G, et al.: Serlopitant for the treatment of chronic pruritus: results of a randomized, multicenter, placebo-controlled phase 2 clinical trial. JAAD 2018; 78: 882–891.e10.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Kleinman E, et al.: What’s new in topicals for atopic dermatitis. Am J Clin Dermatol 2022; 23: 595–603.
- Chovatiya R, Paller AS: JAK inhibitors in the treatment of atopic dermatitis. JACI 2021; 148: 927–940.
- Nakagawa H, et al.: Delgocitinib ointment, a topical Janus kinase inhibitor, in adult patients with moderate to severe atopic dermatitis: A phase 3, randomized, double-blind, vehicle-controlled study and an open-label, long-term extension study. JAAD 2020; 82(4): 823–831.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Park CW, et al.: Asivatrep, a TRPV1 antagonist, for the topical treatment of atopic dermatitis: phase 3, randomized, vehicle-controlled study (CAPTAIN-AD). JACI 2022; 149: 1340–1347.e4.
- Freitas E, Gooderham M, Torres T: New topical therapies in development for atopic dermatitis. Drugs 2022; 82: 843–853.
- Keam SJ: Tapinarof cream 1%: first approval. Drugs 2022; 82: 1221–1228.
- Paller AS, et al.: Efficacy and patient-reported outcomes from a phase 2b, randomized clinical trial of tapinarof cream for the treatment of adolescents and adults with atopic dermatitis. JAAD 2021; 84: 632–638.
- Zebda R, Paller AS. Phosphodiesterase 4 inhibitors. JAAD 2018; 78(3 Suppl 1): 43–S52,
doi: 10.1016/j.jaad.2017.11.056. - Schlessinger J, et al: Safety, effectiveness, and pharmacokinetics of Crisaborole in infants aged 3 to <24 months with mild-to-moderate atopic dermatitis: A phase IV open-label study (CrisADe CARE 1); Am J Clin Dermatol 2020; 21(2): 275–284.
- Saeki H, et al.: Difamilast ointment in adult patients with atopic dermatitis: a phase 3 randomized, double-blind, vehicle-controlled trial. JAAD 2022; 86(3): 607–614, doi: 10.1016/j.jaad.2021.10.027
- Yamamura K, Nakahara T: The Dawn of a New Era in Atopic Dermatitis Treatment. Journal of Clinical Medicine 2022; 11(20): 6145. www.mdpi.com/2077-0383/11/20/6145, (último acesso em 04.12.2024).
DERMATOLOGIE PRAXIS 2024; 34(6): 22–24