Las queratosis actínicas son un marcador del daño solar crónico y de la carcinogénesis de la piel. La protección solar, especialmente a una edad temprana, es la medida de prevención primaria más importante contra las queratosis actínicas en caso de exposición crónica a los rayos UV. Está indicado el tratamiento precoz de las queratosis actínicas. Existe una amplia gama de opciones de tratamiento.
Las queratosis actínicas o solares (QA) representan carcinomas de células escamosas in situ de la piel y se encuentran entre las dermatosis más frecuentes en la práctica diaria. Como su nombre indica, el sol, o más bien el La radiación UV, especialmente la UV-B, es responsable de su desarrollo. Principalmente, la exposición crónica a los rayos UV provoca de forma acumulativa daños permanentes y mayores en el ADN y el genoma de la piel (especialmente la mutación del gen supresor de tumores p53), cuya consecuencia es una proliferación más o menos pronunciada, rica en mitosis, de queratinocitos disqueratósicos transformados.
Se sabe desde hace tiempo que las personas con exposición ocupacional a los rayos UV (“trabajadores al aire libre”) padecen AK con una frecuencia significativamente mayor que las que trabajan predominantemente en oficinas. Además de la intensidad de la radiación UV, el tipo de piel de la persona expuesta a la radiación UV también contribuye al riesgo de desarrollar QA. Por lo tanto, se observan prevalencias mucho más altas en regiones con alta radiación UV y poblaciones de piel clara. En nuestras latitudes, la QA se da en el 11-25% de las personas mayores de 40 años, mientras que en Australia ronda el 60%. Un estudio realizado en Hamburgo en 2013 pudo demostrar que la prevalencia global era del 2,7%, siendo los hombres más afectados, con un 3,9%, que las mujeres, con un 1,5%.
Sin embargo, la prevalencia también aumenta con la edad, como han demostrado diversos estudios: En los hombres mayores de 60 años, el 20% ya están afectados y en los mayores de 70 años incluso el 52%. En los últimos 10 años, también se ha observado un aumento significativo de la AK en general. Además de factores etiológicos -como la exposición crónica a los rayos UV-, la razón de ello es probablemente el cambio demográfico, con una mayor proporción de personas mayores.
La inmunosupresión con medicación, por ejemplo como consecuencia de un trasplante de órganos, no debe dejar de mencionarse como otro factor de riesgo importante: en un estudio, se detectó QA en el 29% de 452 pacientes con trasplante renal en el momento del examen inicial.
Dado que los carcinomas epidermoides de la piel (PEK) pueden desarrollarse a partir de una QA, suele plantearse la pregunta: ¿con qué probabilidad y en qué plazo de tiempo? Una revisión bibliográfica sistemática de 2013, en la que se analizaron 24 estudios, concluyó que, debido al número limitado de datos disponibles y a las limitaciones metodológicas, actualmente no es posible realizar estimaciones fiables de la frecuencia de evolución de la QA a carcinoma invasivo, por lo que se requieren más estudios.
Hallazgos clínicos
La QA se presenta especialmente en zonas de la piel expuestas a los rayos UV, como el capilicio, el hélix de la oreja, el puente de la nariz, las caras extensoras del antebrazo o el dorso de la mano, en forma de máculas, pápulas o placas escamosas ásperas de color rojizo o pardo rojizo (Fig. 1 ). Rara vez se producen lesiones individuales, sino que se ve afectada toda una región. En este contexto, se habla de cancerización del campo.

Diagnóstico
La inspección y la palpación son adecuadas para hacer un diagnóstico provisional de la QA. Sin embargo, la QA se caracteriza por un eritema variable con una queratosis de expresión variable. La gradación clínica de la QA no se correlaciona con la expresión histológica. Por lo tanto, la invasividad no puede evaluarse con certeza clínica.
En caso de hallazgos poco claros, la dermatoscopia es un procedimiento adecuado para diferenciar otras enfermedades y tumores. Numerosos estudios han demostrado que la QA, la QA pigmentada, la enfermedad de Bowen y la PEK muestran patrones típicos, especialmente de los vasos, en la dermatoscopia: Las QA muestran principalmente una pseudorred roja y escamas ligeramente amarillentas-marronáceas, mientras que los carcinomas invasivos muestran vasos en horquilla e irregulares, folículos pilosos targoides, masas centrales de queratina y ulceraciones. Así pues, la QA y la PEK también pueden distinguirse fácilmente de los carcinomas basocelulares. Además, la dermatoscopia también es adecuada para diferenciar entre el lentigo maligno, el lentigo senil y la QA pigmentada. Además, el grado de invasividad se correlaciona con la atipia vascular, por lo que la dermatoscopia también puede utilizarse para evaluar la invasividad. Otros métodos no invasivos de obtención de imágenes son la microscopía láser confocal y la tomografía de coherencia óptica, pero en su mayoría sólo están disponibles en las clínicas.
Si existe un hallazgo clínico típico, el AK no requiere diagnóstico histológico. Por otro lado, las lesiones que no son clínicamente claras, en las que hay signos de progresión hacia una PEK, o en las que hay signos de progresión hacia una PEK, deben tratarse. cuyo comportamiento biológico no pueda evaluarse, deberá realizarse una biopsia. Las QA que no responden a una terapia adecuada también deben someterse a una biopsia.
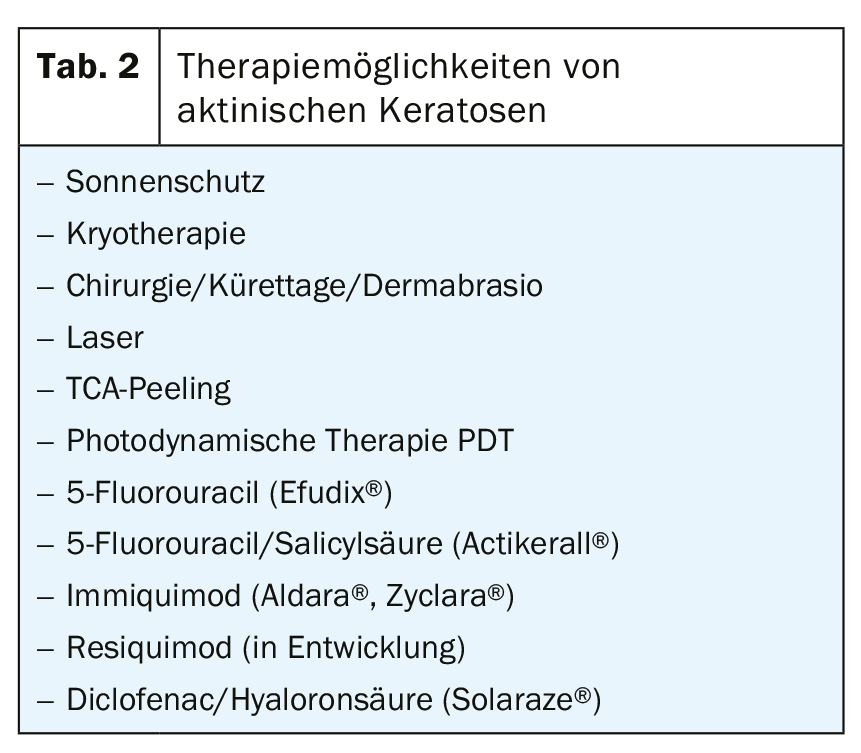
Terapia
En la actualidad existe un gran número de opciones terapéuticas para el tratamiento de la QA, lo que no facilita necesariamente la decisión sobre una terapia concreta en la práctica diaria. Además, la elección de un tratamiento adecuado depende de factores específicos del paciente, la lesión y la terapia. Los factores del paciente incluyen la edad, las comorbilidades, la inmunosupresión, la comedicación, los deseos y preferencias del paciente y la adherencia al tratamiento. Los aspectos relacionados con las lesiones engloban el número de QA, su localización, la naturaleza clínica y el tamaño del campo afectado. Además, como se mencionó al principio, la QA se basa patogenéticamente en el daño del ADN en la piel, lo que preprograma las recidivas tarde o temprano.
En principio, cada una de las opciones de tratamiento existentes se basa en última instancia en la destrucción de las zonas afectadas con la posterior reepitelización.
Crioterapia
La crioterapia con nitrógeno líquido (-196°C) es el procedimiento de tratamiento físicamente destructivo más común para la QA en la vida cotidiana. La frecuencia, la duración, la intensidad y la temperatura específica de la zona de tratamiento no están normalizadas. Los pocos estudios existentes muestran unas tasas de curación relacionadas con la lesión de entre el 41,9% y el 88%, unas tasas relacionadas con el paciente de entre el 25% y el 90,3% y unas tasas de recidiva de entre el 1,2% y el 12% durante el primer año. En general, es más o menos un método basado en la eminencia que en la evidencia, pero es barato, lleva poco tiempo y es bien tolerado por el paciente sin anestesia local. La duración de la congelación se correlaciona con la eficacia, pero también con los posibles efectos secundarios (hipo/hiperpigmentación, cicatrices).
Otros procedimientos ablativos, que sólo deben mencionarse aquí en aras de la exhaustividad y que, sin embargo, han demostrado ser en el mejor de los casos equivalentes a la crioterapia en los estudios, son los procedimientos quirúrgicos (curetaje, escisión plana, escisión, dermoabrasión), el peeling con TCA y el láser (ablativo, no ablativo).
Terapia fotodinámica PDT
La TFD se basa en la destrucción selectiva de las células tumorales de la epidermis y la dermis mediante una sustancia fotosensibilizante (ácido 5-aminolevulínico ALA, metil-5-amino-4-oxopentanoato MAL [Metvix®]) y la irradiación con luz roja de alta energía. Los estudios hallan tasas de curación relacionadas con la lesión de entre el 58% y el 94,3% y relacionadas con el paciente de entre el 31,8% y el 91%, con resultados cosméticos calificados predominantemente de “excelentes” o “buenos”. Sin embargo, el tiempo necesario (deben transcurrir 3 horas entre la aplicación de la crema y la irradiación), el dolor y las reacciones locales más fuertes (eritema, edema, pústulas, erosiones) se perciben como desventajas.
Para simplificar el procedimiento de tratamiento, también existe como alternativa un parche que contiene ALA (Ameluz®, Alacare®).
Una nueva variante de la PDT convencional es la llamada PDT diurna, que puede llevarse a cabo desde finales de abril hasta finales de septiembre. Tras el curetaje de las costras y las hiperqueratosis y la aplicación de un protector solar SPF 20, se aplica MAL sobre las queratosis actínicas sin oclusión y se indica a la paciente que permanezca al aire libre entre 90 y 120 minutos (dependiendo de la exposición al sol) entre las 11.00 y las 16.00 horas después de una media hora. Después, debe lavarse el MAL. En el resumen del estudio, este tipo de TFD parece ser ligeramente inferior al método convencional, con una reducción significativa del dolor.
5-fluorouracilo tópico (Efudix®)
El 5-fluorouracilo es un análogo de la pirimidina que se incorpora al ARN y al ADN como antimetabolito y, por tanto, inhibe la síntesis de este ácido nucleico. También se produce una inhibición de la timidil sintetasa. El 5-Fluorouracilo 5% debe aplicarse dos veces al día durante 2 a 4 semanas, pero también son frecuentes otras variaciones de la dosis, por ejemplo, cada 2 días durante 3 semanas hasta el autotratamiento por parte de la paciente. Suele haber reacciones inflamatorias más o menos pronunciadas hasta erosiones, ampollas o necrosis, que en última instancia pueden ser limitantes de la terapia. Las tasas de curación relacionadas con la lesión oscilaron entre el 47% y el 94%, y las relacionadas con el paciente, entre el 38% y el 96%. El fluorouracilo tópico en dosis bajas al 0,5% en combinación con ácido salicílico al 10% (Actikerall®), aplicado una vez al día, suele mostrar menos reacciones inflamatorias cutáneas. Tasa de curación relacionada con la lesión: del 39,4% al 98,7%, relacionada con el paciente: 55,4%.
Imiquimod
El imiquimod es un agonista específico del TLR-7 y provoca la liberación de una serie de citoquinas (IFN-alfa, IL-1, IL-6, IL-12 y TNF-alfa), lo que conlleva un aumento de la inmunidad celular con propiedades antivirales y antitumorales. La crema al 5% (Aldara®) se aplica tres veces por semana durante 4 semanas. Según los estudios, la tasa de curación relacionada con la lesión oscila entre el 45,1% y el 93,6%, y la relacionada con el paciente, entre el 24% y el 85%. La crema al 3,75% (Zyclara®) se utiliza como terapia de intervalo: 1× diario durante 2 semanas, 2 semanas de descanso, 1× diario durante 2 semanas, con lo que se obtienen tasas de curación de las lesiones de entre el 34% y el 81,8%.
Diclofenaco en gel de ácido hialurónico (Solaraze®)
El diclofenaco, como inhibidor de la COX1 y la COX2, frena la proliferación y la neoangiogénesis en la carcinogénesis y favorece la apoptosis. El gel se aplica dos veces al día durante 60 a 90 días. En el resumen del estudio, una tasa de curación relacionada con la lesión de entre el 51,8% y el 81%, y relacionada con el paciente de entre el 27% y el 50%, observándose reacciones adversas (prurito, eritema, hip- y parestesia, reacciones fotoalérgicas) significativamente menores que con el imiquimod o el 5-fluorouracilo.
Mebutato de ingenol (Picato®)
El gel de aplicación tópica derivado de una planta de tártago, que induce una ruptura del potencial de membrana mitocondrial con necrosis celular consecutiva, que se manifiesta clínicamente en una dermatitis tóxica más o menos grave, fue retirado del mercado en enero de 2020 debido a un posible riesgo de aumento de la carcinogénesis cutánea en las zonas tratadas.
Resumen
En resumen, la protección solar, especialmente a una edad temprana y en caso de exposición crónica a los rayos UV, es la medida más importante en la prevención primaria de la QA. Sin embargo, una vez que el daño solar se ha fijado y “quemado” en el genoma de la piel, la detección precoz y el tratamiento se convierten en una prioridad absoluta. Existen diversas opciones y modalidades terapéuticas para el tratamiento de la QA. Cada método tiene ciertas ventajas, pero también desventajas. El resumen del estudio muestra que la eficacia de las opciones de tratamiento presentadas oscila entre el 50% y el 90%, siendo la TFD ligeramente mejor que Solaraze®, lo que también refleja la experiencia clínica. El objetivo es disponer de un régimen de tratamiento adaptado individualmente a cada paciente, por lo que es posible alternar entre procedimientos individuales o combinar métodos a lo largo del tiempo. Además, no todos los pacientes responden igual de bien a un método de tratamiento concreto. En ocasiones, se producen reacciones inflamatorias locales secundarias más pronunciadas durante el tratamiento, mientras que en otros pacientes parece que no ocurre nada al principio, pero las lesiones de la QA acaban curándose por completo. En este sentido, la discusión educativa y la orientación del paciente tienen funciones muy decisivas. Por un lado, hay que informar al paciente sobre el daño crónico de la luz en la piel, el inicio de la carcinogénesis y los exámenes de control periódicos que, por tanto, probablemente sean necesarios durante toda la vida, y por otro, hay que informarle sobre las distintas opciones terapéuticas. Sin embargo, para ello es necesario que el dermatólogo tratante esté familiarizado con el “manejo del teclado” de las opciones de tratamiento de la QA.
Mensajes para llevarse a casa
- La protección solar, especialmente a una edad temprana, es la medida de prevención primaria más importante contra la QA en caso de exposición crónica a los rayos UV.
- AK son un marcador del daño solar crónico y de la carcinogénesis de la piel.
- El tratamiento precoz de la QA está indicado.
- Existen diversas opciones de tratamiento de la AK.
- La educación y un concepto de tratamiento individual son principios fundamentales en la terapia AK.
Literatura:
- Directriz S3 Queratosis actínica y carcinoma de células escamosas de la piel, directriz AWMF de la Sociedad Dermatológica Alemana Marzo 2020.
- Kornek T, Augustin M: Prevención del cáncer de piel. J Dtsch Dermatol Ges 2013; 11(4): 283-296.
- Green AC: Epidemiología de las queratosis actínicas. Curr Probl Dermatol 2015; 46: 1-7.
- Memon AA, et al: Prevalencia del solardamage y la queratosis actínica en una población de Merseyside. Br J Dermatol 2000 ; 142(6): 1154-1159.
- Schmitt J, et al: La exposición laboral a la luz ultravioleta aumenta el riesgo de desarrollo de carcinoma cutáneo de células escamosas: una revisión sistemática y metaanálisis. Br J Dermatol 2011; 164(2): 291-307.
- Werner RN, et al: La historia natural de la queratosis actínica: una revisión sistemática. Br J Dermatol 2013; 169(3): 502-518.
- Huerta-Brogeras M, et al: Validation of dermoscopy as a real-time noninvasive diagnostic imaging techniquefor actinic keratosis. Arch Dermatol 2012 ; 148(10): 1159-1164.
- Zalaudek I, et al: Dermatoscopia de la queratosis actínica facial, carcinoma intraepidérmico y carcinoma invasivo de células escamosas: Un modelo de progresión. J Am Acad Dermatol 2011.
- Akay BN, et al: Dermatoscopia de lesiones faciales pigmentadas planas: reto diagnóstico entre queratosis actínica pigmentada y lentigo maligno. Br J Dermatol 2010; 163(6): 1212-1217.
- Lallas A, et al: Las características clínicas y dermatoscópicas del carcinoma escamoso cutáneo invasivo dependen del grado histopatológico de diferenciación. Br J Dermatol 2015; 172(5): 1308-1315.
PRÁCTICA DERMATOLÓGICA 2020; 30(4): 6-9