La esquizofrenia se caracteriza, entre otras cosas, por una desregulación dopaminérgica. Todos los antipsicóticos aprobados para su tratamiento son antagonistas de los receptores de dopamina, especialmente de los receptores D2 y D3. Los tres agonistas dopaminérgicos parciales D2 aripiprazol, brexpiprazol y cariprazina muestran un efecto significativamente mejor como antipsicóticos que el placebo en el tratamiento farmacológico de los trastornos esquizofrénicos.
El mecanismo de acción de los antipsicóticos actualmente introducidos apoya la hipótesis neurobiológica de que la esquizofrenia se caracteriza, entre otras cosas, por una desregulación dopaminérgica [1]. Todos los antipsicóticos aprobados para su tratamiento son antagonistas de los receptores de dopamina, especialmente de los receptores D2 y D3. En los últimos 20 años se han introducido en Suiza tres nuevos antipsicóticos para el tratamiento de la esquizofrenia; pertenecen al grupo de los agonistas parciales de los receptores dopaminérgicos D2: el aripiprazol, el brexpiprazol y la cariprazina. Sus propiedades farmacológicas y clínicas fueron descritas en detalle por Eich y Gertsch en esta revista en 2019 [2]. El presente documento pretende actualizar la literatura publicada desde entonces, pero también presentar algunos temas con mayor profundidad, haciendo hincapié en el brexpiprazol. Sin embargo, las recientes recomendaciones de tratamiento y las revisiones [3–5] también muestran que la situación de los datos para los nuevos representantes de este grupo de fármacos, el brexpiprazol y la cariprazina, sigue siendo escasa en comparación con la del aripiprazol, disponible desde hace casi 20 años. Resulta especialmente llamativo que las comparaciones directas entre estos tres antipsicóticos sean extremadamente raras, tanto en términos de su eficacia clínica como de su perfil de efectos secundarios (tolerancia, seguridad) [6].
Hipótesis neurobiológicas de la esquizofrenia: aspectos farmacológicos
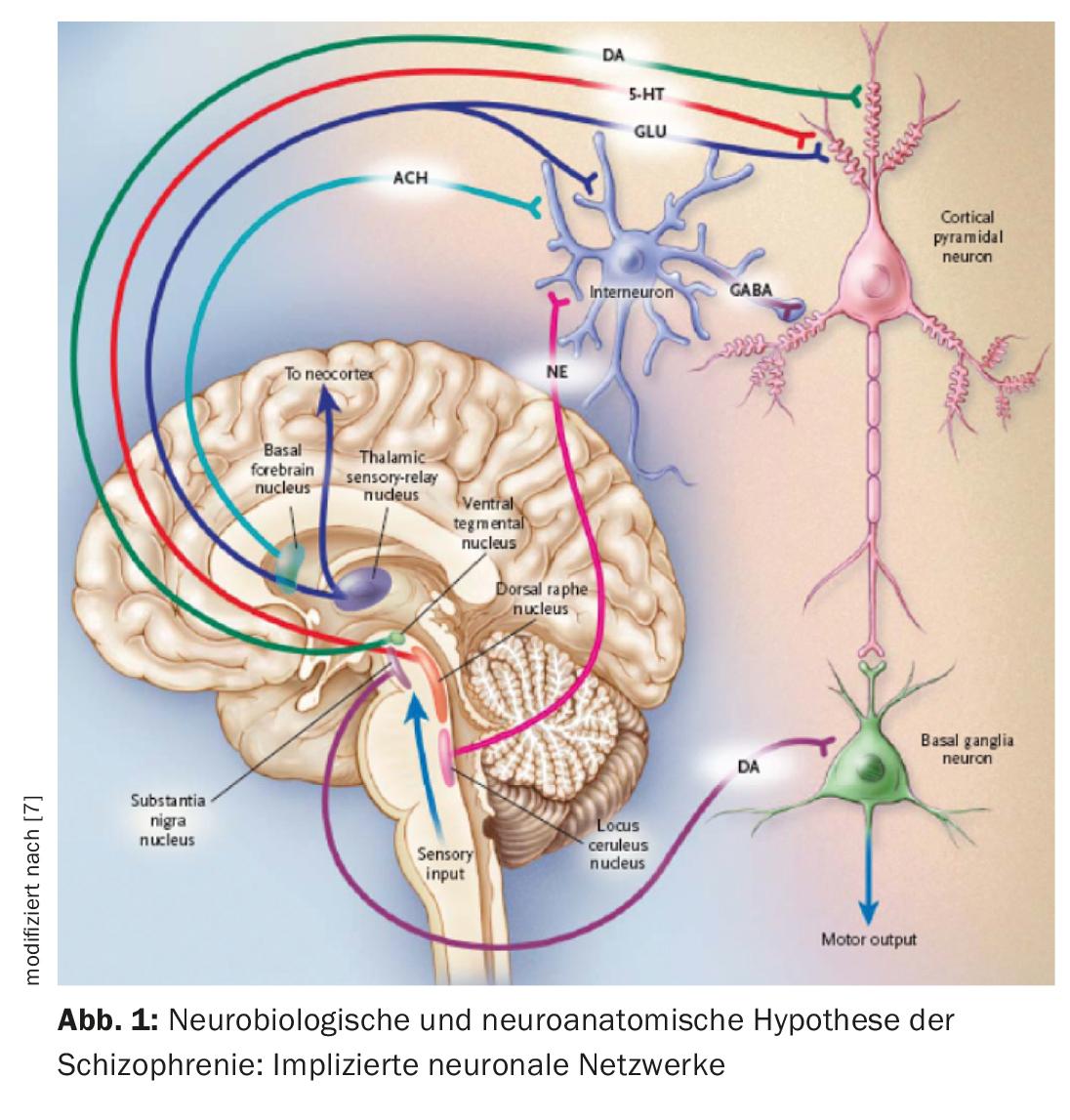
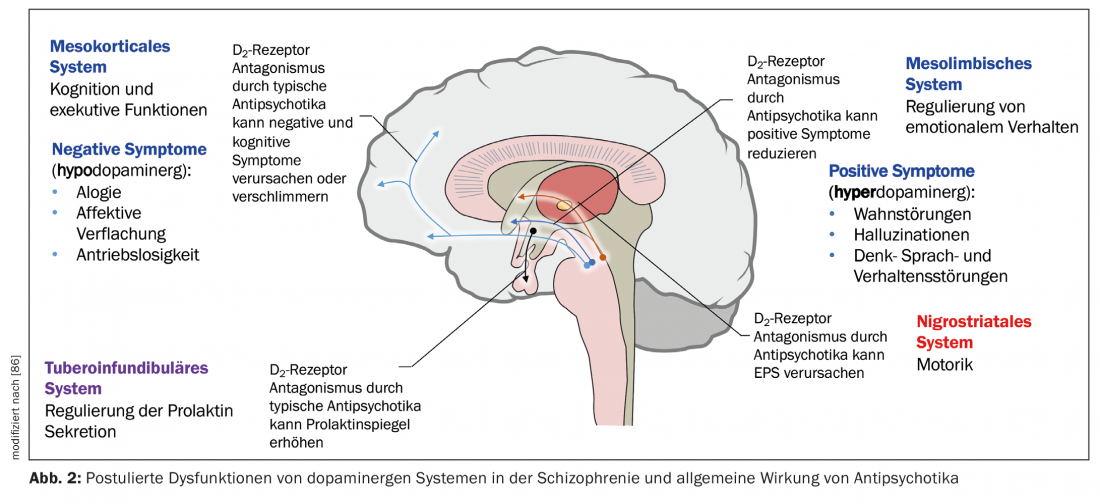
Una hipótesis neurobiológica de la esquizofrenia se basa en la suposición de que el tálamo ya no cumple su función de órgano filtro de los estímulos externos (Fig. 1) [7]. La información sensorial se conduce desde los núcleos talámicos hasta las neuronas piramidales del córtex límbico y el neocórtex a través de aferentes estimuladores glutamatérgicos. Una respuesta excesiva de las neuronas piramidales podría ser el mecanismo responsable de la psicosis, en consonancia con la hiperestimulación observada en los pacientes esquizofrénicos. Diferentes núcleos subcorticales facilitan la respuesta de las neuronas. La disfunción de diversos neurotransmisores como el glutamato, la dopamina (DA), el GABA, la serotonina (5-HT) y la noradrenalina se postula en relación con la etiopatogenia de la esquizofrenia [7,8]. Es posible que el sistema glutamatérgico sea el principal afectado, pero los fármacos que inhiben selectivamente la neurotransmisión glutamatérgica y que han demostrado ser útiles en el tratamiento de la psicosis están aún en fase de desarrollo [9]. Ahora bien, todos los antipsicóticos disponibles actualmente tienen un mecanismo dopaminérgico pero no todos serotoninérgico. La DA del área tegmental ventral activa los receptores D1 y D2, que aumentan la respuesta neuronal al glutamato. La serotonina del núcleo del rafe dorsal activa los receptores 5-HT2A, lo que facilita la liberación de glutamato de las terminales nerviosas. Indirectamente, la actividad glutamatérgica puede disminuir a través de un efecto sobre la 5-HT y la DA. En general, los antipsicóticos inhiben el efecto estimulante de la DA y la 5-HT, así como el de la DA de la sustancia negra en los ganglios basales, por lo que provocan trastornos motores (Fig. 2). Para especificar el papel de cada una de las regiones anatómicas, existen ahora pruebas de un aumento de la actividad dopaminérgica en la zona mesolímbica. Sería responsable de la sintomatología positiva o psicótica, como las alucinaciones y los delirios, mientras que una actividad reducida en el sistema mesocortical con proyecciones al córtex frontal sería coherente con la neurotransmisión hipodopaminérgica. Daría cuenta de síntomas negativos como la apatía, la anhedonia, el retraimiento social y la pobreza de pensamiento (Fig. 2) [10].
Este breve resumen olvida hablar del papel de los receptores D1, D3, 5-HT1a y 5-HT2 y de su farmacología [11]. Ahora resulta sorprendente que la cariprazina tenga una mayor afinidad por los receptores D3 en comparación con el aripiprazol y el brexpiprazol [12,13]. La cariprazina tiene una afinidad por los receptores D3 10 veces mayor que por los receptores D2. Actualmente existe la hipótesis, basada en modelos animales, de que los antagonistas de los receptores D3 influyen favorablemente en el deterioro cognitivo al aumentar la transmisión dopaminérgica en el córtex prefrontal. En cuanto al mecanismo, la cariprazina, por ejemplo, anula una alteración desencadenada por el antagonista de los receptores NMDA del glutamato, la feniciclidina (PCP). Sin embargo, el antagonismo D3 por sí solo no es suficiente para un efecto antipsicótico. Por otro lado, cabe recordar que ciertos antipsicóticos como la lurasidona, la amisulprida, el brexpiprazol y, en menor medida, el aripiprazol son fuertes antagonistas de los receptores 5-HT7 en comparación con otros antipsicóticos, incluida la cariprazina, también un mecanismo que se cree que explica los efectos positivos sobre los trastornos cognitivos [5,14,15].
Farmacología de los agonistas parciales de los receptores dopaminérgicos D2
Mientras que la mayoría de los antipsicóticos son antagonistas dopaminérgicos puros, los agonistas D2 parciales tienen hasta cierto punto la propiedad de actuar como agonistas en caso de baja actividad dopaminérgica, como ocurre en la esquizofrenia en el sistema mesocortical, y como antagonistas en caso de aumento de la actividad dopaminérgica, como ocurre en el sistema mesolímbico. [10]. Por ello, hay autores que, quizá en el sentido de una estrategia de marketing, se refieren al efecto de estos fármacos como “estabilizadores del sistema dopaminérgico” (DSS) [16].
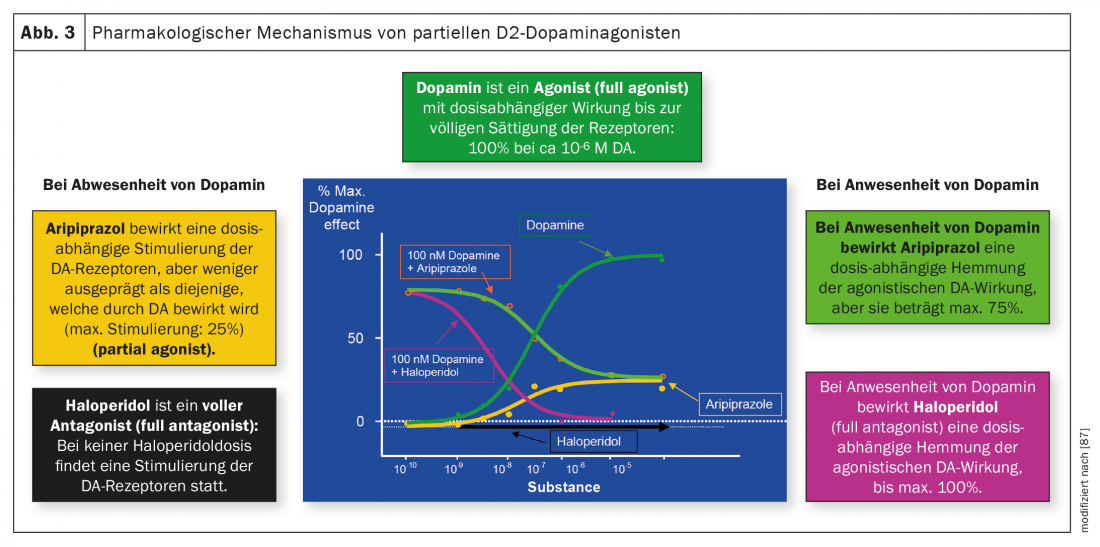
La figura 3 ilustra las diferencias entre antagonistas y agonistas parciales. La dopamina en sí es un agonista, el antipsicótico clásico haloperidol es un antagonista sin ningún efecto agonista sobre los receptores dopaminérgicos, mientras que el aripiprazol tiene un efecto agonista sobre estos receptores en ausencia o baja concentración de dopamina hasta un máximo del 25%. En presencia de dopamina, el haloperidol también tiene un efecto puramente antagonista gracias a su mayor afinidad por estos receptores, mientras que la actividad del aripiprazol es antagonista hasta una inhibición máxima del 75%. El brexpiprazol y la cariprazina tienen un efecto similar al aripiprazol. Como ya se ha mencionado, la cariprazina difiere de los otros dos antipsicóticos relacionados en su afinidad particularmente pronunciada por el receptor D3 y su actividad agonista parcial en este receptor, lo que también podría explicar un efecto sobre los síntomas negativos y el deterioro cognitivo.
La hipótesis de la noradrenalina en la esquizofrenia: aspectos farmacológicos
Aunque el aripiprazol, el brexpiprazol y la cariprazina comparten la propiedad de ser agonistas D2 parciales, su efecto sobre el sistema noradrenérgico es diferente. La primera cuestión es si existen pruebas de su disfunción en los trastornos esquizofrénicos y si el efecto terapéutico de los antipsicóticos puede explicarse a través de este sistema neurotransmisor. Se supone que la hiperactividad del sistema noradrenérgico, más que del dopaminérgico, desempeña un papel en el desarrollo de los síntomas positivos, mientras que la hipoactividad del sistema noradrenérgico es decisiva para los síntomas negativos [17]. Recientemente, un grupo de autores ha formulado ampliamente la hipótesis de que la fenomenología de la esquizofrenia, en particular los síntomas cognitivos, se explica por una interacción anormal entre la susceptibilidad genética y la disfunción noradrenérgica inducida por el estrés del locus coeruleus (un núcleo de neuronas noradrenérgicas) [18]. La investigación actual sobre la esquizofrenia se centra, en efecto, en los aspectos de genética – desarrollo (fase de vida prenatal y postnatal, infancia, adolescencia, edad adulta) – estrés, pero también es cierto que la hipótesis noradrenérgica no es un punto focal en este momento y de ningún modo debe considerarse aislada de otras hipótesis.
Ahora, sin embargo, también hay hallazgos farmacológicos interesantes sobre la hipótesis noradrenérgica de la esquizofrenia. Un metaanálisis sugiere que la comedicación (“aumento”) con los antagonistas α2mirtazapina o mianserina mejora la eficacia de los antagonistas D2 en el tratamiento de la esquizofrenia al reducir los síntomas negativos [19]. Según una revisión de 2020, prácticamente todos los antipsicóticos, incluidos el aripiprazol y el brexpiprazol, son antagonistas de los receptores α1-, α2a-y α2b, pero faltan los datos correspondientes para la cariprazina [20]. Hasta ahora, estas propiedades farmacológicas se han asociado principalmente a efectos secundarios. De hecho, la asenapina (en los receptores α2b) y el brexpiprazol (en los receptores α2c) destacan como los antagonistas más potentes. Los estudios en animales permiten plantear la hipótesis de que el bloqueo de los receptores α1contribuye a la mejora de los síntomas positivos y el de los receptores α2a la mejora de los síntomas negativos y cognitivos. El antagonismo α2csería posiblemente responsable de los efectos procognitivos y de la mejora de la ansiedad y la depresión [21]. Estos receptores tienen una distribución diferente en el cerebro: los receptores α2están muy extendidos y son más frecuentes (90%) que los receptores α2c(10%), que se localizan principalmente en el cuerpo estriado, el hipocampo y el córtex [22].
Metabolismo y farmacocinética del aripiprazol, el brexpiprazol y la cariprazina
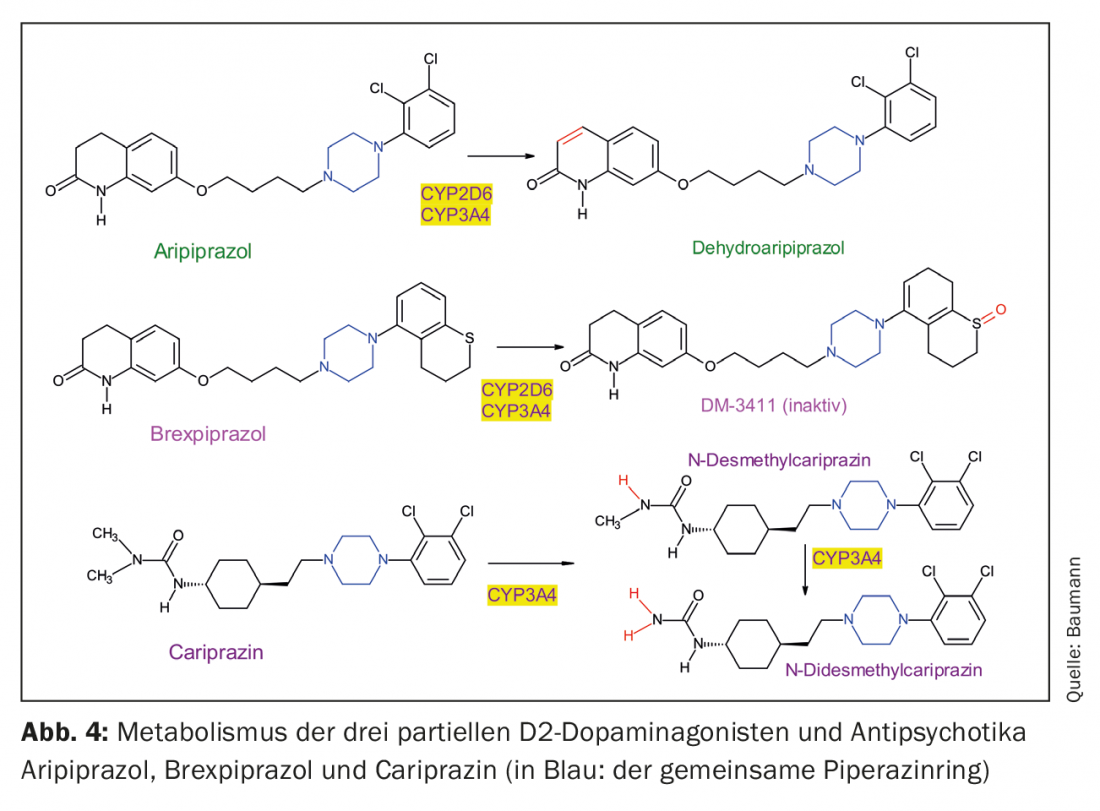
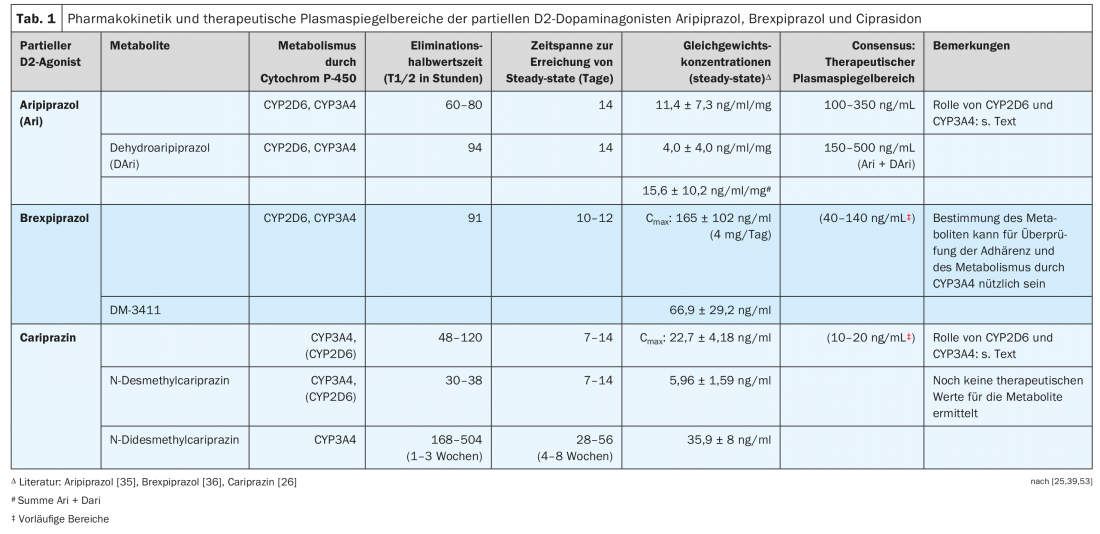
Los tres agonistas parciales D2 son derivados de la piperazina estructuralmente similares, pero difieren en su metabolismo (Fig. 4, Tab. 1). Cabe destacar que la cariprazina es el isómero trans de un compuesto químico, siendo el isómero cis farmacológicamente menos activo [23]. Tanto el aripiprazol como el brexpiprazol no tienen una estructura que dé lugar a dicho isomerismo cis-trans.
El aripiprazol se deshidrata a dehidroaripipiprazol, que ejerce una actividad farmacológica similar a la de su sustancia madre. El brexpiprazol es sulfoxidado por el CYP2D6 al metabolito (DM-3411) [24], que, sin embargo, es farmacológicamente significativamente menos activo que la sustancia madre y tampoco entra en el cerebro [24]. Esto no era necesariamente de esperar ya que, por ejemplo, el metabolito sulfóxido de la tioridazina, la mesoridazina, también se comercializaba como antipsicótico. La biotransformación de la cariprazina es más complicada, ya que aunque la desmetilcariprazina farmacológicamente activa se forma a través de una primera N-desmetilación, sus concentraciones de equilibrio en la sangre de los pacientes tratados con cariprazina son significativamente inferiores a las de la sustancia madre y el siguiente metabolito, también producto de la N-desmetilación: se trata de la N-desmetilcariprazina farmacológicamente activa, cuyas concentraciones en estado estacionario superan a las de la cariprazina debido a su semivida de eliminación especialmente larga. (Tab. 1) [25, 26].
Dado que apenas existen publicaciones hasta la fecha sobre la importancia clínica del polimorfismo genético del CYP2D6 en el tratamiento de pacientes con brexpiprazol (o cariprazina), el tema sólo se abordará brevemente aquí. No sólo el aripiprazol sino también su metabolito activo son sustratos del CYP2D6; sus niveles plasmáticos dependen en gran medida del genotipo CYP2D6. Esto explica la recomendación en recientes artículos de revisión y metaanálisis de considerar el genotipado CYP2D6 en pacientes tratados con aripiprazol en determinadas condiciones. Esto también es cierto para el brexpiprazol, también un sustrato de CYP2D6, pero los datos son limitados [27–30]. Por ejemplo, no existen estudios farmacogenéticos publicados sobre el brexpiprazol, salvo uno realizado en Japón: en él sólo se examinaron los metabolizadores normales (extensos (ME) e intermedios (MI) de los sustratos del CYP2D6, ya que apenas existen parejas con una deficiencia genética del CYP2D6 (metabolizadores pobres (MP)) en este grupo de personas. También cabe mencionar un estudio basado en un modelo farmacocinético. Se utiliza una simulación para comparar la farmacocinética del brexpiprazol en los llamados metabolizadores “extensivos” (normales) con la cinética en PM calculada según el modelo teórico [31]. Estos estudios confirman la recomendación de ajustar la dosis de brexpiprazol al genotipo CYP2D6 del paciente. Esto significa prescribir sólo la mitad de la dosis habitual a los pacientes con una deficiencia genética o una dosis más alta a los metabolizadores ultrarrápidos. La dosis de ambos antipsicóticos también debe reducirse en caso de comedicación con inhibidores potentes del CYP2D6 como la fluoxetina o la paroxetina. Para los tres agonistas parciales D2, la dosis debe ajustarse a la baja en caso de comedicación con inhibidores del CYP3A4 como el ketoconazol, y aumentarse si se pretende utilizar como comedicación fármacos inductores del CYP3A4 como la carbamazepina o ciertos extractos de hierba de San Juan que contienen hiperforina. La mayoría de los datos sólo se han recogido para el aripiprazol [32,33]. El brexpiprazol inhibe por sí mismo moderadamente la CYP2B6, y sólo débilmente la CYP2C9, CYP2C19, CYP2D6 y CYP3A4, y su efecto inhibidor de moléculas transportadoras como la glicoproteína P (P-gP) es también escasamente relevante desde el punto de vista clínico según los experimentos in vitro. El brexpiprazol tampoco es un sustrato de la P-gP [34].
La tabla 1 muestra ejemplos de concentraciones sanguíneas de equilibrio medidas en sujetos o pacientes durante la administración de uno de los tres agonistas parciales D2 [26,35,36].
Agonistas parciales D2 como preparados de depósito y su farmacocinética
Los preparados de depósito de antipsicóticos existen desde hace décadas, por ejemplo con el decanoato de haloparidol, mediante la esterificación de los grupos hidroxi existentes de los fármacos con ácidos grasos largos [37–39]. A continuación se disuelven en aceite y se administran por vía intramuscular al paciente como LAI (fármaco antipsicótico inyectable de acción prolongada). Esta técnica ya no era aplicable a productos como la risperidona, ya que no tienen grupo OH esterificable. Para ellos, se utilizó una nueva técnica inyectando dichos antipsicóticos encerrados en microesferas. Dado que ni el aripiprazol, ni el brexpiprazol ni la cariprazina son compuestos hidroxilados (Fig. 1), habría que desarrollar un método similar para ellos. Hasta ahora, sólo existe en el mercado un preparado LAI para el aripiprazol, pero hay estudios con el objetivo de ofrecer también brexpiprazol como LAI [40]. Existen incluso dos formas de depósito para el aripiprazol: en Suiza se ha introducido el aripiprazol monohidrato, mientras que en EE.UU. también se ofrece el aripiprazol lauroxil [41]. Es el producto de un enlace covalente del ácido láurico (ácido dodecanoico) a un átomo de nitrógeno del aripiprazol (Fig. 4) [42]. Esto debe tenerlo en cuenta el médico tratante para los pacientes procedentes del extranjero, ya que las dosis difieren para los dos preparados. Dado que los antipsicóticos atípicos de depósito suelen presentar el problema del aumento de peso y del IMC y de la elevación de la prolactina (excepción: aripiprazol) [43], sería ventajoso disponer también de LAI de brexipirazol y cariprazina [44], que tienen un perfil más favorable a este respecto, como se muestra a continuación.
Medición de la unión de agonistas parciales D2 en el sistema nervioso central mediante tomografía por emisión de positrones (PET).
Una cuestión importante es hasta qué punto los antipsicóticos son activos en el cerebro y en qué medida se unen a receptores terapéuticamente importantes. Los estudios PET lograron demostrar por primera vez la unión del aripiprazol a los receptores D2 y D3 en el cerebro humano [45–48]. La saturación completa de la unión de los receptores centrales D2/D3 ya se alcanza con una concentración plasmática de 100-150 ng/mL de aripiprazol en pacientes esquizofrénicos tratados con este antipsicótico [47], y en este estudio se midió una concentración plasmática media de aripiprazol de 228 ng/mL (s.d.: 142 ng/mL) en todo el grupo de pacientes (n=16).
También se han publicado estudios PET de este tipo para la cariprazina [49] y el brexpiprazol [24,50,51]. Dependiendo del ligando PET utilizado, no es posible distinguir entre la unión a receptores D2 o D3. Esta técnica tampoco determina directamente la proporción del metabolito activo en la unión, por lo que en realidad proporciona pruebas de la unión de la “fracción activa” (a saber, aripiprazol + dehidroaripipiprazol; brexpiprazol; cariprazina + N-desmetilcariprazina + N-didesmetilcariprazina). Dado que el brexpiprazol no tiene ningún metabolito activo, la unión observada se refiere únicamente a la molécula madre, ya que, además, el metabolito no entra en el cerebro [24]. Otra limitación de la técnica PET es que la proporción respectiva de antagonismo/agonismo no puede deducirse directamente de los datos recogidos. No obstante, los estudios PET aportan hallazgos muy importantes, como la observación de que también existe una curva dosis-respuesta para el brexpiprazol entre su nivel plasmático y su unión a los receptores D2/D3 en la zona estriada, como ya se ha informado para el aripiprazol [45]. Cuatro horas después de una dosis única (5 ó 6 mg) de brexpiprazol, la unión alcanza el 77-78% en el putamen y el caudado; permanece relativamente estable hasta 23,5 h después de la administración [51]. Se recuerda que el efecto de un antipsicótico tiene un rango de unión del 60-80%, y que una unión más fuerte aumenta el riesgo de efectos secundarios extrapiramidales [52], lo que puede ocurrir con los antagonistas D2/D3 puros más que con los agonistas D2 parciales como el aripiprazol [45]. Con una unión del 50% de la unión máxima (Omax: aprox. 90-95%), los niveles plasmáticos de brexpiprazol correspondientes serían de aprox. 8 ng/mL [51]. Si los datos se extrapolan ahora al tratamiento con dosis múltiples de 2 mg/día de brexpiprazol, cabe esperar una unión al receptor D2/D3 superior al 80%, valor algo superior al comunicado en otro estudio PET [50] debido a la elección de un ligando diferente.
Estudios sobre la relación: niveles plasmáticos de agonistas parciales D2 – efecto clínico
Para el aripirazol en particular, existen varios estudios sobre la relación entre sus niveles plasmáticos y su efecto clínico en pacientes esquizofrénicos. Las directrices de consenso del grupo AGNP-TDM (Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie) [53] y las publicadas con la Sociedad Americana de Psicofarmacología Clínica [54] recomiendan unos rangos de niveles plasmáticos, que se muestran en la Tabla 1 . Los intervalos de niveles plasmáticos indicados para el brexpiprazol y la cariprazina deben considerarse provisionales debido a la insuficiencia de datos. Los intervalos dados para la cariprazina no especifican si incluyen también los metabolitos.
Estudios recientes de eficacia clínica sobre el aripiprazol, el brexpiprazol y la cariprazina
En los últimos dos años se han publicado varias revisiones sobre las propiedades clínicas del brexpiprazol [55] y la cariprazina [56,57]. Dado que en la actualidad se carece de estudios comparativos directos entre los tres agonistas parciales D2, deben utilizarse estudios en red para realizar comparaciones indirectas [6,58]. Un metaanálisis de la eficacia clínica de 32 antipsicóticos orales descubrió que prácticamente todos estos fármacos eran significativamente más beneficiosos que el placebo [58], incluidos el aripiprazol, el brexpiprazol y la cariprazina. Se trataba de la puntuación total, así como de los síntomas positivos, negativos y depresivos. No obstante, la presentación de los datos sugiere que el brexpiprazol difiere menos del placebo que el aripiprazol y la cariprazina. Los autores lo justifican con la observación de que, a lo largo de las décadas, el efecto placebo en tales estudios comparativos ha aumentado de forma constante, y esto fue particularmente evidente con el agonista parcial D2 más reciente. El brexpiprazol resultó ser mejor que el placebo en el “funcionamiento social”, en contraste con el aripiprazol, que no se diferenció del placebo, mientras que no hubo datos al respecto para la cariprazina. Al comparar los datos sobre la interrupción del tratamiento, el aripiprazol y el brexpiprazol obtuvieron mejores resultados que el placebo, al contrario que la cariprazina. Para una comparación mutua de las propiedades clínicas de estos antipsicóticos directos, ahora serían necesarios estudios comparativos directos, pero hasta ahora sólo existen de forma limitada [59,60], concretamente sólo un estudio abierto y exploratorio de 6 semanas entre el aripiprazol y el brexpiprazol [61].
Sin embargo, un estudio con cariprazina había atraído gran atención al demostrar que funcionaba significativamente mejor que la risperidona para el tratamiento de los síntomas negativos en pacientes esquizofrénicos con síntomas negativos predominantes [62,63]. Por desgracia, este estudio aún no se ha reproducido para confirmar este importante hallazgo. En un interesante metaanálisis, que también incluía otros antipsicóticos, se descubrió que las dosis diarias óptimas para el tratamiento de los síntomas negativos y positivos diferían de un fármaco a otro: Aripiprazol (11,9 mg [für die negative Symptomatik], 11 mg [für die positive Symptomatik]). Las dosis correspondientes para el brexpiprazol son: (2,1 mg y 4 mg respectivamente); para la cariprazina: (4 mg y 6,51 mg respectivamente): En sentido estricto, se trata de las dosis ED95 (dosis eficaz 95%) con las que los síntomas respectivos se reducen al máximo [64]. En un estudio similar, también se calculó la ED95, es decir, la reducción del 95% de los síntomas positivos medidos con la escala PANSS o la BPRS en comparación con el placebo. [65]Es de 11,5 mg/día (dosis equivalente a 1 mg/día de risperidona: 1,8 mg/día) para el aripiprazol, 3,36 mg/día (0,54 mg/día) para el brexpiprazol y 7,6 mg/día para la cariprazina. La curva dosis-respuesta para el brexpiprazol y la cariprazina muestra una meseta a dosis más altas, y una curva en forma de campana para el aripiprazol, lo que significa que dosis más altas no prometen ningún efecto adicional.
Reacciones adversas a los medicamentos (RAM)
Con pocas excepciones, los antipsicóticos que se siguen utilizando hoy en día no difieren significativamente en su eficacia clínica en los trastornos esquizofrénicos [58]. La situación es diferente con sus perfiles de efectos secundarios, tal y como se presenta en tres notables revisiones o metaanálisis en red [58,6,25] (Tab. 2), así como en otras publicaciones [20,66,67]. Muchas RAM de los antipsicóticos muestran una dependencia de la dosis según la bibliografía, como se ha documentado para el aripiprazol pero aún no para el brexpiprazol y la cariprazina [68].
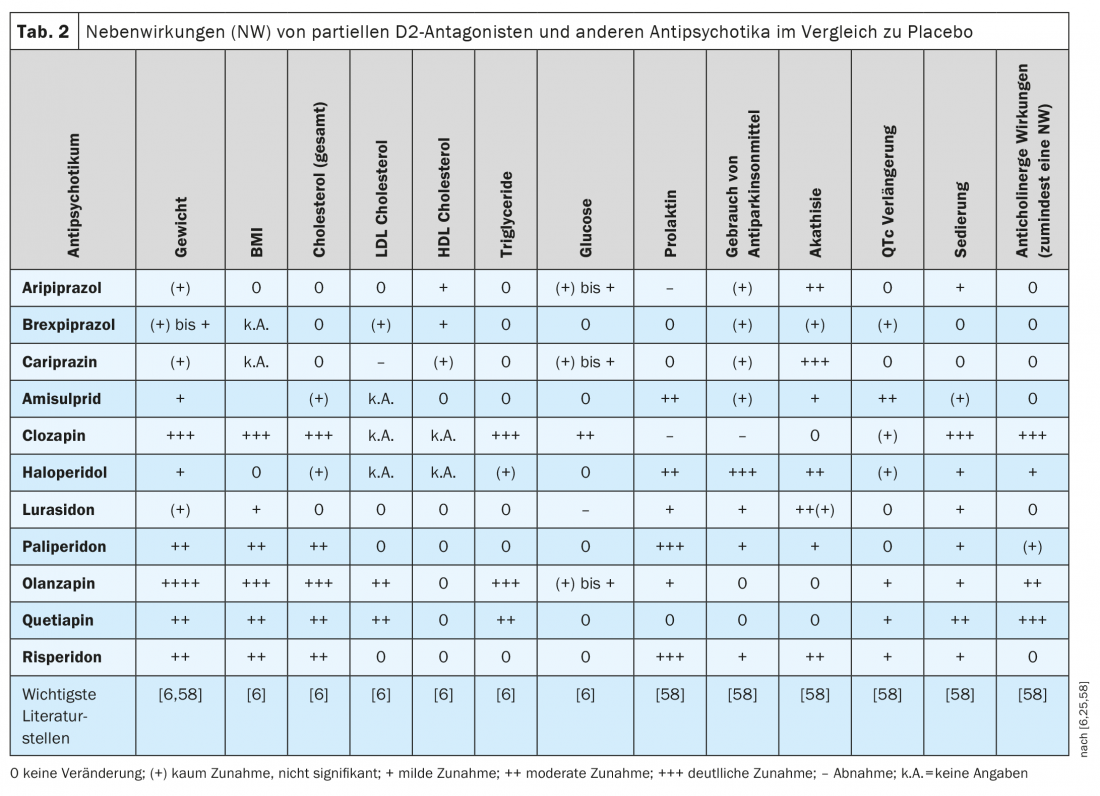
En el estudio comparativo directo entre el brexpiprazol y el aripiprazol citado anteriormente, la acatisia se produjo con menos frecuencia con el brexpiprazol (9,4%) que con el aripiprazol (21,2%), pero no hubo diferencias significativas entre los dos inhibidores parciales D2 en el efecto clínico [61], ni en los niveles de prolactina medidos. Sin embargo, muchos pacientes experimentaron un aumento de peso clínicamente significativo(≥7%) tras 6 semanas de farmacoterapia tanto en el grupo de brexpiprazol (35% de los pacientes) como en el de aripiprazol (19%): un hallazgo que se confirmó en un análisis en red [60] pero que parece bastante elevado según otras revisiones [59,69]. Como se muestra en la Tabla 2 , basándose en la literatura, los tres agonistas parciales D2 se comportan bastante bien en comparación con muchos otros antipsicóticos en términos de aumento de peso o incremento del IMC. Puede haber aumento de peso en algunos pacientes y pérdida de peso en otros, pero esto sólo refleja la amplitud del intervalo de confianza que no se muestra aquí (en su mayoría IC: 95%), que se expresa en mayor o menor medida en dichos cálculos estadísticos de un fármaco a otro. El aripiprazol tiende a funcionar ligeramente mejor que el brexpiprazol y la cariprazina [6,25,58], y un reciente estudio retrospectivo demostró que el peso corporal y el IMC aumentaban significativamente en los pacientes tratados con brexpiprazol pero no con cariprazina [70]. En comparación con otros antipsicóticos de 2ª generación, la dislipidemia se produce con menos frecuencia con los tres agonistas parciales D2 (Tab. 2).
Remitiéndonos de nuevo al estudio comparativo [61], el ECG apenas mostró cambios de media, y si lo hizo, cambios clínicamente irrelevantes bajo aripiprazol y brexpiprazol. No obstante, estas mediciones son apropiadas, ya que en un paciente que tomaba brexpiprazol el valor del QTcF aumentó (399 ms antes del tratamiento; 442 ms cuando se interrumpió). También hubo que interrumpir el tratamiento en un paciente que tomaba aripiprazol debido a cambios en el ECG. Serían necesarios más estudios de comparación directa de este tipo para mostrar diferencias claras entre estos agonistas parciales D2.
En comparación con otros antipsicóticos con un fuerte antagonismo D2, los antagonistas parciales D2 no aumentan la prolactina en sangre (Tab. 2) . Con el aripiprazol, al igual que con la clozapina, ocasionalmente puede observarse incluso una disminución de los niveles de prolactina en comparación con el placebo. Por ello, el aripiprazol se considera la primera opción para reducir los niveles plasmáticos elevados de prolactina en pacientes esquizofrénicos [71]. Un estudio farmacocinético mostró correlaciones negativas significativas entre los niveles de prolactina y las concentraciones plasmáticas de aripiprazol y la suma de aripiprazol y dehidro-aripiprazol en pacientes esquizofrénicos tratados con aripiprazol. Se produjo hipoprolactinemia (<8 ng/mL) en varios pacientes, aunque las posibles consecuencias clínicas no están claras (disfunción eréctil, disminución de la producción de leche, síntomas de ansiedad) [72]. Por otra parte, los pacientes sometidos a aripiprazol o cariprazina sufren con más frecuencia acatisia que los sometidos a brexpiprazol (Tab. 2).
Un “aumento” de una terapia antidepresiva con max. 2 mg/día de brexpiprazol en pacientes deprimidos [73] que no responden a la monoterapia con antidepresivos es una opción terapéutica interesante [74]. Sin embargo, la polimedicación también conlleva riesgos, como se describe en un informe de un paciente que desarrolló hipomanía tras una semana de comedicación con brexpiprazol después de que el paciente deprimido hubiera respondido inadecuadamente al tratamiento combinado con mirtazapina y duloxetina. Llamativamente, tras suspender el brexpiprazol, este efecto secundario desapareció [75]. Esta observación estaría más o menos en consonancia con los resultados de 2 estudios que no mostraron ningún beneficio del brexpiprazol en comparación con el placebo en el tratamiento de la manía bipolar [76].
Preguntas clínicas especiales
Discinesias tard ías: Un reciente metaanálisis de estudios sobre los EPS en pacientes psiquiátricos tratados con antipsicóticos encontró una alta prevalencia de efectos secundarios motores: EPS: 20%; acatisia: 11%; discinesias tardías: 7% [77]. El mismo grupo de autores informó de una incidencia anual de discinesia tardía del 0,68-6,5%. Se producen en alrededor del 15-30% de los pacientes tratados crónicamente con antipsicóticos [78]. Hoy en día, los antipsicóticos pueden prescribirse con mayor frecuencia, no sólo para los trastornos esquizofrénicos sino también para los trastornos bipolares y como medicación complementaria para las psicosis afectivas. Por lo tanto, es urgente preguntarse hasta qué punto los fármacos modernos, como los antipsicóticos agonistas parciales D2, pueden causar discinesia tardía. La cuestión de la discinesia tardía también es de actualidad, ya que la deutetrabenazina y la valbenazina se han introducido con la indicación de discinesia tardía en EE.UU., pero aún no en Suiza [79]. El aripiprazol causa menos discinesia tardía que el haloperidol según un estudio más antiguo [80]. Una revisión de 2018 describió la aparición de estas RAM tras el tratamiento con aripiprazol, pero posiblemente debido a su reciente introducción, aún no se han notificado casos de este tipo tras el tratamiento con brexpiprazol o cariprazina [81].
Agonistas parciales D2 en pacientes psicogeriátricos: Los antipsicóticos suelen llevar una advertencia para su uso en pacientes psicogeriátricos que sufren psicosis asociada a la demencia. El riesgo de mortalidad aumenta en los pacientes tratados con antipsicóticos atípicos (incluido el aripiprazol) en comparación con el placebo, es decir, como consecuencia de reacciones adversas cardiovasculares (por ejemplo, insuficiencia cardiaca, muerte súbita cardiaca), infecciosas (por ejemplo, neumonía) o cerebrovasculares. Sin embargo, también existen estudios sobre el efecto de los agonistas parciales D2 en pacientes agitados diagnosticados de enfermedad de Alzheimer. Por ejemplo, dos ensayos de 12 semanas controlados con placebo demostraron recientemente una eficacia satisfactoria y una tolerabilidad relativamente buena de 2 mg/día de brexpiprazol en pacientes de Alzheimer agitados, en los que el síntoma objetivo era la agitación [82]. El éxito de este estudio motivó entonces a los fabricantes de brexpiprazol a realizar más estudios. Una revisión recientemente publicada sobre innovaciones farmacoterapéuticas en pacientes psicogeriátricos citaba este estudio en este ámbito [82], pero ninguno referido al aripiprazol o la cariprazina [83].
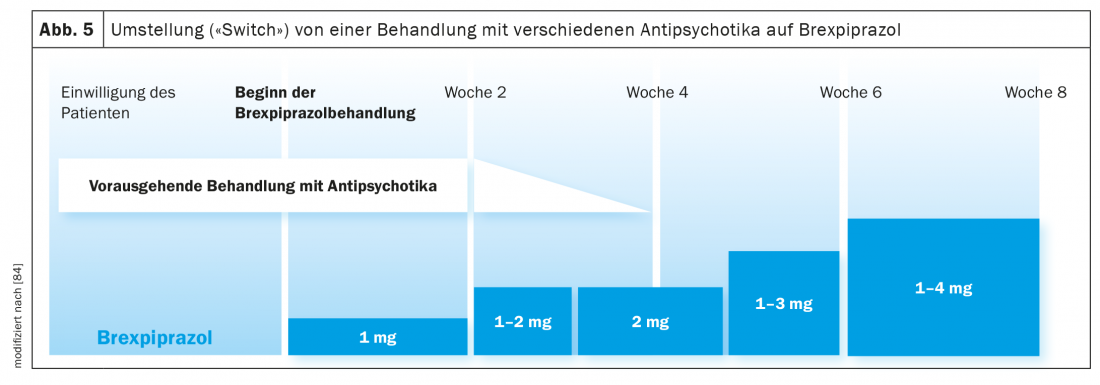
Cambio de tratamiento antipsicótico a bre xpiprazol: En un estudio clínico, se investigaron las consecuencias de cambiar a pacientes que sufrían esquizofrenia o psicosis afectiva de un tratamiento con diferentes antipsicóticos a brexpiprazol (Fig. 5) [84]. El cambio se realizó durante cuatro semanas manteniendo el tratamiento antipsicótico anterior durante cuatro semanas. Se retiró lentamente al principio de la semana 3, y a partir de la semana 4 sólo se continuó con la medicación de brexpiprazol, que se había introducido al principio de la semana 1 con una dosis baja (1 mg/día, luego 1-2 mg/día, 4 mg/día). (Fig. 5). La dosis máxima de brexpiprazol fue de 4 mg/día (en el 50% de los 200 pacientes), pero se ajustó individualmente según los criterios del CGI. Tras la octava semana del estudio, la tasa de interrupción alcanzó el 17%. Como era más o menos de esperar, esta tasa fue sólo del 4,9% en los pacientes cambiados de aripiprazol a brexpiprazol, pero del 25,4% en los pacientes tratados con otros antipsicóticos. En resumen, un periodo de cambio de 4 semanas parece demasiado corto, especialmente con una medicación previa con, por ejemplo, olanzapina, que se caracteriza por sus propiedades anticolinérgicas. También hay que tener en cuenta que las largas semividas (Tab. 1 ) del aripiprazol, el brexpiprazol y la cariprazina hacen que las concentraciones de equilibrio no se alcancen antes de 10 días. En otro estudio de conversión, se observó que la introducción de brexpiprazol tenía un efecto beneficioso sobre la sintomatología preexistente del EPS. No sólo se produjo un aumento del colesterol HDL y una disminución del peso corporal y del IMC de los pacientes, sino también un descenso significativo de los niveles de prolactina (la mayoría de los pacientes fueron pretratados con risperidona o paliperidona) [85]. Este efecto beneficioso del brexpiprazol también se observó en la paciente aquí descrita (descripción del caso) tras pasar de la risperidona al agonista parcial D2.
Observaciones finales
Comparando el perfil práctico deseado de los antipsicóticos presentado por Eich y Gentsch (2019) en su revisión sobre su seguridad y tolerabilidad óptimas [2], a saber: Ausencia o escasez de EPS, ausencia de agranulocitosis, ausencia o escasez de aumento de peso, ausencia o escasez de sedación, ausencia de cardiotoxicidad (ausencia de prolongación del QTc, ausencia de hipotensión), ausencia de elevación de la prolactina/sin disfunción sexual, ausencia o escasez de interacciones, los tres agonistas parciales D2 aripiprazol, brexpiprazol y cariprazina cumplen satisfactoriamente algunos de estos deseos. No obstante, tras unos 70 años de investigación de orientación biológica, uno desearía ver un “salto cuántico” en el desarrollo de fármacos antipsicóticos eficaces. Probablemente esto sólo será posible una vez que la investigación nos haya proporcionado más conocimientos sobre las causas neurobiológicas de los trastornos esquizofrénicos, que podremos utilizar para desarrollar nuevas herramientas terapéuticas.
Mensajes para llevarse a casa
- Los tres agonistas dopaminérgicos parciales D2 aripiprazol, brexpiprazol y cariprazina muestran un efecto significativamente mejor como antipsicóticos que el placebo en el tratamiento farmacológico de los trastornos esquizofrénicos.
- En términos de seguridad y tolerabilidad, son más beneficiosos que muchos otros antipsicóticos de primera y segunda generación, sobre todo en lo que respecta al uso de fármacos antiparkinsonianos, así como al aumento del peso corporal y de los niveles de prolactina. El riesgo de efectos secundarios metabólicos y anticolinérgicos es bajo. Por otro lado, la aparición de acatisia es especialmente digna de mención durante la terapia con cariprazina y aripiprazol.
- Dado que el aripiprazol y el brexpiprazol son metabolizados por el CYP2D6, pero también como la cariprazina por el CYP3A4, debe tenerse en cuenta el riesgo de interacciones farmacocinéticas (inhibición, inducción) para los tres antipsicóticos.
- Dependiendo del genotipo CYP2D6 del paciente, se recomienda ajustar la dosis de aripiprazol o brexpiprazol.
- Faltan datos sobre las recomendaciones para la monitorización terapéutica (TDM) del brexpiprazol y la cariprazina.
Literatura:
- McCutcheon RA, Reis Marques T, Howes OD: Esquizofrenia – Una visión general. JAMA psiquiatría 2020;77(2): 201-210.
- Eich P, Gentsch K: Similitudes y diferencias de los agonistas parciales de la dopamina. InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(6): 16-21.
- Barnes TR, Drake R, Paton C, et al: Directrices basadas en la evidencia para el tratamiento farmacológico de la esquizofrenia: Recomendaciones actualizadas de la Asociación Británica de Psicofarmacología. J Psychopharmacol. 2020;34(1): 3-78.
- Sakurai H, Yasui-Furukori N, Suzuki T, et al: Tratamiento farmacológico de la esquizofrenia: Consenso de expertos japoneses. Farmacopsiquiatría. 2021;54(2): 60-67.
- Frankel JS, Schwartz TL: Brexpiprazol y cariprazina: distinguiendo dos nuevos antipsicóticos atípicos del estabilizador dopaminérgico original aripiprazol. Ther Adv Psychopharmacol. 2017;7(1): 29-41.
- Pillinger T, McCutcheon RA, Vano L, et al: Efectos comparativos de 18 antipsicóticos sobre la función metabólica en pacientes con esquizofrenia, predictores de la desregulación metabólica y asociación con la psicopatología: una revisión sistemática y un metaanálisis en red. The Lancet Psychiatry. 2020;7(1): 64-77.
- Freedman R: Esquizofrenia. New England Journal of Medicine. 2003; 349: 1738-1749.
- McCutcheon RA, Krystal JH, Howes OD: Dopamina y glutamato en la esquizofrenia: biología, síntomas y tratamiento. Psiquiatría mundial. 2020; 19(1): 15-33.
- Koblan KS, Kent J, Hopkins SC, et al: Un fármaco que no se une al receptor D2 para el tratamiento de la esquizofrenia. N Engl J Med. 2020;382(16): 1497-1506.
- Lieberman JA: Agonistas parciales de la dopamina: una nueva clase de antipsicóticos. CNSDrugs. 2004;18(4): 251-267.
- Kondej M, Stepnicki P, Kaczor AA: Enfoque multiobjetivo para el descubrimiento de fármacos contra la esquizofrenia. Int J Mol Sci. 2018;19(10).
- Stahl SM: Fármacos para la psicosis y el estado de ánimo: acciones únicas en los subtipos de receptores dopaminérgicos D3, D2 y D1. CNS Spectr. 2017; 22(5): 375-384.
- Neill JC, Grayson B, Kiss B, et al: Efectos de la cariprazina, un nuevo antipsicótico, sobre el déficit cognitivo y los síntomas negativos en un modelo roedor de sintomatología esquizofrénica. Eur Neuropsychopharmacol. 2016;26(1): 3-14.
- Risbood V, Lee JR, Roche-Desilets J, Fuller MA: Lurasidona: un antipsicótico atípico para la esquizofrenia. Ann Pharmacother 2012; 46(7-8): 1033-1046.
- Harvey PD, Siu CO, Hsu J, et al: Efecto de la lurasidona sobre el rendimiento neurocognitivo en pacientes con esquizofrenia: Un estudio a corto plazo controlado con placebo y activo seguido de una extensión a doble ciego de 6 meses. Eur Neuropsychopharmacol. 2013; 23(11): 1373-1382.
- Kikuchi T, Maeda K, Suzuki M, et al: Investigación del descubrimiento e historia del desarrollo de los agonistas parciales del receptor D2 de la dopamina, aripiprazol y brexpiprazol. Neuropsychopharmacol Rep. 2021;41(2): 134-143.
- Yamamoto K, Shinba T, Yoshii M: Síntomas psiquiátricos de la disfunción noradrenérgica: una visión fisiopatológica. Psiquiatría Clin Neuroci 2014;68(1): 1-20.
- Maki-Marttunen V, Andreassen OA, Espeseth T: El papel de la norepinefrina en la fisiopatología de la esquizofrenia. Neurosci Biobehav Rev. 2020;118: 298-314.
- Hecht EM, Landy DC: Terapia complementaria con antagonistas de los receptores alfa-2 en el tratamiento de la esquizofrenia; un metaanálisis. Schizophr Res. 2012; 134(2-3): 202-206.
- Siafis S, Tzachanis D, Samara M, Papazisis G: Fármacos antipsicóticos: de los perfiles de unión a receptores a los efectos secundarios metabólicos. Neurofarmacología actual 2018; 16(8): 1210-1223.
- Maletic V, Eramo A, Gwin K, Offord SJ, Duffy RA. El papel de la norepinefrina y sus receptores alfa-adrenérgicos en la fisiopatología y el tratamiento del trastorno depresivo mayor y la esquizofrenia: una revisión sistemática. Psiquiatría frontal. 2017(8): 42.
- Uys MM, Shahid M, Harvey BH: Therapeutic Potential of Selectively Targeting the alpha2C-Adrenoceptor in Cognition, Depression, and Schizophrenia-New Developments and Future Perspective. Front Psychiatry 2017; 8: 144.
- Yuan R-X, Xu J-W, Song L-H, et al: Una síntesis cómoda y práctica del isómero cis del primer agonista parcial del receptor D3-D2 del anillo preferente de la dopamina activo por vía oral, la cariprazina. Comunicaciones sintéticas 2021; 51(14): 2127-2134.
- Sasabe H, Koga T, Furukawa M, et al.: Farmacocinética y metabolismo del brexpiprazol, un nuevo modulador de la actividad serotonina-dopamina y su principal metabolito en rata, mono y humano. Xenobiotica 2021; 51(5): 590-604.
- Keks N, Hope J, Schwartz D, et al: Tolerabilidad comparativa de los agonistas parciales del receptor D2/3 de la dopamina para la esquizofrenia. Fármacos para el SNC 2020.
- Nakamura T, Kubota T, Iwakaji A, et al: Estudio de farmacología clínica de la cariprazina (MP-214) en pacientes con esquizofrenia (tratamiento de 12 semanas). Drug Des Devel Ther 2016; 10: 327-338.
- Milosavljevic F, Bukvic N, Pavlovic Z, et al: Association of CYP2C19 and CYP2D6 Poor and Intermediate Metabolizer Status With Antidepressant and Antipsychotic Exposure: A Systematic Review and Meta-analysis. JAMA psychiatry 2021; 78(3): 270-280.
- Islam F, Men X, Yoshida K, et al: Avances guiados por la farmacogenética en el tratamiento antipsicótico. Clin Pharmacol Ther 2021; 110(3): 582-588.
- Bousman CA, Bengesser SA, Aitchison KJ, et al: Revisión y consenso sobre las pruebas farmacogenómicas en psiquiatría. Farmacopsiquiatría 2021; 54(1): 5-17.
- Carvalho Henriques B, Yang EH, et al: ¿Cómo pueden el metabolismo de los fármacos y la genética de los transportadores informar sobre la prescripción de psicotrópicos? Fronteras de la genética 2020; 11: 491895.
- Elmokadem A, Bruno CD, Housand C, Jordie EB, Chow CR, Lesko LJ, et al. Farmacocinética del brexpiprazol en metabolizadores deficientes de CYP2D6: Uso de modelos farmacocinéticos basados en la fisiología para optimizar el tiempo hasta las concentraciones efectivas. J Clin Pharmacol. 2021.
- Waade RB, Christensen H, Rudberg I, et al.: Influencia de la comedicación en las concentraciones séricas de aripiprazol y dehidroaripipiprazol. Ther Drug Monit 2009; 31(2): 233-238.
- Castberg I, Spigset O: Efectos de la comedicación en los niveles séricos de aripiprazol: evidencia de un servicio rutinario de monitorización de fármacos terapéuticos. Farmacopsiquiatría 2007; 40(3): 107-110.
- Sasabe H, Koga T, Furukawa M, Matsunaga M, et al: Evaluaciones in vitro de las interacciones farmacocinéticas de un nuevo modulador de la actividad serotonina-dopamina, el brexpiprazol. Xenobiotica 2021; 51(5): 522-535.
- Kirschbaum KM, Muller MJ, Malevani J, et al: Niveles séricos de aripiprazol y dehidroaripipiprazol, respuesta clínica y efectos secundarios. World J Biol Psychiatry 2008; 9(3):212-218.
- Ishigooka J, Iwashita S, Higashi K, et al. Farmacocinética y seguridad del brexpiprazol tras la administración de dosis múltiples a pacientes japoneses con esquizofrenia. J Clin Pharmacol 2018; 58(1): 74-80.
- Correll CU, Kim E, Sliwa JK, et al: Características farmacocinéticas de los antipsicóticos inyectables de acción prolongada para la esquizofrenia: una visión general. Fármacos para el SNC 2021; 35(1): 39-59.
- Toja-Camba FJ, Gesto-Antelo N, Maronas O, et al: Revisión de la farmacocinética y farmacogenética en los antipsicóticos atípicos inyectables de acción prolongada. Farmacéutica 2021; 13(7).
- Schoretsanitis G, Baumann P, Conca A, et al: Seguimiento terapéutico de fármacos antipsicóticos inyectables de acción prolongada. Ther Drug Monit 2021; 43(1): 79-102.
- Wu B, Wu L, He Y, et al.: Microesferas de PLGA de ingeniería para la liberación prolongada de brexpiprazol: estudios in vitro e in vivo. Desarrollo de fármacos y farmacia industrial 2021; 47(6): 1001-1010.
- Citrome L: Formulaciones inyectables de acción prolongada de aripiprazol para la esquizofrenia: aripiprazol monohidrato y aripiprazol lauroxil. Expert Rev Clin Pharmacol 2016; 9(2): 169-186.
- Hard ML, Mills RJ, Sadler BM, et al: Aripiprazol lauroxil: Perfil farmacocinético de este antipsicótico inyectable de acción prolongada en personas con esquizofrenia. J Clin Psychopharmacol 2017; 37(3): 289-295.
- Saucedo Uribe E, Carranza Navarro F, Guerrero Medrano AF, et al: Perfiles preliminares de eficacia y tolerabilidad de los antipsicóticos inyectables de acción prolongada de primera frente a los de segunda generación en la esquizofrenia: revisión sistemática y metaanálisis. J Psychiatr Res 2020; 129: 222-233.
- de Filippis R, De Fazio P, Gaetano R, et al: Antipsicóticos de acción prolongada actuales y emergentes para el tratamiento de la esquizofrenia. Expert Opin Drug Saf 2021; 20(7): 771-790.
- Yokoi F, Grunder G, Biziere K, et al.: Ocupación de los receptores D2 y D3 de la dopamina en humanos normales tratados con el fármaco antipsicótico aripiprazol (OPC 14597): estudio mediante tomografía por emisión de positrones y [11C]raclopride. Neuropsicofarmacología 2002; 27(2): 248-259.
- Mamo D, Graff A, Mizrahi R, et al: Differential effects of aripiprazole on D(2), 5-HT(2), and 5-HT(1A) receptor occupancy in patients with schizophrenia: a triple tracer PET study.[see comment]. Revista Americana de Psiquiatría 2007; 164(9): 1411-1417.
- Grunder G, Fellows C, Janouschek H, et al.: Farmacocinética cerebral y plasmática del aripiprazol en pacientes con esquizofrenia: un estudio [18F]fallypride PET. Am J Psychiatry 2008; 165(8): 988-995.
- Sparshatt A, Taylor D, Patel MX, Kapur S: Una revisión sistemática del aripiprazol: dosis, concentración plasmática, ocupación del receptor y respuesta: implicaciones para la monitorización terapéutica del fármaco. J Clin Psychiatry 2010; 71(11): 1447-1456.
- Girgis RR, Slifstein M, D’Souza D, et al: Unión preferente a los receptores dopaminérgicos D3 sobre los D2 por la cariprazina en pacientes con esquizofrenia mediante PET con el ligando del receptor D3/D2 [(11)C]-(+)-PHNO. Psicofarmacología (Berl) 2016; 233 (19-20): 3503-3512.
- Girgis RR, Forbes A, Abi-Dargham A, Slifstein M: Un estudio de ocupación con tomografía por emisión de positrones del brexpiprazol en los receptores de dopamina D2 y D3 y de serotonina 5-HT1A y 5-HT2A, y en los transportadores de recaptación de serotonina en sujetos con esquizofrenia. Neuropsicofarmacología 2020; 45(5): 786-792.
- Wong DF, Raoufinia A, Bricmont P, et al: Estudio abierto de tomografía por emisión de positrones sobre la ocupación del receptor estriatal D2/D3 y la farmacocinética de una dosis única oral de brexpiprazol en participantes sanos. Eur J Clin Pharmacol 2021;77(5): 717-725.
- Gründer G, Carlsson A, Wong DF: Mecanismo de los nuevos medicamentos antipsicóticos – La ocupación no es sólo antagonismo. Archivos de Psiquiatría General 2003; 60: 974-977.
- Hiemke C, Bergemann N, Clement HW, et al: Directrices de consenso para la monitorización terapéutica de fármacos en neuropsicofarmacología: Actualización 2017. Farmacopsiquiatría 2018; 51(1/2): 9-62.
- Schoretsanitis G, Kane JM, Correll CU, et al: Blood Levels to Optimize Antipsychotic Treatment in Clinical Practice: A Joint Consensus Statement of the American Society of Clinical Psychopharmacology and the Therapeutic Drug Monitoring Task Force of the Arbeitsgemeinschaft fur Neuropsychopharmakologie und Pharmakopsychiatrie. J Clin Psychiatry 2020; 81(3).
- Frampton JE: Brexpiprazol: una revisión en la esquizofrenia. Medicamentos 2019; 79(2): 189-200.
- Mucci F, Della Vecchia A, Baroni S, Marazziti D: La cariprazina como opción terapéutica para la esquizofrenia: una evaluación farmacológica. Expert Opin Pharmacother 2021; 22(4): 415-426.
- Laszlovszky I, Barabassy A, Nemeth G: Cariprazina, un antipsicótico de amplio espectro para el tratamiento de la esquizofrenia: farmacología, eficacia y seguridad. Adv Ther 2021; 38(7): 3652-3673.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al: Eficacia comparativa y tolerabilidad de 32 antipsicóticos orales para el tratamiento agudo de adultos con esquizofrenia multiepisódica: una revisión sistemática y un metaanálisis en red. Lancet 2019; 394(10202): 939-951.
- Watanabe Y, Yamada S, Otsubo T, Kikuchi T: Brexpiprazol para el tratamiento de la esquizofrenia en adultos: una visión general de su eficacia y seguridad clínicas y la perspectiva de un psiquiatra. Drug Des Devel Ther 2020; 14: 5559-5574.
- Kishi T, Ikuta T, Matsuda Y, et al: Aripiprazol frente a brexpiprazol para la esquizofrenia aguda: revisión sistemática y metaanálisis en red. Psicofarmacología (Berl) 2020; 237(5): 1459-1470.
- Citrome L, Ota A, Nagamizu K, et al: El efecto del brexpiprazol (OPC-34712) y el aripiprazol en pacientes adultos con esquizofrenia aguda: resultados de un estudio aleatorizado y exploratorio. Int Clin Psychopharmacol 2016; 31(4): 192-201.
- Nemeth G, Laszlovszky I, Czobor P, et al: Cariprazina frente a monoterapia con risperidona para el tratamiento de los síntomas negativos predominantes en pacientes con esquizofrenia: un ensayo aleatorizado, doble ciego y controlado. Lancet 2017; 389(10074): 1103-1113.
- Fleischhacker W, Galderisi S, Laszlovszky I, et al: La eficacia de la cariprazina en los síntomas negativos de la esquizofrenia: Análisis post hoc de los ítems individuales de la PANSS y de los factores derivados de la PANSS. Eur Psychiatry 2019; 58: 1-9.
- Sabe M, Zhao N, Crippa A, Kaiser S: Antipsicóticos para los síntomas negativos y positivos de la esquizofrenia: metaanálisis dosis-respuesta de ensayos aleatorizados controlados en fase aguda. NPJ Schizophr 2021; 7(1): 43.
- Leucht S, Crippa A, Siafis S, et al: Metaanálisis dosis-respuesta de fármacos antipsicóticos para la esquizofrenia aguda. Am J Psychiatry 2020;177(4): 342-353.
- Citrome L: El ABC de los agonistas parciales de los receptores de dopamina – aripiprazol, brexpiprazol y cariprazina: el reto de 15 minutos para clasificar estos agentes. Int J Clin Pract 2015; 69(11): 1211-1220.
- Citrome L: Efectos adversos activadores y sedantes de los antipsicóticos de segunda generación en el tratamiento de la esquizofrenia y el trastorno depresivo mayor: aumento absoluto del riesgo y número necesario para dañar. J Clin Psychopharmacol. 2017; 37(2): 138-147.
- Yoshida K, Takeuchi H: Efectos dependientes de la dosis de antipsicóticos sobre la eficacia y los efectos adversos en la esquizofrenia. Behav Brain Res 2021; 402: 113098.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al: Eficacia comparativa y tolerabilidad de 32 antipsicóticos orales para el tratamiento agudo de adultos con esquizofrenia multiepisódica: una revisión sistemática y un metaanálisis en red. Lancet 2019.
- Greger J, Aladeen T, Lewandowski E, et al: Comparación de las características metabólicas de los antipsicóticos de segunda generación más recientes: brexpiprazol, lurasidona, asenapina, cariprazina e iloperidona con la olanzapina como comparador. J Clin Psychopharmacol 2021; 41(1): 5-12.
- Labad J, Montalvo I, González-Rodríguez A, et al: Estrategias de tratamiento farmacológico para reducir la prolactina en personas con un trastorno psicótico e hiperprolactinemia: revisión sistemática y metaanálisis. Schizophr Res 2020; 222: 88-96.
- Tasaki M, Yasui-Furukori N, Kubo K, et al: Relación de las concentraciones de prolactina con las concentraciones plasmáticas en estado estacionario de aripiprazol en pacientes con esquizofrenia. Ther Drug Monit 2021; 43(4): 589-592.
- Thase ME, Zhang P, Weiss C, et al: Eficacia y seguridad del brexpiprazol como tratamiento adyuvante en el trastorno depresivo mayor: resumen de cuatro estudios a corto plazo. Expert Opin Pharmacother 2019; 20(15): 1907-1916.
- Kishi T, Sakuma K, Nomura I, et al: Brexpiprazol como tratamiento adyuvante para el trastorno depresivo mayor tras el fracaso del tratamiento con al menos un antidepresivo en el episodio actual: una revisión sistemática y metaanálisis. Int J Neuropsicofarmacol 2019; 22(11): 698-709.
- Lafreniere S, Picotte F, Legare N: Hipomanía en un hombre deprimido tras la introducción del brexpiprazol: A propósito de un caso. Encephale 2021;47(2): 185-186.
- Vieta E, Sachs G, Chang D, et al: Dos ensayos aleatorizados, doble ciego y controlados con placebo y un ensayo abierto a largo plazo de brexpiprazol para el tratamiento agudo de la manía bipolar. J Psicofarmacol 2021; 35(8): 971-982.
- Ali T, Sisay M, Tariku M, et al: Antipsychotic-induced extrapyramidal side effects: A systematic review and meta-analysis of observational studies. PLoS One 2021; 16(9): e0257129.
- Ali Z, Roque A, El-Mallakh RS: Una teoría unificadora para el mecanismo patoetiológico de la discinesia tardía. Med Hypotheses 2020; 140: 109682.
- Bashir HH, Jankovic J: Tratamiento de la discinesia tardía. Neurol Clin 2020; 38: 379-396.
- Amada N, Akazawa H, Ohgi Y, et al: El brexpiprazol tiene un bajo riesgo de sensibilización de los receptores D2 de dopamina e inhibe los fenómenos de rebote relacionados con los receptores D2 y 5-HT2A de serotonina en ratas. Neuropsicofarmacol Rep 2019; 39(4): 279-288.
- Carbon M, Kane JM, Leucht S, Correll CU: Riesgo de discinesia tardía con antipsicóticos de primera y segunda generación en ensayos controlados aleatorizados comparativos: un metaanálisis. Psiquiatría Mundial 2018; 17(3): 330-340.
- Grossberg GT, Kohegyi E, Mergel V, et al: Eficacia y seguridad del brexpiprazol para el tratamiento de la agitación en la demencia de Alzheimer: dos ensayos aleatorizados, doble ciego y controlados con placebo de 12 semanas de duración. Am J Geriatr Psychiatry 2020; 28(4): 383-400.
- Aftab A, Lam JA, Liu F, et al: Avances recientes en psicofarmacología geriátrica. Expert Rev Clin Pharmacol 2021; 14(3): 341-355.
- Ishigooka J, Usami T, Iwashita S, et al: Análisis post-hoc que investiga la seguridad y la eficacia del brexpiprazol en pacientes japoneses con esquizofrenia a los que se cambió de otros antipsicóticos en un estudio a largo plazo (Publicación secundaria). Neuropsychopharmacol Rep. 2020;40(2): 122-129.
- Ichinose M, Miura I, Horikoshi S, et al: Efecto del cambio a brexpiprazol sobre los niveles plasmáticos de ácido homovanílico y los efectos secundarios relacionados con los antipsicóticos en pacientes con esquizofrenia o trastorno esquizoafectivo. Neuropsychiatr Dis Treat 2021; 17: 1047-1053.
- Stahl SM: Psicofarmacología esencial de Stahl: bases neurocientíficas y aplicación práctica.4ª ed. Nueva York, EE.UU.: Cambridge University Press; 2013: 626.
- Bandelow B, Meier A: Aripiprazol, un “estabilizador del sistema dopamina-serotonina” en el tratamiento de la psicosis. Revista alemana de psiquiatría 2003; 6: 9-16.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2021; 19(6): 12-23